アプリケーションノート
定量的発光アッセイを用いたウイルス誘発性細胞変性効果の測定
利点
- 簡易な添加と測定の方法で、試薬添加後わずか10 分で結果を取得
- スクリーニングに適した安定した高感度の発光測定
- SoftMax Pro ソフトウェアを用いて自動でデータ作成と結果解析が可能
SpectraMax iD5マルチモードマイクロプレートリーダーについて問い合わせる
はじめに
哺乳類細胞のウイルス感染は、多くの場合細胞生存能を低下させ、形状や大きさの変化、隣接する細胞との融合など、細胞に視覚的な影響を引き起こします。これらの変化は細胞変性効果(CPE)と呼ばれ、光学顕微鏡やイメージングシステムを用いた評価、あるいはより定量的な方法を用いて測定されます。
PromegaのViral ToxGlo Assay Kitは細胞のATPを測定します。ATPは生存可能な細胞に存在し、発光測定を用いた細胞生存能を定量するための簡単な指標となります。ウイルス誘発性CPEによってATPが枯渇すると発光シグナルが減少することを利用して、宿主細胞のウイルス誘発性CPEを定量できます。アッセイ結果は、簡易な添加と測定のワークフローを用いて、SpectraMax®iD5マルチモードマイクロプレートリーダーで簡単に検出でき、SoftMax®Proソフトウェアで解析できます(図1)。
本稿では、Viral ToxGlo アッセイを使用してウイルス感染哺乳類細胞のウイルス感染価および組織培養感染量(TCID₅₀)を測定する方法、ならびに化合物の抗ウイルス活性を測定する方法について述べます。本稿で紹介する研究は、これまでに発表されている 2 つのウイルス感染モデルを用い、Madin-Darby イヌ腎臓(MDCK)細胞にインフルエンザ(H1N1)ウイルスを感染させ¹、MRC-5 ヒト肺線維芽細胞にヒトコロナウイルス 229E 株(HCoV-229E)を感染させました²。抗ウイルス活性があることが実証されている2つの化合物、リバビリン³とレムデシビル⁴をウイルスに曝露させた細胞に添加し、それぞれの抗ウイルス活性を測定しました。
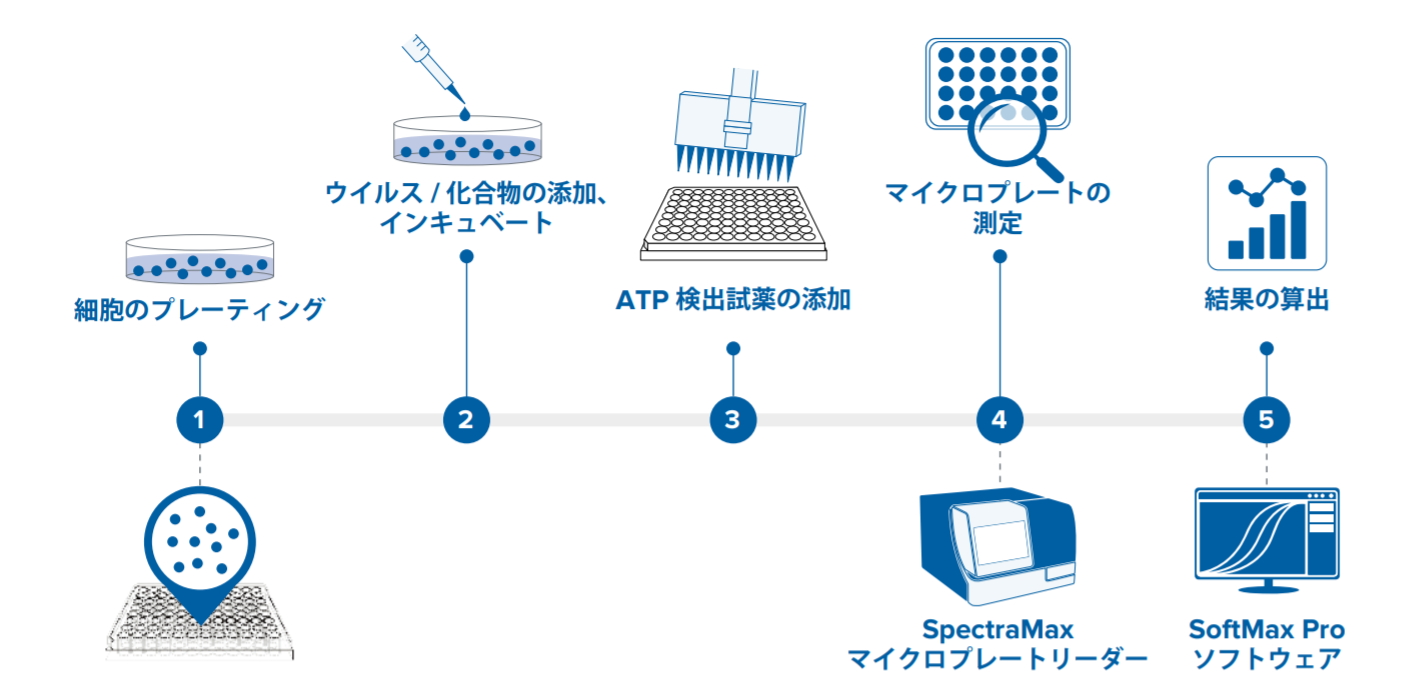
図1 – フラッシュおよびグロー反応
材料
- Viral ToxGlo Assay Kit(Promega cat. #G8942)
- MDCK(NBL-2)細胞株(ATCC cat. #CCL-34)
- MRC-5 細胞株(ATCC cat. #CCL-171)
- 増殖培地(MDCK および MRC-5 用): MEM(Corning cat. #10-010-CV)+ 10% ウシ胎児血清(FBS, Avantor® Seradigm cat. #1500-500)+ペニシリン / ストレプトマイシン(Thermo Fisher cat. #15070-063)
- インフルエンザ A 型ウイルス(H1N1)、(ATCC cat. #VR-95PQ)
- ヒトコロナウイルス 229E(ATCC cat. #VR-740)
- リバビリン(Sigma cat. #R-9644)
- レムデシビル(MedChemExpress cat. #HY-104077)
- 96 ウェル白色組織培養処理透明底マイクロプレート(Corning cat. #3610)
- Nunc 白シーリングテープ(ThermoFisher cat. #236272)
- SpectraMax iD5 マルチモードマイクロプレートリーダー(Molecular Devices)
方法
TCID₅₀の決定
ウイルスストックを段階希釈し、指定された曝露時間、標的細胞 に添加することで、ウイルスの感染性と組織培養感染量(TCID)を決定しました。曝露終了時、Viral ToxGlo アッセイを用いて細胞生存能の指標となるATP を測定しました。測定した細胞生存能を50% 低下させたウイルス希釈率が、TCID₅₀ または50%細胞変性効果(CPE)の値となります。この値を用いて、抗ウイルス剤の活性に関する次の試験を行いました。
透明底96 ウェル白色マイクロプレートに、10,000 cells/ ウェルの密度で細胞をプレーティングしました。細胞を接着させて37℃、5% CO₂で一晩培養しました。培地で希釈して、最初の希釈率が1:1000(H1N1)または1:5(HCoV-229E)のウイルスストックを作製しました。最初のウイルス希釈液46 μL をカラム1 のウェルに加え(最初の容量は100 μL/ ウェル)、次にカラム1 から46 μL をカラム2 に移し、カラム10 までこれを繰り返すことで、細胞プレートでHalf-log(3.16 倍)の段階希釈を行いました。次にカラム10 から46 μL を取り除き、実験ウェルの容量が100 μL/ ウェルになるようにしました。ウイルスが入っていない対照ウェルと無細胞の対照ウェルも加えました。細胞をウイルスと共に3 日間(MDCK/H1N1)または6 日間(MRC-5/HCov-229E)、37℃、5% CO₂でインキュベートしました。
細胞変性効果をViral ToxGlo kit で測定しました。3 または6 日間のウイルス処理終了時に、ウェルをアッセイするためにウェルにATP 検出試薬を添加し、プレートを室温で10 分間インキュべートして細胞を溶解させました。発光シグナルを最大化させるため、測定の前に、それぞれの透明底マイクロプレートの底にNunc 白シーリングテープを貼りました。表1 に示した設定で、SpectraMax iD5 リーダーでプレートを測定しました。
SoftMax Pro ソフトウェアの4 パラメータカーブフィットを用いてRLU 対ウイルス希釈率で結果をプロットし、これらの曲線からそれぞれの細胞株に対する各ウイルスのTCID₅₀ 値を得ました(図2)。H1N1 ウイルスストックの999,000 倍希釈で、MDCK生存能が50% 低下しました。一方、MRC-5 細胞では、HCoV-229E ウイルスストックの43 倍希釈で同様な生存能の低下が認められました。
| パラメータ | 設定 |
| 測定モード | 発光 |
| 測定タイプ | エンドポイント |
| 波長 | 全波長 |
| プレートタイプ | 96 ウェルCostar |
| PMT およびオプティクス | 積分時間:1000 ms 読み取り高さ:1.12 mm |
| その他の設定(More settings) | 読み取り前最適化オプションを表示する(Show pre-read optimization options) |
表1 Viral ToxGlo アッセイのためのSpectraMax iD5 リーダーの設定。 設定はSoftMax Pro ソフトウェアのプレートセクションで指定します。読み取り高さは、「その他の設定(More settings)」にある「読み取り前最適化オプションを表示する(Show Pre-Read Optimization Options)」の隣のボックスをチェックし、読み取りが開始時に表示される指示に従って最適化します。
化合物の抗ウイルス活性の測定
ウイルス処理細胞の細胞変性効果低減におけるリバビリンとレムデシビルの有効性を評価するため、透明底96 ウェル白色マイクロプレートに、培地50 μL 中10,000 cells の密度でMDCK またはMRC-5 細胞をプレーティングしました。培地のみを含む無細胞の対照ウェルも加えました。細胞を接着させて37℃、5%CO₂インキュベーターで一晩培養しました。
MDCK 細胞に、1:3 で段階希釈したリバビリン(1000 μM ~0.02 μM)25 μL を添加しました。MRC-5 細胞に、1:3 で段階希釈したレムデシビル(17 μM ~ 0.003 μM)25 μL を添加しました。MDCK またはMRC-5 細胞に、それぞれ最適細胞変性効果を示すTCID₅₀を超えるストックウイルスの希釈液(H1N1では1:1000、HCov-229E では1:5)を、1 ウェルあたり25 μL添加しました。化合物のオフターゲット細胞毒性を評価するため、前述と同じ化合物希釈シリーズを用いて、ウイルスを含まない細胞にリバビリンまたはレムデシビルを添加しました。処理した細胞プレートを37℃、5% CO₂で3 日間(MDCK)または6 日間(MRC-5)インキュベートしました。
ウイルスおよび化合物と共にインキュベートした後、アッセイウェルにViral ToxGlo ATP 検出試薬を添加し、プレートを室温で10 分間インキュベートして細胞を溶解させました。透明底マイクロプレートの底にNunc 白シーリングテープを貼ってから、SpectraMax iD5 リーダーで発光シグナルを測定しました(設定、表1)。
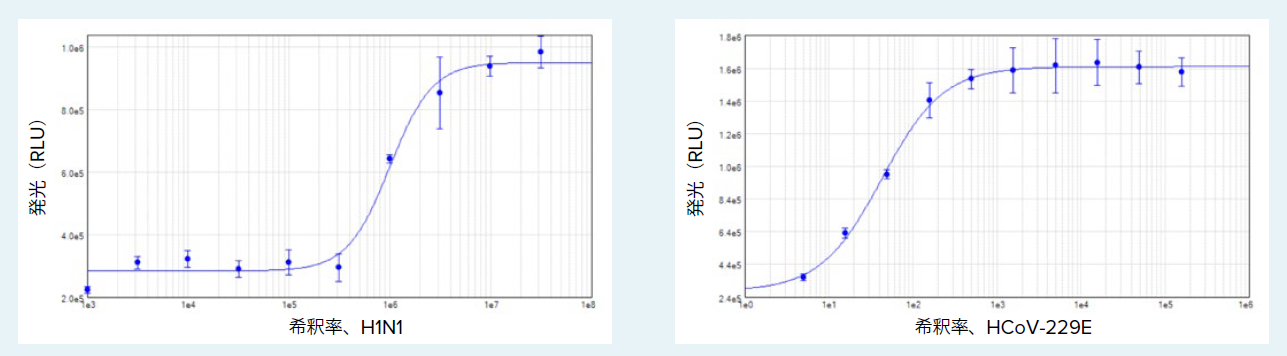
図2 – MDCK 細胞におけるH1N1 ウイルス(A)およびMRC-5 細胞におけるHCoV-229E ウイルス(B)の濃度反応曲線。TCID₅₀はH1N1 では1:999,000 希釈、HCoV-229E では1:43 希釈。
SoftMax Pro ソフトウェアの4 パラメータカーブフィットを用いてRLU 対化合物濃度で結果をプロットし、曲線から各化合物のEC50 値を得ました。リバビリンはH1N1 ウイルスに曝露させたMDCK 細胞の生存能を部分的にレスキューし、EC50 は89 μMでした(図3A)。しかし、ウイルス未感染細胞をリバビリン単独で処理したとき、100 μM 以上で毒性効果が認められました。HCoV-229E 存在下でMRC-5 細胞をレムデシビルで処理した場合、生存能はほぼ完全にレスキューされ、EC50 は215 nM でた(図3B)。レムデシビルのオフターゲット効果は最低限であり、16 μM を超えたときのみに認められました。

図3 – MDCK のみまたはH1N1 ウイルスで処理したMDCK に対するリバビリン(A)、およびMRC-5 のみまたはHCoV-229E ウイルス処理したMRC-5 に対するレムデシビル(B)の、オフターゲット(緑)およびオンターゲット(赤)効果。リバビリンEC50= 89 μM、レムデシビルEC50= 215 nM。
結論
ウイルス感染により誘導される細胞生存能への影響の評価について、時間のかかる顕微鏡法と比較して、Viral ToxGlo アッセイは、簡易な添加と測定の方法で行えます。結果の検出と解析は、試薬を処理細胞に添加してからわずか10 分間で行えます。SpectraMax iD5 リーダーでは、このアッセイを非常に高感度で検出でき、SoftMax Pro ソフトウェアでは、TCID₅₀ならびに抗ウイルス物質のオンターゲット効果およびオフターゲット効果を簡単に決定できます。
References
- Niles, A et al. Determine Viral-Induced Cytopathic Effect Using a Luminescent Assay: https://www.promega.com/ resources/pubhub/determine-viral-induced-cytopathic-effectusing- a-luminescent-assay/
- Funk, CJ et al. Infection of human alveolar macrophages by human coronavirus strain 229E. J. Gen. Virol. (2012), 93, 494–503
- Khalili, JS et al. Novel coronavirus treatment with ribavirin: Groundwork for an evaluation concerning COVID-19. J. Med. Virol. 2020; 1–7.
- Parang, K et al. Comparative antiviral activity of remdesivir and anti-HIV nucleoside analogs against human coronavirus 229E (HCoV-229E). Molecules 2020, 25, 2343.
