アプリケーションノート
生細胞タイムラプスイメージングによる
細胞遊走の測定
利点
- 再現性が高く、自動化できる細胞遊走アッセイの実施
- 重要なタイムポイントのみデータ取得することにより、時間とストレージスペースを削減
- プレート全体の継時変化を一度に視覚化
- ハイコンテントアナリシスによる信頼性の高い統計データ
このページは、自動翻訳ツールを用いて制作されているため、正確でない表現が含まれている可能性があります。原文は下記よりダウンロードできます。
ImageXpress Pico自動細胞イメージングシステムについて問い合わせる
はじめに
細胞遊走は胚発生、創傷治癒、癌転移および免疫学的反応を含む多くの生物学的事象に重要な過程です。多くの場合、サイトカインシグナルおよびケモカイン濃度勾配に応答して自然免疫系が活性化する中、免疫細胞は損傷組織を除去し、組織を再生するために炎症部位に移動します1,2。一方で、免疫細胞の移動と蓄積は、関節リウマチのような多くの自己免疫疾患の発症にもつながります3。さらに、癌患者の癌微小環境における細胞運動性の増加は、癌の予後を悪化させる可能性があります4。治療法や薬剤を開発するために特定の疾患の病因を研究する際には、細胞運動性を測定することが重要になる場合があります。 培養細胞に手作業でスクラッチ(引っかき傷)をいれ、創傷領域への細胞移動を観察することにより細胞運動性を測定することがありますが、手作業で傷を作るのは大変 で、時間もかかるため、ハイスループットスクリーニング研究には適していません。
このアプリケーションノートではハイスループットで細胞遊走アッセイ(図1)を行うために、細胞遊走イメージングとそのリアルタイム解析を96または384ウェルのマイクロプレートで実施する方法を示します。Platypus Technologies社によって開発された細胞遊走アッセイは、細胞遊走能に影響を与える化合物を再現性良くスクリーニングすることを可能にします。まず、細胞をアプライ後に溶解する生物適合性ゲルを含むマイクロプレート中に播種し、細胞を含まない無細胞ゾーンを作製します。播種から数時間後、ImageXpressTMPico自動細胞イメージングシステムを使用して画像取得を開始し、細胞の無細胞領域への遊走を測定します。
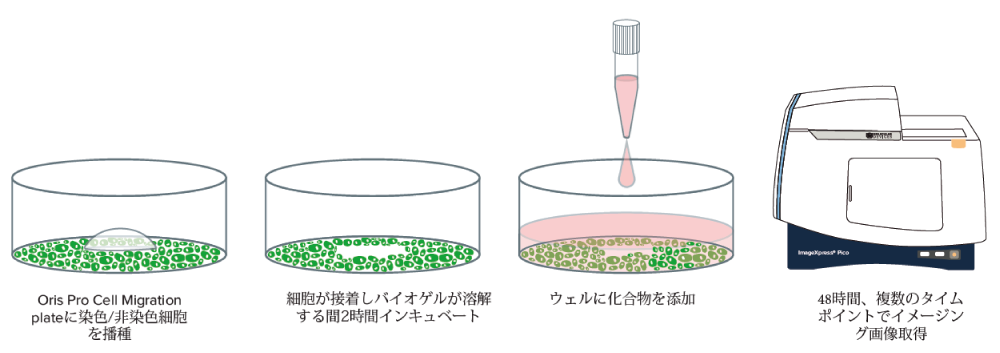
図1 ImageXpress Pico自動細胞イメージングシステムを用いた細胞遊走アッセイ
化合物が細胞遊走に及ぼす影響を測定するため、培養開始後2~48時間の間で複数のタイムポイントで、イメージング画像を取得した。
CellReporterXpressTM細胞画像取得・解析ソフトウェアに搭載されたディスコンティニュアスタイムラプス機能では、イメージングシステムを占有することなく、異なる時点で取得されたウェルを1つのファイルに保存し、タイムラプス実験としてシームレスに分析およびプロットすることができます。このアプローチを用いて化学療法化合物であるサイトカラシンD、コルヒチン、およびノコダゾールで処理したHT1080(線維肉腫)細胞における創傷治癒の差異を示すことに成功しました。
材料
- HT 1080 線維肉腫細胞株(ATCC, P/N CCL-121)
- SiR-Actin Kit
(Cytoskeleton Inc., P/N CY-SC001) - シトシンß-D-アラビノフラノシド塩酸塩 (Ara C)
(Sigma Aldrich, P/N C1768) - OrisTM Pro Cell Migration Assay (PlatypusTechnologies, P/N PRO384CMA1)
- ImageXpress Pico自動細胞イメージングシステム (Molecular Devices)
- CellReporterXpress画像取得・解析ソフトウェア(Molecular Devices)
方法
HT1080細胞をシトシンß-D-アラビノフラノシド塩酸塩 (Ara C)およびSiR-Actin、それぞれ最終濃度20μMおよび0.1μMで処理しました。Ara Cは細胞分裂を阻害するため、無細胞ゾーンにおける細胞の存在が細胞分裂ではなく細胞遊走のみに起因することを保証できます。SiR-Actinは生細胞のアクチンを染色する毒性の低い蛍光色素です。処理後の細胞を384ウェルのOris Pro Cell Migration plateに濃度1万細胞/ウェル、容量30μLで播種し、インキュベーターに戻しました。 2時間後、細胞が付着し、ゲルが溶解したのち、30μLの化学療法化合物を、細胞を播種したウェルに添加しました。細胞は、ImageXpress Picoシステムのディスコンティニュアスタイムラプスを用いて、イメージングしました。この機能により、タイムラプス撮影の間システムを占有してラボの他の研究者が実験を行うことを妨げることなく、45時間の間、8つのタイムポイントでプレートを撮影することができました。 この機能では、シームレスなタイムラプス解析のために撮影した画像を一つの実験に追加していきます。また、細胞が完全に無細胞ゾーンに移動するのには数日かかることがありますので(図2)、余分なデータを生成せずにストレージスペースを節約します。4倍の倍率において、全ウェルの単一画像を、透過光(5 ms未満の露光)およびCy5蛍光(500~1000msの露光)の両方を用いて取得しました。透過光画像解析と蛍光画像解析それぞれに対して最適化した分析プロトコルを用い、画像取得と並行して数値結果を生成しました(図3)。 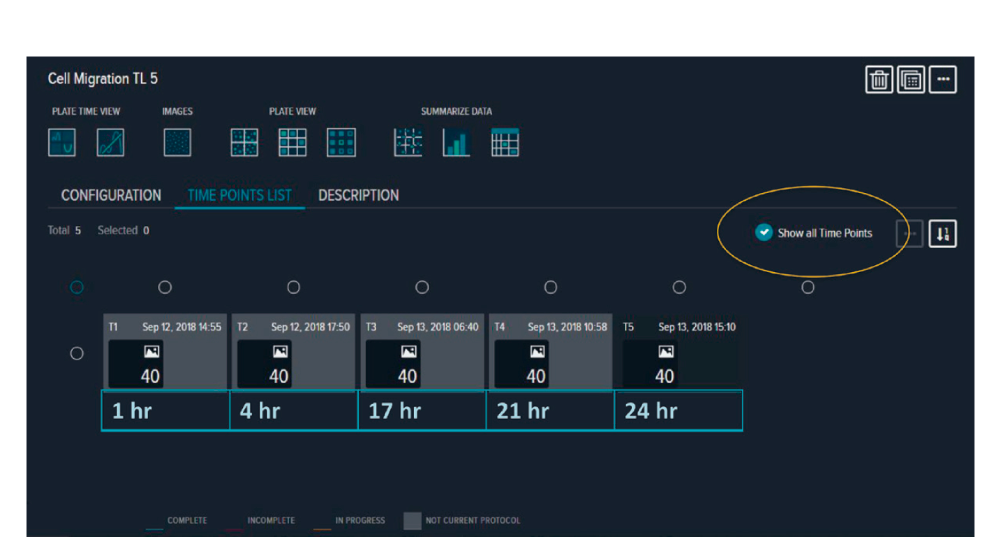
図2 各タイムポイントの間隔を設定した、ディスコンティニュアスタイムラプス実験
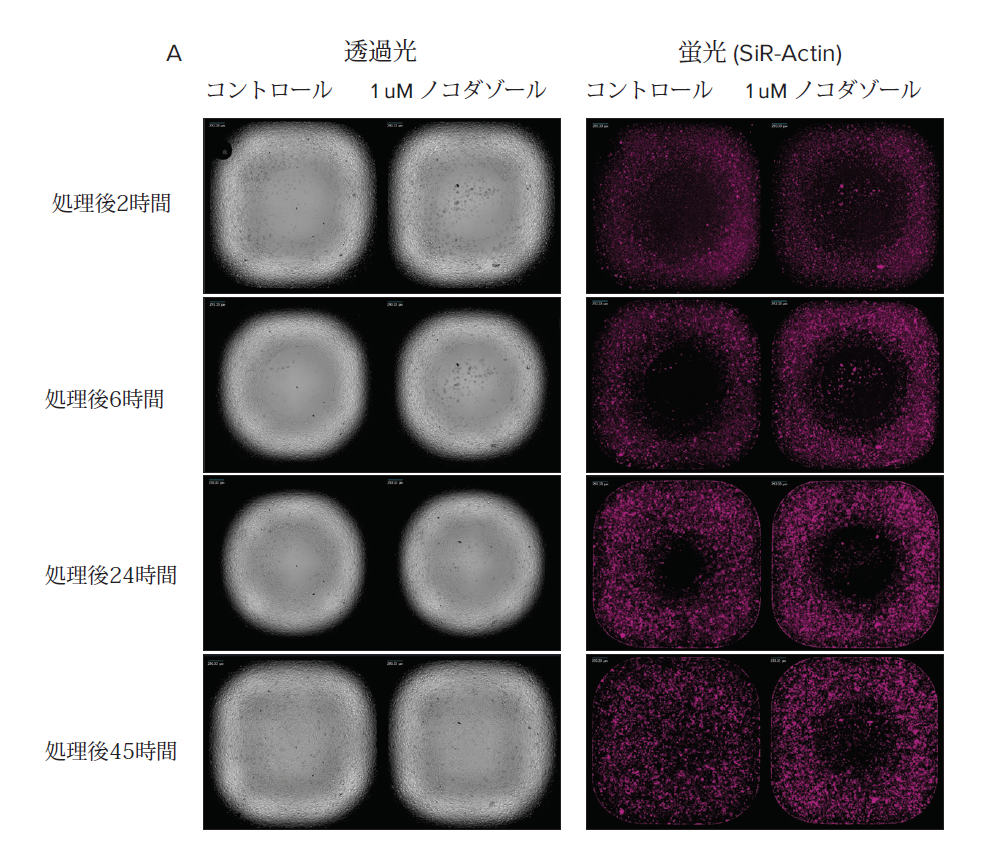
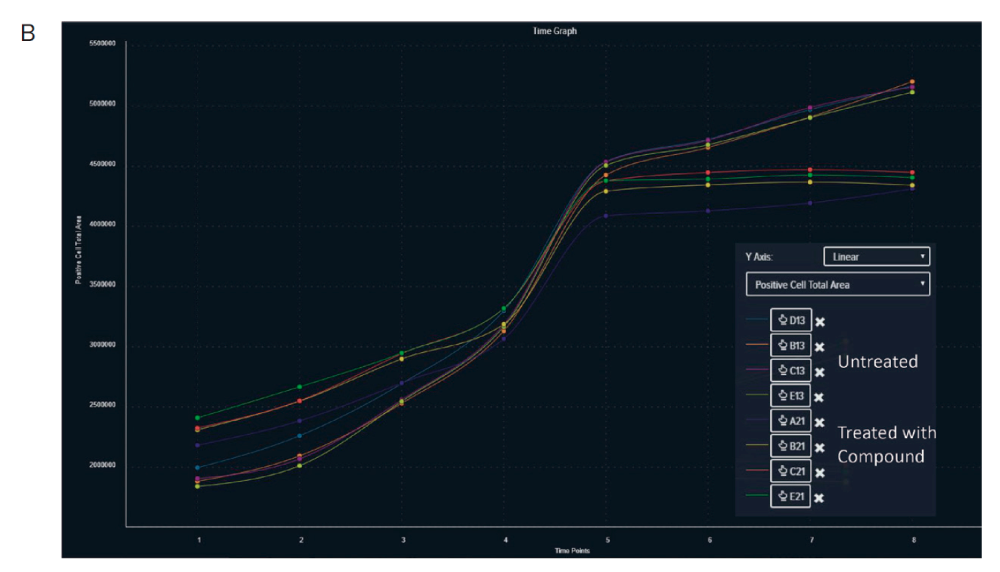
図3
A 透過光および蛍光 (SiR-Actin)イメージングによるHT 1080細胞の例
右に1 μMノコダゾールで処理した細胞、左にコントロールをそれぞれ4つのタイムポイントで示す。ノコダゾールにより細胞の排除ゾーンへの移動が抑制されている。 B.CellReporterXpressソフトウェアにより 排除ゾーンへの細胞の遊走を視覚化
未処理のコントロール細胞はノコダゾールで処理した細胞よりも早く遊走している。
期待された通り、コルヒチン、サイトカラシンDおよびノコダゾールにより処理した細胞は、対照細胞と比較して、有意に細胞遊走を減少させ、サイトカラシンDは細胞遊走を最も阻害しました(図4)。SiR‐Actinで染色した細胞を用いた蛍光イメージングでも、細胞遊走の減少が観察されました(図5)。これは、蛍光SiR-Actin標識の有無にかかわらず、細胞移動アッセイを実施できることを示唆しています。 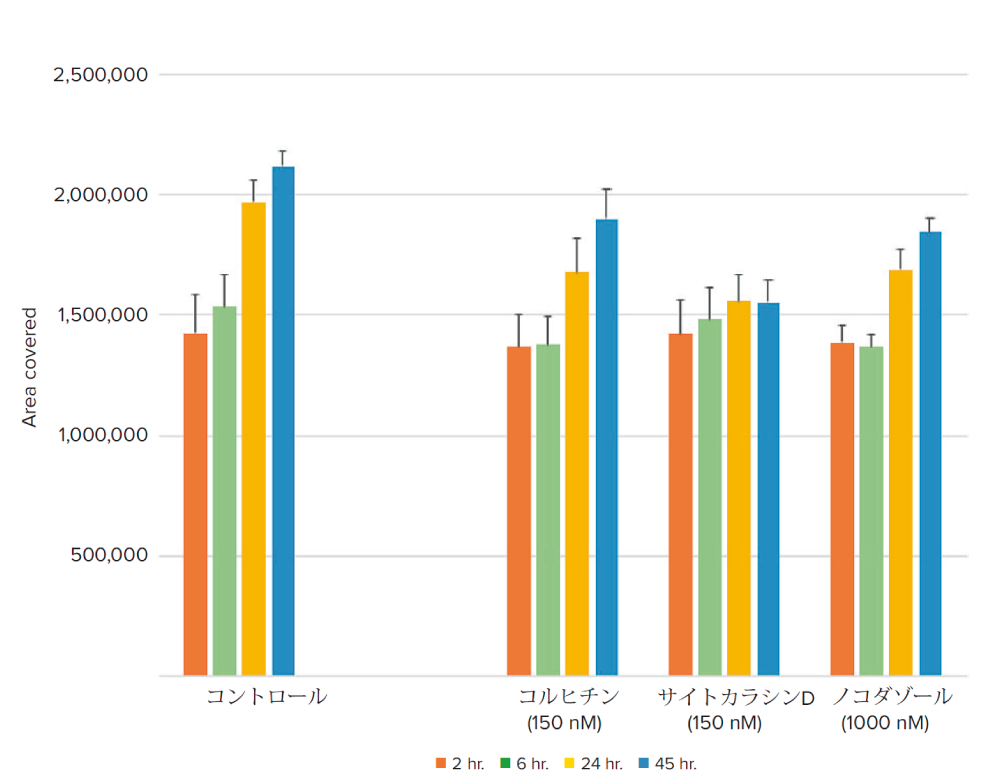
図4 透過光を用いたタイムラプス解析により、化合物処理されたウェルでは細胞遊走が減少していることが示された
サイトカラシンDは最も長時間にわたり遊走を抑制する効果を示した。
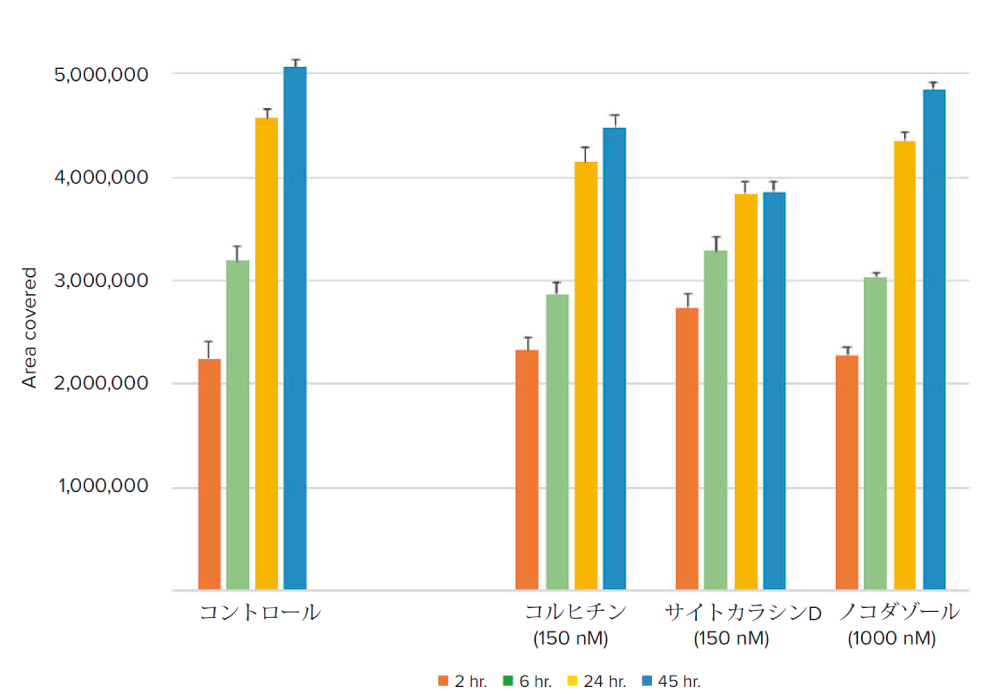
図5 蛍光ラベルした細胞のタイムラプス解析により、化合物処理されたウェルでは細胞遊走が減少していることが示された
データは透過光を用いて測定したデータと一貫していた。
まとめ
ImageXpress Pico自動細胞イメージングシステムおよびCellReporterXpress画像取得・解析ソフトウェアを用いて、384ウェルのOris Proマイクロプレート中で培養したHT1080細胞の遊走を45時間にわたりタイムラプス撮影し、解析した。予想されたように、化学療法化合物コルヒチン、サイトカラシンD、およびノコダゾールによる処置は、対照と比較して細胞遊走の速度を有意に低下させた。透過光および蛍光を用いて得られたデータは相関を示し、細胞が実験の経過中に色素を保持できる限り、SiR-Actinのような蛍光染色により標識された細胞においても細胞遊走を観察ことができます。ImageXpress Picoのシステムを使えば、研究者は無細胞エリアへの移動を、長時間にわたり定量化することができます。タイムラプス画像は、指定したインターバルで自動的に取得することができます。装置が生細胞を維持するために必要な環境制御オプションを備えていない場合や、長いタイムラプス実験の間に研究室の他のユーザが同じ装置を用いて画像を取得する必要がある場合などでも、手動でプレートを装置の内外に移動させることにより、タイムラプス画像を取得することができます(ディスコンティニュアスタイムラプス)。 ImageXpress Picoは、96、384ウェルのOris Proマイクロプレートを用いて、低倍率対物レンズ(4倍または10倍)にてこのアッセイを実施できます。1ウェル内で複数の視野が必要になる場合には、CellReporterXpressソフトウェアが自動的に各視野をつなぎ合わせます。このソフトウェアにプリセットされた透過光または蛍光イメージング用プロトコルを単層細胞で覆われた面積を定量するためにセットアップするのは容易で、また、画像の取得と並行して解析結果を得ることができます。
このページは、自動翻訳ツールを用いて制作されているため、正確でない表現が含まれている可能性があります。原文は下記よりダウンロードできます。
ImageXpress Pico自動細胞イメージングシステムについて問い合わせる
参考文献
- Barrett CS, Millena AC, Khan SA. (2017) TGF-ßEffects on Prostate Cancer Cell Migration andInvasion Require FosB. Prostate 77(1):72-81
- Julier Z, Park AJ, Briguez PS, Martino MM.(2017) Promoting tissue regeneration bymodulating the immune system. Acta Biomater53:13-28
- Nevius E, Gomes AC, Pereira JP. (2016)Inflammatory Cell Migration in RheumatoidArthritis: A Comprehensive Review. Clin RevAllergy Immunol 51(1):59-78
- Shiraishi M, Shintani Y, Ishida H, Saba R,Yamaguchi A, Adachi H, Yashiro L, Suzuki K.(2016) Alternatively activated macrophagesdetermine repair of the infarcted adult murineheart. J Clin Invest 126(6):2151-66
