アプリケーションノート
FlexStation 3 マイクロプレートリーダーを用いたデュアルルシフェラーゼ発現検出
利点
- 1 列単位での分注と同時検出による高いアッセイスループット
- 1 ウェルあたりわずか10 個の細胞数でホタルおよびウミシイタケルシフェラーゼの発現を検出
- プリセットされているプロトコルにより効率的なアッセイ設定と速やかな結果の取得が可能
FlexStation 3 マイクロプレートリーダーについて問い合わせる
はじめに
レポーター遺伝子アッセイは、細胞経路の活性化に伴う遺伝子発現の研究に重要なツールです。レポーター遺伝子と対象とする遺伝子配列(通常はプロモーターまたはその他の転写制御因子)を含むプラスミドを細胞にトランスフェクトします。プロモーターが活性化されると、レポーター遺伝子が発現し、その発現レベルを測定することができます。
ホタルルシフェラーゼは、広く使用されているレポーター遺伝子です。その発光シグナルを利用することにより、蛍光や他の手法よりも優れた感度が得られます。2 つ目の発光レポーターであるウミシイタケルシフェラーゼは、トランスフェクション効率や細胞数などのばらつきを標準化する目的で構成的プロモーターの制御下でよく使用されます。ホタルルシフェラーゼとウミシイタケルシフェラーゼの基質は異なるため、デュアルルシフェラーゼ検出アッセイを用いることにより両方の発光シグナルを同一のウェルで測定できます。
SpectraMax® DuoLuc Reporter Assay Kit を用いることにより、マイクロプレートのフォーマットで、ホタルルシフェラーゼとウミシイタケルシフェラーゼ両方の発光シグナルの高感度な定量が可能となります。試料ウェルにホタルルシフェラーゼ標準溶液以下、ホタル標準溶液)を添加するとホタルルシフェラーゼの発光反応が開始し、次にウミシイタケルシフェラーゼ標準溶液(以下、ウミシイタケ標準溶液)を添加するとホタルルシフェラーゼの発光が抑制され、同時にウミシイタケルシフェラーゼの反応が開始します。
FlexStation® 3 マルチモードマイクロプレートリーダーは、96および384 ウェルのフォーマットのSpectraMax DuoLuc アッセイを、高感度およびハイスループットで行うことができます。FlexStation 3リーダーでは、同時かつオンボードでの試薬ピペッティング・発光検出により、一連の反応をリアルタイムでモニタリングすることができます(図1)。
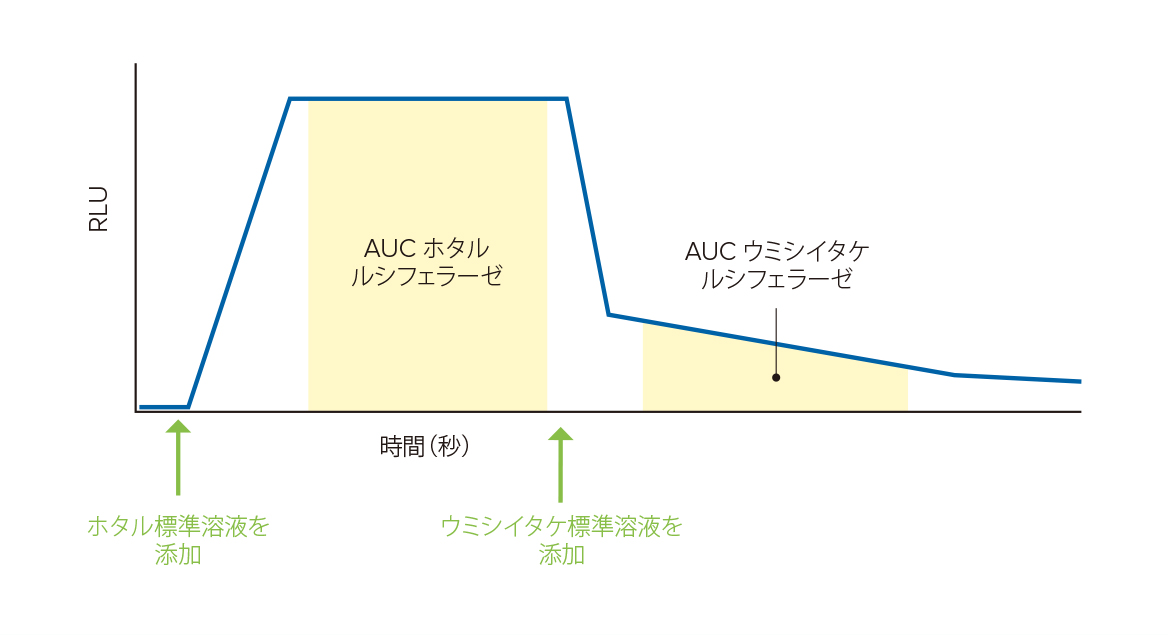
図1 FlexStation 3 リーダーを用いた試薬添加からの反応のリアルタイムモニタリング。
各反応フェーズ(ホタルルシフェラーゼおよびウミシイタケルシフェラーゼ)に相当する曲線下面積(AUC)をソフトウェアで算出する。
材料
- FlexStation 3 マルチモードマイクロプレートリーダー(Molecular Devices cat. #Flex3)
- FlexStation 3 8 チャンネルピペッターヘッド(Molecular Devices cat. #0200-6182)
- FlexStation 3 16 チャンネルピペッターヘッド(Molecular Devices cat. #0200-6183)
- 96 ウェルBlack FlexStation ピペットチップ(Molecular Devices cat. #0900-0911)
- 384 ウェルBlack FlexStation ピペットチップ(Molecular Devices cat. #9000-0764)
- SpectraMax DuoLuc Reporter Assay Kit(Molecular Devices cat. #R8361)
- HeLa 細胞(ATCC cat. #CCL-2)
- pGL4.13[luc2/SV40] ホタルルシフェラーゼ発現ベクター(Promega cat. #E668A)
- pGL4.75[hRluc/CMV] ウミシイタケルシフェラーゼ発現ベクター(Promega cat. #E693A)
- ViaFect™ トランスフェクション試薬(Promega cat. #E4981)
- Opti-MEM Reduced Serum Medium(ThermoFisher Scientific cat. #31985062)
方法
細胞のトランスフェクション
トランスフェクションに先立ち、組織培養用に処理した6 ウェルプレートに、1 ウェルあたり2 × 105 個のHeLa 細胞を播種し、37 ℃、5% CO2 にて24 時間培養しました。Opti-MEM 培地を用い、ホタルルシフェラーゼ発現ベクターpGL4.13[luc2/SV40] を1 μg/μL、ウミシイタケルシフェラーゼ発現ベクターpGL4.75[hRluc/CMV] を100 ng/μL となるように希釈しました。3 本のチューブに次の組成の混合物を準備し、穏やかに撹拌しました:Opti-MEM 培地400 μL、ホタルルシフェラーゼ発現ベクターpGL4.13[luc2/SV40] 2 μL(2 μg)、ウミシイタケルシフェラーゼ発現ベクターpGL4.75[hRluc/CMV] 2 μL(200 ng)。それぞれのチューブにViaFect 試薬6 μL を添加し、穏やかに混合しました。チューブを室温で10 分間インキュベートし、トランスフェクション複合体を形成させました。トランスフェクション複合体200 μL を6 ウェルプレートの各ウェルに滴下し、穏やかに撹拌して混合しました。細胞をインキュベーターに戻して48 時間培養し、処理後にアッセイに用いました。
| パラメーター | 96 ウェル | 384 ウェル |
|---|---|---|
| 測定モード | 発光 | |
| 測定の種類 | Flex | |
| 波長 | 全波長 | |
| 積算時間 | 200 ms | |
| 総測定時間 | 2分 | 3分40秒 |
| 測定間隔 | 3.4秒 | 5.2秒 |
| 1番目の化合物の添加 | ホタル溶液100μLを添加 高さ = 50μL 添加速度 = 4 添加時間 = 20秒 |
ホタル溶液25μLを添加 高さ = 25μL 添加速度 = 4 添加時間 = 20秒 |
| 2番目の化合物の添加 | ウミシイタケ溶液100μLを添加 高さ = 150μL 添加速度 = 4 添加時間 = 60秒 |
ウミシイタケ溶液100μLを添加 高さ = 75μL 添加速度 = 4 添加時間 = 70秒 |
| 撹拌 | 1 番目の化合物の添加後 高さ = 50μL サイクル = 2 容量 = 50μL 2番目の化合物の添加後 高さ = 100μL |
1 番目の化合物の添加後 高さ = 25μL サイクル = 2 容量 = 25μL 2番目の化合物の添加後 高さ = 25μL |
| データ計算 | ホタル:20 ~ 67秒 ウミシイタケ:68 ~ 120秒 |
ホタル:20 ~ 80秒 ウミシイタケ:80 ~ 220秒 |
表1 FlexStation 3 マイクロプレートリーダーの化合物添加およびアッセイパラメーター。
細胞溶解液の調製
6 ウェルプレートの各ウェルのトランスフェクション済み細胞をトリプシン処理し、10 等分量に分け、1500 rpm で5 分間遠心処理して得られたペレットをPBS で1 回洗浄しました。PBS を取り除き、細胞ペレットをアッセイ時まで-80 ℃で保存しました。
アッセイの準備として、Passive Lysis Buffer および細胞ペレットを室温に戻し、各細胞ペレットを150 μL のPassive LysisBuffer で溶解しました。室温に15 分間置いて細胞を溶解しました。次に、1 ウェルあたりの細胞数が4 ~ 8700 個の範囲の標準曲線を得るため、Passive Lysis Buffer を用いて細胞溶解液を2 倍段階希釈しました。各濃度の細胞溶解液を、96 ウェルプレートの3ウェルにそれぞれ20 μLずつ添加し、384ウェルプレートの4 ウェルにそれぞれ10 μL ずつ添加しました。
ルシフェラーゼアッセイの手順
キットのすべての構成品を室温で解凍しました。Firefly Substrate(凍結乾燥品)1 バイアル2.2 mg に水220 μL を加えました。Aquaphile™ セレンテラジン(凍結乾燥品)1 バイアル440 μgに水220 μL を加えました。
ホタル標準溶液は、ホタルルシフェラーゼ基質をFirefly AssayBuffer で50 倍に希釈して調製しました。ウミシイタケ標準溶液は、Aquaphile セレンテラジンをRenilla Assay Buffer で50倍に希釈して調製しました。96 ウェルプレート1 枚に対して、対応する基質を220 μL 加えて11 mL の標準溶液を調製しました。
表1 に示したパラメータと、SoftMax® Pro ソフトウェアにプリセットされたプロトコルを使用しました。ソフトウェアのグラフィカルなインターフェースにより、化合物添加を簡単に設定することができました(図2)。FlexStation 3 マイクロプレートリーダーは、1 列ごとに試薬を分注することができ、測定の種類としてFlex を用いることで、これらのウェルを設定した時間において繰り返し測定することが可能です。各試料のリアルタイムカイネティックトレースが作成されます。各カイネティックトレース内において、ホタルルシフェラーゼとウミシイタケルシフェラーゼのシグナルは区別でき、曲線下面積を算出できます(図3)。
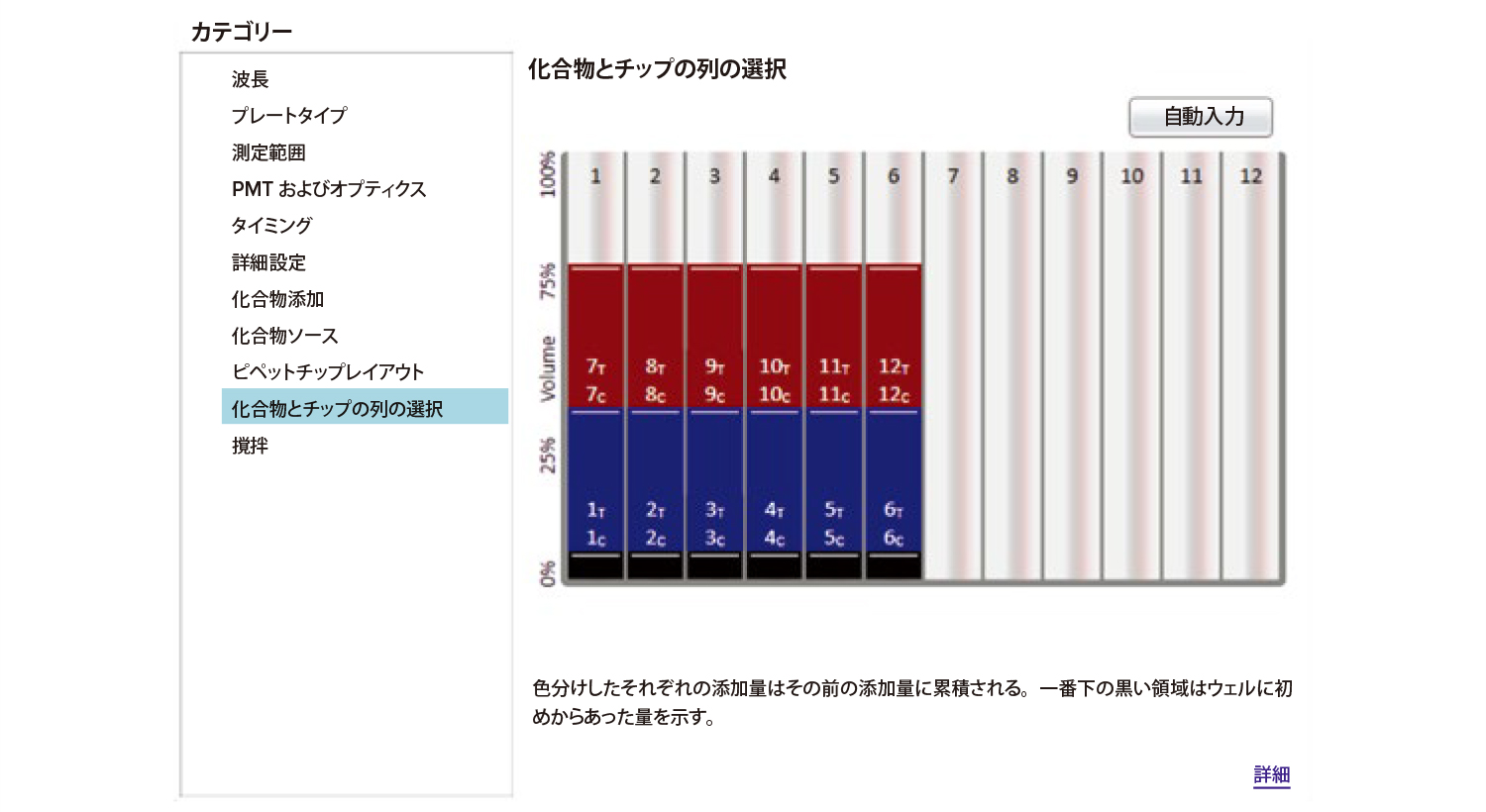
図2 FlexStation 3 マイクロプレートリーダー用SoftMax Pro 7 ソフトウェアのユーザーインターフェース。
ソフトウェアのインターフェースは分かりやすく、チップと化合物の列の選択が簡単に行えるようになっている。
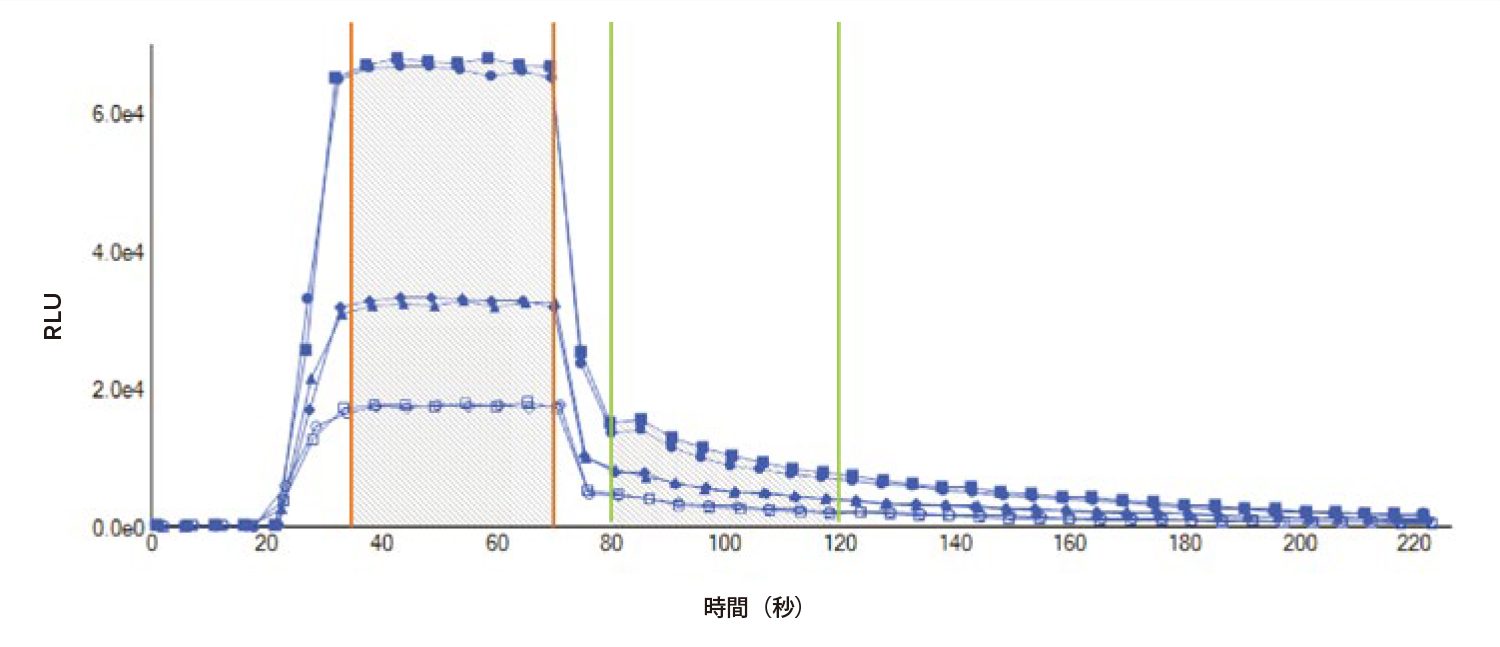
図3 DuoLuc カイネティックトレース。DuoLuc レポーターアッセイの発光シグナルを経時的に記録し、カイネティックトレースを作成した。384ウェルプレートで3種類の濃度の細胞をアッセイした結果を示した。カイネティックトレースにおける、ホタルルシフェラーゼの曲線下面積(35 ~ 70秒)、およびウミシイタケルシフェラーゼの曲線下面積(80 ~ 120秒)を表示した。20秒と70秒の時点で試薬を添加した。
結果
トランスフェクションしたHeLa 細胞のホタルルシフェラーゼとウミシイタケルシフェラーゼを、SpectraMax DuoLuc レポーターアッセイとFlexStation 3 マイクロプレートリーダーを用いて測定しました。96 ウェルプレートで行ったアッセイでは、優れた直線性と感度が認められました。1 ウェルあたりの細胞数が8700 から約4 個までの範囲で、ホタルルシフェラーゼとウミシイタケルシフェラーゼの両方の発光を検出できました(図4)。
384 ウェルプレートでのアッセイ性能は同等であり、同程度の直線性と、1 ウェルあたりの細胞数が最低約8 個での検出が認められました(図5)。
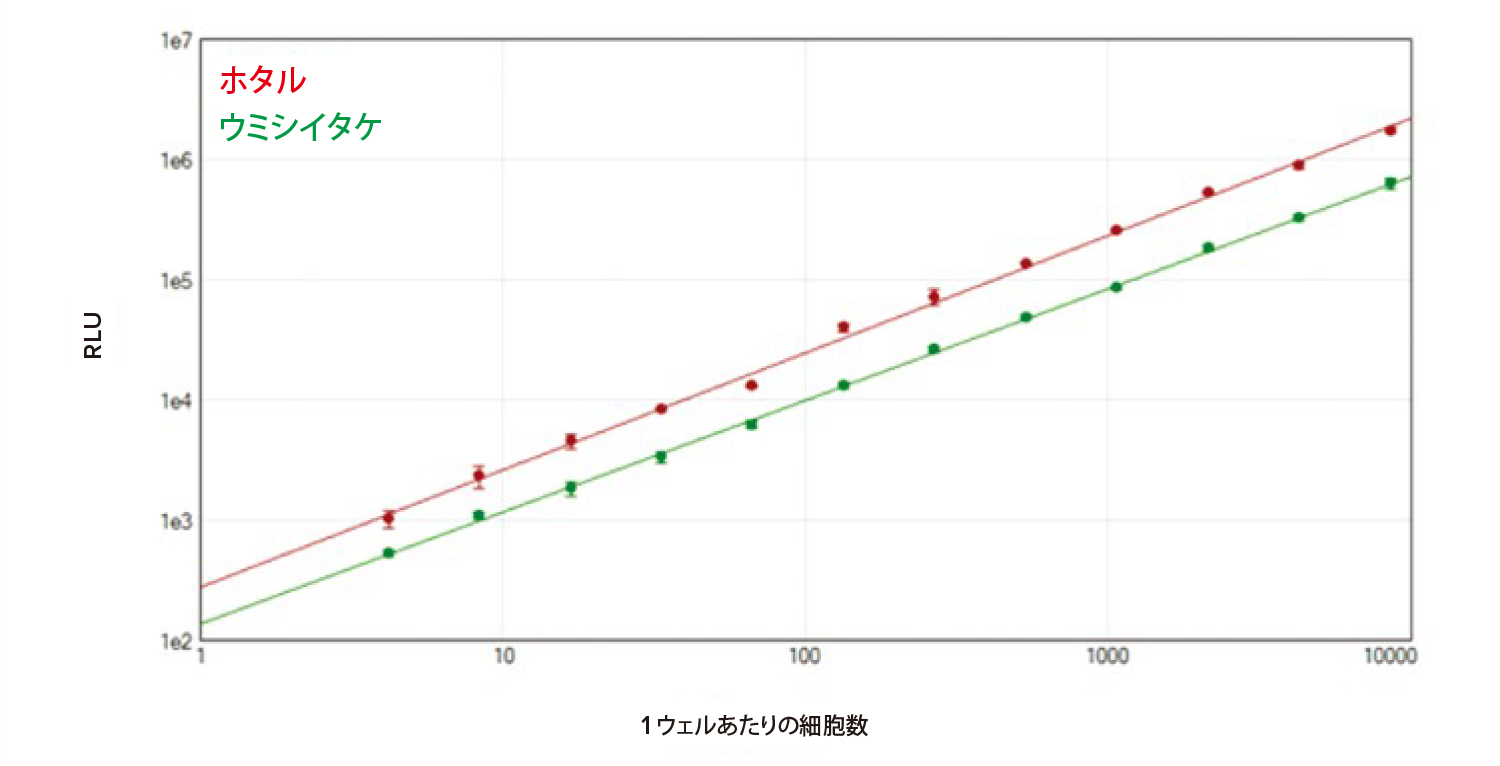
図4 96 ウェルのフォーマットで行ったDuoLuc レポーターアッセイ。FlexStation 3 マイクロプレートリーダーを用いて96 ウェルプレート上でDuoLucレポーターアッセイを行った。SoftMax Pro ソフトウェアのlog-log カーブフィットを用い、ホタルルシフェラーゼ(赤)、およびウミシイタケルシフェラーゼ(緑)の標準曲線をプロットした(それぞれr2 > 0.998)。各濃度について3回ずつ測定を行った。
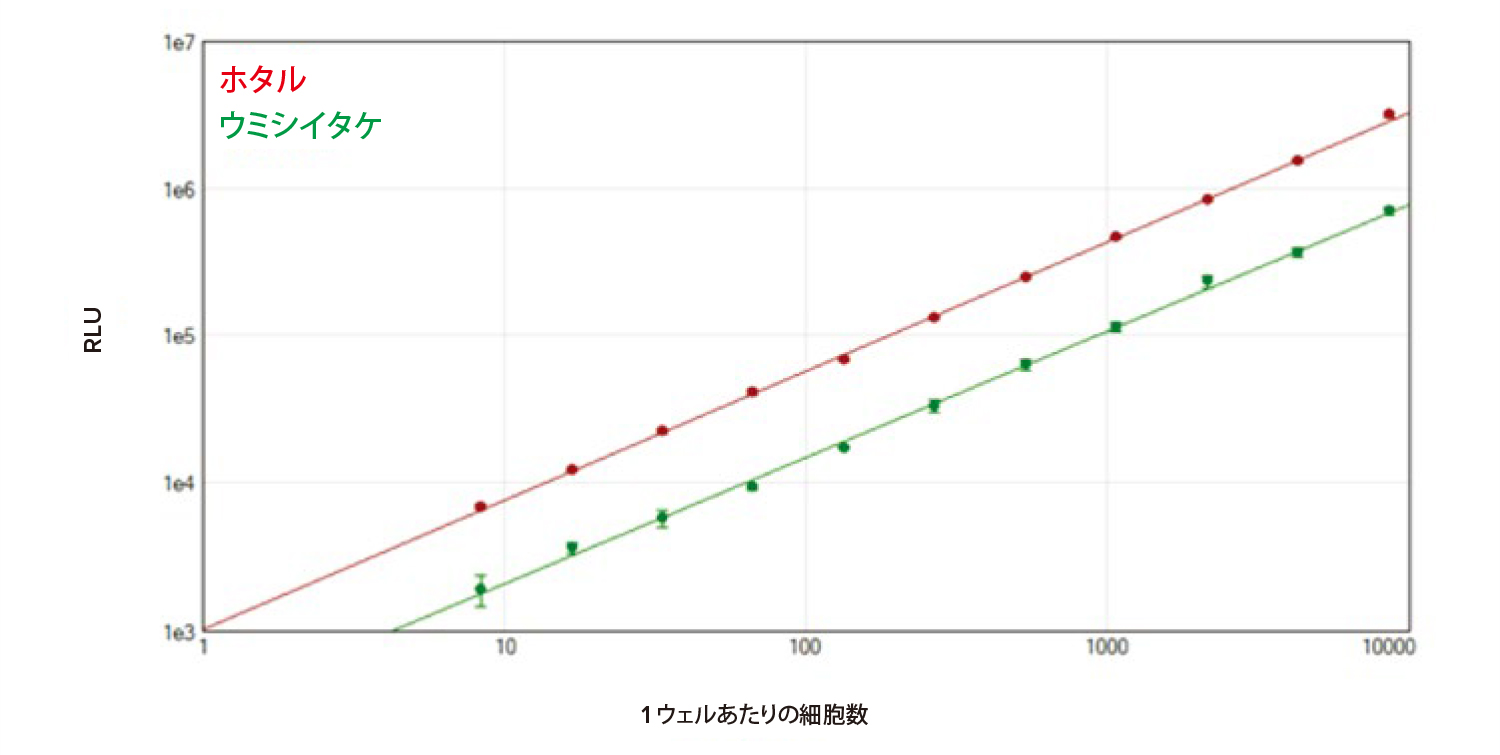
図5 384 ウェルのフォーマットで行ったDuoLuc レポーターアッセイ。384 ウェルプレート上でSpectraMax DuoLucレポーターアッセイを行った。SoftMax Pro ソフトウェアのlog-log カーブフィットを用い、ホタルルシフェラーゼ(赤)、およびウミシイタケルシフェラーゼ(緑)の標準曲線をプロットした(それぞれr2 > 0.998)。各濃度について4 回ずつ測定を行った。
結論
液体工学と発光検出技術を搭載したFlexStation 3 マイクロプレートリーダーを用いることで、SpectraMax DuoLucレポーターアッセイは、哺乳類細胞の遺伝子発現を正確に測定できる高感度なフラッシュ型発光アッセイとなります。このリーダーは、試薬を1列ごとに分注でき、また、設定した総測定時間をとおして1列単位でウェルを繰り返し測定できるため、デュアルインジェクターを用いたシステムよりも高いアッセイスループットが達成されます。SoftMax Pro ソフトウェアの直感的なインターフェースとプリセットされたプロトコルにより、デュアルルシフェラーゼアッセイの設定、実施、解析が速やかに行えます。
FlexStation 3 マイクロプレートリーダーについて問い合わせる
