2025/8/5
3Dオルガノイドと2D細胞株:創薬・疾患研究の新時代
By Katya Mameishvili, Ph.D., for Biocompare
創薬において、より予測性が高く正確なモデルが求められる中、従来の2D細胞培養の限界はますます明らかになっています。3Dオルガノイドスクリーニングは、生理学的により正確な代替手段を提供しますが、独自の課題も伴います。本記事では、創薬における3Dオルガノイドと2D細胞株の利点と制約を検討し、ハイスループット用途や今後の展望に関する重要な考慮事項を紹介します。
3Dオルガノイドと2D細胞株の利点と制約
「2D培養で細胞を育てることは、そのシンプルさ、低コスト、高度に制御された条件により、創薬や疾患モデル化における長年の主流でした」と、ATCCのBioNexus主任研究員Carolina Lucchesi博士は述べています。しかし、2D培養では、in vivoで見られる酸素や糖の勾配、3Dの細胞間相互作用、細胞外マトリックス成分といった重要な微小環境シグナルが欠如しており、組織の複雑性を再現する能力が制限されます。
これに対し、3Dオルガノイドは臓器の構造や機能をより忠実に模倣することで、生理学的関連性の高いモデルを提供します。「この改善された生理学的関連性により、薬効や毒性の予測精度が向上し、偽陽性や偽陰性のリスクを低減します」と、モレキュラーデバイスのオルガノイドイノベーションディレクターNikki Carter氏は述べています。オルガノイドは、候補薬がヒト組織とどのように相互作用するかを早期に把握でき、治療効果と潜在的な副作用の両方をより正確に特定するのに役立ちます。「このレベルの洞察により、研究者は早期に失敗を見極め、より有望な候補に投資を集中できます」と、MilliporeSigma(Merck KGaA, Darmstadt, Germanyのライフサイエンス事業)のCell Biology Reagents & Tools部門R&D責任者Vi Chu氏は付け加えています。
患者由来オルガノイドは、特に腫瘍学において、薬剤応答の個体差を捉えることで個別化医療を支援します。「シングルセル型で構成され、時間とともにゲノム変化を蓄積することが多い2Dモデルとは異なり、オルガノイドは多様な細胞型、遺伝子変異、周囲の微小環境を含む体の複雑性をより正確に反映します」とChu氏は説明します。「2Dモデルで有望とされた薬剤候補が、患者由来オルガノイドでは同様に効果を示さない場合があります。」
その組織様の性質により、オルガノイドは予測毒性学においても有効なツールとなり、肝臓や腎臓などの臓器での潜在的副作用の検出を可能にします。「3Dモデルでは、2Dで安全と見なされた化合物を、より現実的な環境で試験できます」とLucchesi氏は述べています。複数の研究で、さまざまな組織タイプにおける高い感度と特異性が確認されています *1-3。
しかし、利点がある一方で、3Dオルガノイドは培養やスケール化の一貫性に課題があり、専門的な知識、ワークフロー、資材を必要とする場合があります。2D細胞培養と比較して、コストが高く、スループットも低い傾向があります。「オルガノイドは依然として血管構造や動的な液体流動といった重要なin vivo特徴を欠いており、予測精度に影響を与える可能性があります」とLucchesi氏は指摘しています。
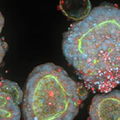
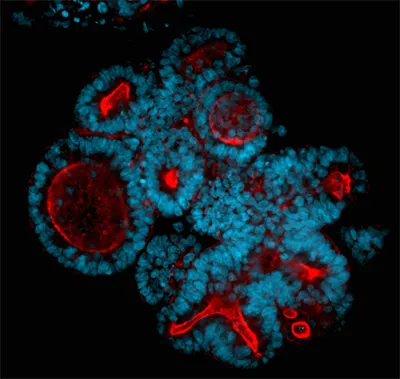
患者由来の大腸がんオルガノイド。核をHoechst(青)、アクチンフィラメントをファロイジン(緑)、ミトコンドリアをMitoTracker(赤)で染色。画像は共焦点スピニングディスクを搭載したImageXpress® HCS.ai ハイコンテントスクリーニングシステムで取得。写真提供:モレキュラーデバイス。
適切なモデルの選択
2Dモデルと3Dモデルの選択は、研究課題、疾患の複雑性、プロジェクトの段階に依存します。「2D細胞培養は、創薬初期において大規模な化合物ライブラリーをスクリーニングする際に特に有用です。これは、より複雑で生理学的に関連性の高い3Dモデルに移行する前に、有望な候補を効率的に絞り込むことができるためです」とLucchesi氏は述べています。
パイプラインが絞られ、生理学的関連性の必要性が高まるにつれ、3Dオルガノイドの有用性は増します。「より生理学的に関連性の高いモデルを提供することで、3Dオルガノイドは前臨床試験の予測力を高めます」とCarter氏は説明します。オルガノイドは、メカニズム研究や複雑な疾患のモデル化に特に適しており、in vivoに近い応答が重要な領域—がん、神経疾患、感染症、MASHのような代謝性疾患、IBDなどの消化器疾患—で活用されます。さらに、オルガノイドは浸潤・遊走アッセイ、腫瘍-ストローマ相互作用、薬剤耐性プロファイリングにも有用です。
生理学的関連性を超えて、オルガノイドは動物試験への依存を減らし、研究における遺伝的多様性を広げることにも貢献します。「オルガノイドは、遺伝的に多様な集団を研究に反映させる機会を生み出し、科学者が過小評価されている患者集団における薬物相互作用をよりよく理解できるようにします」とChu氏は指摘します。
「実際には、両システムは相補的な強みを活かして併用される可能性が高く、より複雑なモデル(マイクロフィジオロジカルシステムなど)を構築するための細胞ソースとして利用されることもあります」とLucchesi氏は結論づけています。
ハイスループットスクリーニングへの3Dシステム移行
ハイスループット用途で2Dから3D培養システムへ移行する際には、一貫性とスケーラビリティを備えたオルガノイド生産といった技術的課題が生じます。2D細胞株とは異なり、オルガノイドはより複雑で精密な成長条件—特殊な培地、足場または細胞外マトリックス、長い培養期間—を必要とし、環境変化に敏感でスケール化が困難です。
アッセイの互換性も課題です。従来の2Dアッセイは3Dシステムにうまく適用できないことが多いため、「研究者は3Dオルガノイドでエンドポイントを正確に測定できるよう、アッセイを最適化または新規開発する必要があります」とCarter氏は述べています。Lucchesi氏は、足場材料が自己蛍光などのバックグラウンドノイズを引き起こし、シグナル検出を複雑にする可能性があると付け加えています。
Chu氏は、患者由来オルガノイドへのアクセス制限や高い生産コストといったシステム的課題を指摘します。「遺伝的多様性は、効果的な患者層別化や異なる集団が薬物治療にどのように応答するかを理解するために不可欠です」と彼女は説明します。また、Chu氏は、グローバルな標準化、データ統合、研究コミュニティにおけるオルガノイドの広範な受容の必要性も強調しています。
細胞のばらつきへの対応も懸念事項です。「細胞型の比率、培養内での配置、さらには3D培養のサイズまでが変動し、大きなばらつきを生じます」とLucchesi氏は述べています。研究者は、96ウェルや384ウェルのスフェロイドシステムなど、マイクロプレート対応の小型フォーマットを活用し、自動液体ハンドリングやイメージングシステムと統合することでこれに対応しています。ハイドロゲル足場、マイクロ流体技術、バイオプリンティングの進歩も、微小環境と均一性の制御を改善しています。
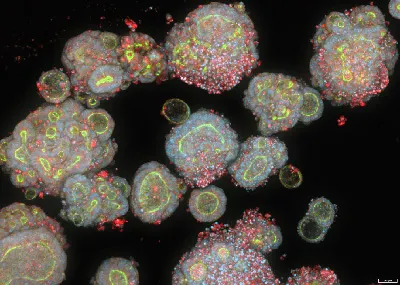
患者由来の大腸がんオルガノイド。ImageXpress® HCS.ai ハイコンテントスクリーニングシステムで撮像。Hoechst染色で核を、ファロイジンでF-アクチンを可視化。写真提供:モレキュラーデバイス
モレキュラーデバイスは、大量の均一なオルガノイドを生産する課題を克服するため、CellXpress.ai 自動細胞培養システムのようなツールを開発しました。「このシステムは培養プロセスを自動化し、一貫した品質を確保しながら、培養からエンドポイントアッセイへの移送ステップを削減することで、プレート内でのオルガノイドのスケーラブルな生産を可能にします」とCarter氏は説明します。同社の3D Readyオルガノイドは、患者由来のアッセイ対応オルガノイドを研究者に提供し、スケールアップを支援します。
モレキュラーデバイスのIN Carta 画像解析ソフトウェアは、高度なAIを用いて、3Dオルガノイドのハイスループットスクリーニングから生成される膨大なデータセットを処理し、複雑な画像を容易に解釈可能な結果に変換します。これにより、2D、3D、さらには4D実験もサポートします。「ユーザーフレンドリーなワークフローにより、研究者は高度にカスタマイズされた画像解析プロトコールを作成でき、最も複雑なアッセイでも堅牢な結果を得ることができます」とCarter氏は述べています。
アッセイ面では、自動化されたハイコンテントイメージングと機械学習の組み合わせが、豊富で実用的なデータを抽出するための推奨アプローチとなりつつあります。最終的には、培養プロトコールとデータ解析の標準化が、3Dハイスループットスクリーニングをスケーラブルで信頼性の高い創薬ツールにするために不可欠です。
3Dオルガノイドの今後
専門家は、オルガノイドの複雑性、自動化、データ統合の進展を予測しています。「上皮細胞と免疫細胞の共培養など、より複雑な細胞構成をサポートする改良された培養システムは、オルガノイドの生理学的関連性をさらに高めるでしょう」とChu氏は述べています。Carter氏は、バイオプリンティングの進歩により、複数の細胞型を精密に空間配置し、患者特異的なオルガノイドモデルを作成して、個別化治療に対応できるようになると付け加えています。
自動化は依然として主要な焦点です。「自動化されたオルガノイド形成は、一貫性とスケーラビリティを改善し、ハイスループットスクリーニングを支援し、再現性のある患者特異的3Dモデルを生成することで個別化医療を推進します」とLucchesi氏は述べています。また、iPSCリプログラミングの進歩が精密医療を牽引し、実験間での信頼性と再現性を高めると指摘しています。
Chu氏は、ゲノム、トランスクリプトーム、プロテオーム、メタボローム、エピゲノムデータをハイコンテントイメージングや薬剤応答プロファイルと統合するマルチオミクス統合プラットフォームの台頭を予測しています。こうしたシステムにより、研究者は患者由来オルガノイドを分子レベルと表現型レベルで比較し、バイオマーカーを特定し、患者応答を層別化し、薬剤感受性や耐性の予測を洗練できます。
新たに登場するOrgan-on-a-chip(臓器チップ)システムは、複数の臓器モデルにわたる薬剤効果のリアルタイムモニタリングを可能にするかもしれません。「長期的なビジョンは、ヒト・オン・チップです—複数のオルガノイドを組み合わせ、1つの薬剤が複数の臓器にどのように影響するかを理解することです」とChu氏は述べています。
Lucchesi氏は、AIが薬剤応答予測とターゲット同定を効率化し、3Dモデルの採用を加速すると予測しています。また、オルガノイドデータを他のモデルと統合するための明確な意思決定フレームワークの必要性も強調しています。
最後に、FDAやEMAなどの規制当局によるガイダンスは、オルガノイドベースのアッセイが信頼性、再現性を備え、品質基準を満たすことを保証するために不可欠です。Carter氏は次のように述べています。「3Dオルガノイドの可能性を最大限に活用するには、学術界、産業界、政府の共同努力が必要です」。
参考文献
- Bell, C.C., Dankers, A.C.A., Lauschke, V.M., et al. (2018). Comparison of Hepatic 2D Sandwich Cultures and 3D Spheroids for Long-term Toxicity Applications: A Multicenter Study. Toxicol Sci, 162(2):655-666.
- Caleb, J., Yong, T. (2020). Is It Time to Start Transitioning From 2D to 3D Cell Culture? Front Mol Biosci, 7:33.
- Imamura, Y., Mukohara, T., Shimono, Y., et al. (2015). Comparison of 2D- and 3D-culture models as drug-testing platforms in breast cancer. Oncology Reports, 33, 1837-1843.
この記事はBiocompareに掲載されたものを許可を得て転載したものです。