Application Note ウェルからウェスタンブロットへ
細胞のヒートショック応答解析
- 染色なしで細胞増殖をモニターします
- 蛍光細胞イメージングで細胞死のメカニズムを調べます
- 1つのプラットフォームで細胞のイメージング、セルベースアッセイの実施、ウェスタンブロットの検出が可能です
PDF版(英語)
はじめに
細胞応答の解析には、イメージング、セルベースの生存率や増殖アッセイ、タンパク質発現変化を確認するウェスタンブロットなど、複数の情報取得手法が必要になることがあります。必要な結果を得るために複数の装置プラットフォームを使用し、さらに複数のソフトウェアを習得しなければならない場合もあります。
本テクニカルノートでは、SpectraMax® i3 マルチモードマイクロプレートリーダーを用いて、複数の関連する細胞パラメータのデータを1台の装置で取得する方法をご紹介します。ヒートショックをモデルシステムとして、イメージングやウェスタンブロットスキャンを含む異なる検出モードを活用し、多面的な細胞応答に関する洞察を得る方法を示します。
細胞を通常より高い温度に曝露すると、アポトーシス経路が活性化されるとともに、ヒートショックタンパク質HSP70の発現が増加することが知られています。CHO-K1細胞を健常条件とストレス条件の2種類で培養し、ヒートショック処理後にSpectraMax i3システムのイメージング機能を用いて増殖、生存率、アポトーシスを評価しました。さらに、ヒートショック応答でアップレギュレーションされるHSP70の発現を、ScanLater™ ウェスタンブロット検出システムで解析しました。
- CHO-K1細胞(ATCC)
- 細胞培養培地(10%ウシ胎児血清および1%ペニシリン/ストレプトマイシン含有Ham's F12)
- 黒壁透明底組織培養マイクロプレート(Corning)
- SpectraMax i3 マルチモードマイクロプレートリーダー(モレキュラーデバイス)
- SpectraMax MiniMax™ 300 イメージングサイトメーター(モレキュラーデバイス)
- EarlyTox Cell Integrity Kit(モレキュラーデバイス)
- CellEvent Caspase-3/7 Green 検出試薬(Life Technologies)
- ScanLaterウエスタンブロット検出システム(モレキュラーデバイス)
- ScanLater:ユーロピウム標識ヤギ抗マウス抗体付き抗マウス評価キット(モレキュラーデバイス)
- ScanLaterウェスタンブロット検出カートリッジ(モレキュラーデバイス)
- 抗HSP70マウスモノクローナル抗体(R&D Systems)
- Immobilon-FL Membrane, 0.45 μm pore size (EMD Millipore)
方法
CHO-K1細胞を健常群とストレス群の2種類で準備しました。健常細胞は定期的に培地を交換し、コンフルエンス80%以下で継代しました。一方、ストレス細胞は過度にコンフルエントになるまで培養し、培地交換頻度を減らしました。
オールインワンソリューション SpectraMax® MiniMax™ 300 イメージングサイトメーター、ScanLater™ ウェスタンブロットカートリッジ、最適化された試薬、業界をリードするデータ取得・解析ツールSoftMax® Proなどのオプションを備えたSpectraMax i3xマルチモードマイクロプレートリーダーは、細胞経路やタンパク質の活性化・発現を1つのシステムで探索できます。
ヒートショック前日に、健常またはストレス細胞をイメージングおよびセルベースアッセイ用に、黒壁透明底の96ウェル組織培養マイクロプレートに1ウェルあたり7,500細胞で播種しました。ウェスタンブロット用サンプルは、6ウェルプレートに1ウェルあたり225,000細胞で播種しました。
播種翌日、細胞プレートの半分を45°Cで90分間ヒートショック処理しました。処理直後、SpectraMax MiniMax 300イメージングサイトメーターの透過光(TL)チャンネルで細胞を撮像し、形態変化を確認しました。ヒートショック後6時間および24時間で再度イメージングを行い、増殖を測定し形態を再評価しました。StainFree™ テクノロジーを用いて、染色なしで各ウェルの細胞をカウントしました。
アポトーシスおよび細胞生存率のセルベースアッセイを実施し、ヒートショックによってアポトーシスやその他の細胞死経路が誘導されたか、また健常群とストレス群で応答が異なるかを調べました。CellEventアッセイでアポトーシス細胞を定量し、モレキュラーデバイス EarlyTox™ Cell Integrity アッセイキットで生細胞と死細胞を識別・カウントしました。両アッセイはヒートショック後6時間および24時間で実施しました。
ウェスタンブロットでは、6ウェルプレートで培養・処理した細胞をトリプシン処理後、ペレット化、洗浄し、PBSに0.5%Tweenとプロテアーゼ阻害剤を加えて溶解しました。遠心後、上清をタンパク質定量し、細胞抽出物2.1 µgを4-20%ゲルにロードし、PVDF膜に転写しました。マウス抗HSP70でプローブし、Eu標識抗マウス二次抗体で検出しました。タンパク質バンドはSpectraMax i3プレートリーダーとScanLaterウェスタンブロット検出カートリッジで検出・定量しました。
細胞増殖
ヒートショック後、細胞を6時間または24時間回復させてからイメージングおよびその他のアッセイを行いました。2つのタイムポイントで、SpectraMax MiniMax 300イメージングサイトメーターのStainFree細胞カウントで細胞数の差を定量しました。染色は不要で、ソフトウェアが細胞を自動認識しました。SoftMax® Proソフトウェアのプリセット設定を使用しました。ヒートショック細胞では増殖が減少し、特にストレス群で顕著であり、24時間後により強く現れました(図1)。
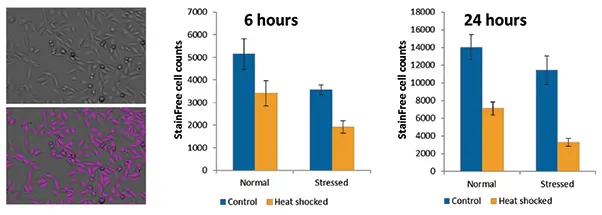
図1. ヒートショック後の細胞増殖のStainFree測定 左は未処理CHO-K1細胞の透過光画像(上)と、StainFree解析で認識された細胞を示す紫色マスク(下)。グラフは健常群とストレス群の細胞数を、コントロール条件とヒートショック条件で比較したものです。細胞数は6時間および24時間で比較しました。
アポトーシスアッセイ
6時間および24時間のタイムポイントでアポトーシスを評価しました。ヒートショック後6時間で、ストレス細胞はより高いアポトーシス率を示しましたが、24時間後にはストレス群ヒートショック細胞でさらに多くのアポトーシス細胞が観察されました(図2)。一方、非ヒートショック細胞は低いアポトーシス率を維持しました。
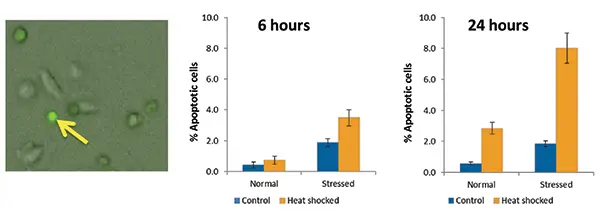
図2. コントロールおよびヒートショック細胞のアポトーシス 左パネルはアポトーシス細胞(明るい緑)と丸い形態、非アポトーシス細胞の扁平で伸長した形態を示します。黄色矢印は高い緑蛍光を示すアポトーシス細胞を指しています。グラフは健常群とストレス群のアポトーシス率をコントロール条件とヒートショック条件で示しています。
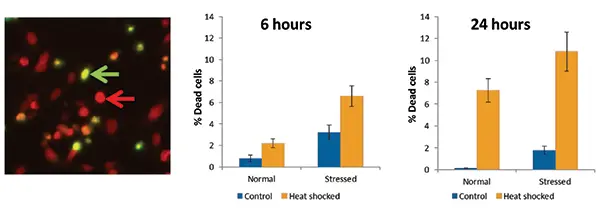
図3. ヒートショック後の細胞生存率の定量 左パネルはヒートショック細胞の画像(緑矢印:死細胞、赤矢印:生細胞)。グラフはヒートショックによる死細胞の割合増加を、健常群とストレス群で示しています。
細胞生存率アッセイ
EarlyTox Cell Integrityキットを用いて、細胞がアポトーシス以外の方法で死んでいるかを調べました。ヒートショックで細胞死が増加し、特に24時間後に顕著でした。ストレス細胞は健常群より死細胞の割合が高く、アポトーシス結果とよく一致しました。これにより、観察された細胞死のほとんどはアポトーシスによるものと考えられます。
HSP70誘導
ScanLaterウェスタンブロット解析で、ヒートショック応答としてHSP70が誘導されることが確認されましたが、この応答は健常細胞でストレス細胞よりも大きく現れました。SoftMax Proソフトウェアでバンド強度を定量した結果、健常細胞ではヒートショック後6時間でHSP70が48倍増加しましたが、ストレス細胞では1.5倍の増加にとどまりました(図4)。非ヒートショックコントロール細胞では、ストレス群のHSP70発現量が健常群より約18倍高いことがわかりました。
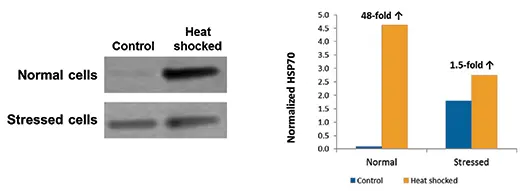
図4. HSP70発現のウェスタンブロット解析 左パネルは処理6時間後のコントロールおよびヒートショック細胞のHSP70発現を示すウェスタンブロット。グラフはScanLater解析で定量した結果を示します。「Normalized HSP70」は背景を差し引いた積分密度を百万単位で表します。
結論
SpectraMax i3 マルチモードマイクロプレートリーダーを用いて、セルベースイメージングアッセイとウェスタンブロットを実施し、ヒートショックに対する細胞応答を調べました。StainFree細胞カウントで健常群とストレス群の増殖変化を確認し、アポトーシスおよび細胞生存率アッセイでヒートショック誘導細胞死のメカニズムを解明しました。さらに、ウェスタンブロット解析でHSP70誘導を定量しました。結果から、ヒートショックによる細胞死のほとんどはアポトーシスによるものであると考えられます。HSP70誘導は健常細胞で最も高く、ストレス細胞ではヒートショック前から誘導されていましたが、健常細胞ほど高レベルには達しませんでした。そのため、ストレス細胞はアポトーシスからの保護が弱く、より高いアポトーシス率を示した可能性があります。
SpectraMax i3システムとSoftMax Proソフトウェアを用いることで、従来は複数の検出装置と異なる解析ツールを必要とした多面的な細胞機能解析を、1つのプラットフォームで実現できます。
PDF版(英語)