Application Note オートファジー解析に最適な神経細胞イメージング手法
- ラベルなし神経突起の正確なセグメンテーションを生成します
- 神経変性疾患のメカニズムをより深く理解します
- 類似した細胞内構造をより高精度に識別します
- 1つのウェルで複数の生物学的指標を測定し、豊富なデータを生成します
PDF版(英語)
Jayne Hesley, PhD | シニアアプリケーションサイエンティスト | モレキュラーデバイス
治療介入の可能性を持つ領域としてのオートファジー
Jayne Hesley, PhD|Sr.アプリケーションサイエンティスト|モレキュラーデバイス
オートファジーは、細胞内で不要または異常と認識されたタンパク質やオルガネラを隔離し分解するカタボリックプロセスです。オートファジーは、侵入した微生物、変性タンパク質、劣化したオルガネラを除去する「ハウスキーピング」機能を担うことで、正常な細胞プロセスを維持します。オートファジーは細胞の恒常性維持に不可欠であり、細胞内物質の代謝回転機構としての役割に加え、飢餓などのストレスに応答してエネルギー消費や物質再利用の速度を調整することで、生体の適応を支えます。
オートファジーは、がん、感染症、糖尿病、神経変性疾患など、さまざまな疾患において有益な役割と有害な役割の両方を持つことが明らかになっています。特に神経細胞の研究において、オートファジーは長い軸索距離にわたってタンパク質の構造と機能を維持するために重要です。他の組織の細胞とは異なり、ニューロンの細胞質内容物は分裂によって希釈されることがありません。アルツハイマー病やパーキンソン病などの神経疾患では、オートファジーの変化や細胞毒素の蓄積が観察されています。これらの知見から、オートファジーのさまざまなメカニズムが治療介入の可能性を持つ領域として注目されています。このプロセスに対する実験変数の影響を定量化することは、安全で効果的なオートファジー標的治療の開発につながる研究の重要な要素です。
材料
- CYTO-ID ® オートファジー試薬(エンゾライフサイエンス)
- 蛍光リソソーム色素
- iCell ® ヒト多能性幹細胞由来ニューロン(セルラー・ダイナミクス・インターナショナル)
- ラットPC-12細胞(ATCC)
- ImageXpress®Microハイコンテントイメージャーシステム(モレキュラーデバイス)
- MetaXpress®ハイコンテント画像取得・解析ソフトウェア(モレキュラーデバイス)
蛍光イメージングによるオートファジーの可視化
オートファジーは、入手しやすい試薬を用いて、異質な細胞集団においても可視化および特徴付けが可能です。
CYTO-ID Autophagy Reagentは、ファゴフォア、オートファゴソーム、オートリソソームの膜を選択的に染色します。また、オートファゴソームタンパク質LC3-IIとの共局在も確認されています。この試薬は495/519 nmの蛍光励起/蛍光発光プロファイルを持ち、標準的なFITCフィルターセットで使用できます。
リソソーム特異的蛍光イメージングを利用することで、オートファゴソームとリソソームの破壊的融合を検出できます(図1)。以下の例では、励起/発光波長647/668 nmの蛍光リソソーム染料を用いてリソソーム活性を特徴付けました。深赤色のリソソーム染料からの発光は、標準的なCy5フィルターセットで検出できます。
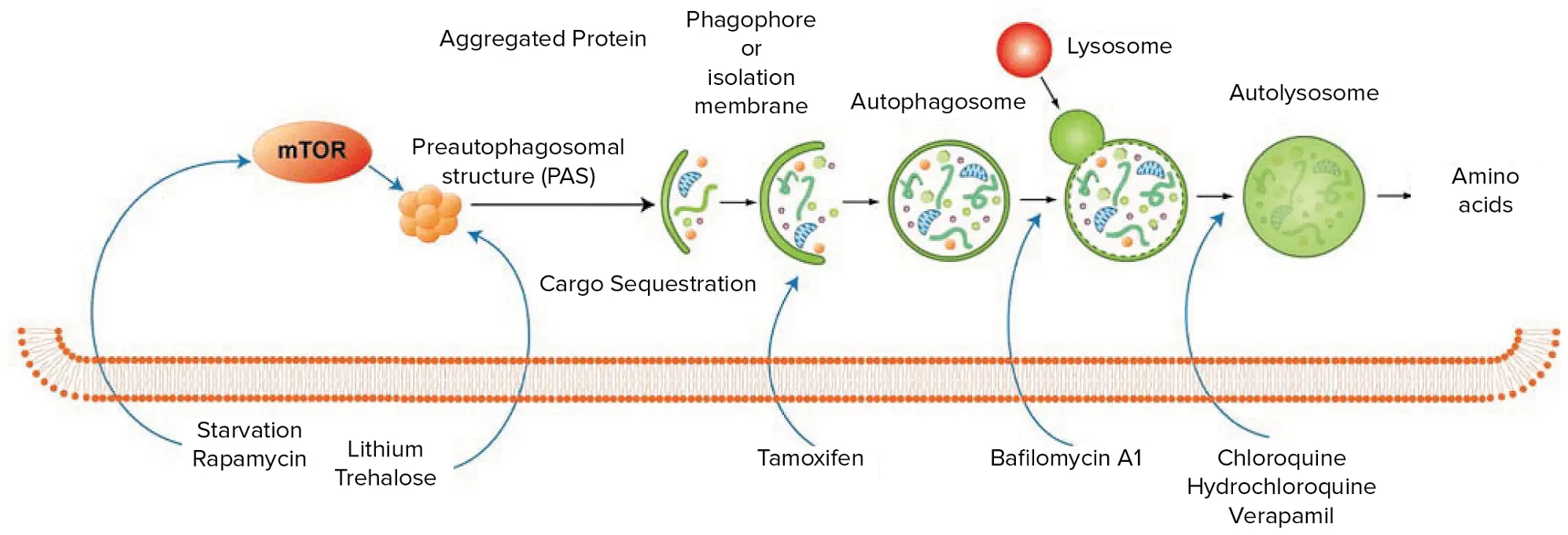
図1:オートファジーのプロセスは、内因性または外因性のシグナルにより、ファゴフォアと呼ばれる球状の二重膜構造が形成されることで始まります。微小管関連タンパク質1ライトチェーン3α(LC3)はファゴフォアの伸長を促進し、細胞質ターゲットの取り込みを開始します。オートファジー関連(ATG)タンパク質によって媒介されるプロセスで、ファゴフォアはターゲットを囲み、オートファゴソームになります。その後、オートファゴソームはリソソームと融合し、内容物と膜が加水分解酵素によって分解されます *1。
表現型変化の同時解析を可能に
ライブセルにおけるCYTO-ID Greenによるオートファゴソーム染色とリソソーム染色のレベルは、化合物がオートファジー経路を刺激または阻害するメカニズムに関する情報を提供します。この解析は、固定またはライブセル、組織、小型生物のワイドフィールド蛍光または明視野イメージングを行うハイコンテントスクリーニングシステム ImageXpress Microシステムを使用して実施しました(図2)。

図2. 自動イメージングを用いた簡易定量化ワークフロー。シンプルで自動化されたワークフローは、プレーティングから最終結果まで数日かかる実験であっても、最小限の手作業でハイスループットスクリーニングに対応できます。
MetaXpressソフトウェアは、事前設定されたアプリケーションまたはカスタムモジュールを使用して画像を解析し、表現型変化を特徴付け、特定の出力を生成しました。カスタムモジュールにより、核、オートファゴソーム、リソソームなど、複数の染色された構造の同時検出、測定、および面積の合計が可能になりました。測定値は、時間経過や薬剤濃度の範囲などの実験条件に対してプロットされました。
オートファゴソームの増加は細胞ストレスを示唆
iCellヒト誘導多能性幹細胞(iPSC)由来ニューロンとラットPC-12細胞を用いて、384ウェルマイクロプレートの各ウェルで複数の細胞応答を評価する有用性を実証しました。
ヒトニューロン
ニューロンは5,000 cells/wellで播種し、メーカーの推奨に従って培養しました。5日後、メンテナンス培地で調製した化合物の希釈系列で処理しました。化合物を24時間インキュベートした後、リソソーム、核、オートファゴソームを染色し、ImageXpress Microシステムを用いて37°Cでライブセルをイメージングしました。画像は、60X Plan Fluorまたは40X Plan Apo対物レンズを使用し、ウェルごとに2~4サイトから取得しました(図3A)。画像解析はMetaXpressソフトウェアで行い、化合物曝露の濃度範囲にわたる影響を定量化しました(図3B)。例示画像は60X倍率で示していますが、図3~6のグラフデータは同じ実験から得られた40X倍率の画像を使用しています。低倍率は細胞内小胞の測定に十分な画質を提供し、視野内により多くの細胞を取り込む利点があります。
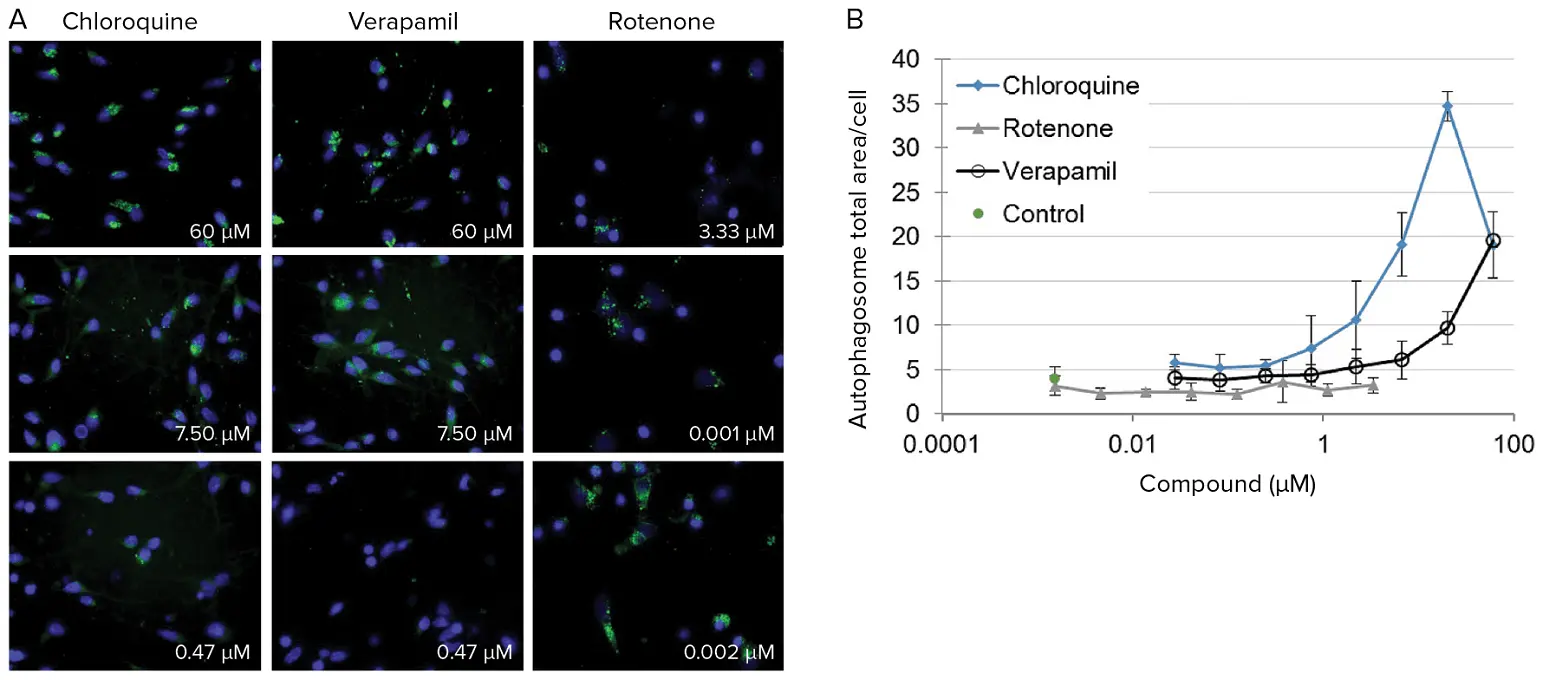
図3. ヒトニューロンにおける化合物曝露の影響の定量化。(A)3種類の化合物を3つの濃度で曝露した後のヒトニューロンの代表的な60X倍率画像。オートファゴソーム(緑)は用量依存的に応答します。(B)クロロキン、ロテノン、ベラパミルがヒトニューロンのオートファゴソーム総面積に与える用量反応効果。オートファゴソームは化合物曝露により阻害または刺激される可能性があります。
ラットPC-12細胞
PC-12細胞は2,000 cells/wellで播種し、完全培地で調製した化合物の希釈系列で処理する前に一晩培養しました。24時間後、リソソーム、核、オートファゴソームを染色し、37°Cでライブセルをイメージングしました。画像は40X倍率でウェルごとに2~4サイトから取得しました。画像解析はMetaXpressソフトウェアで行い、化合物曝露の濃度範囲にわたる影響を定量化しました(図4)。
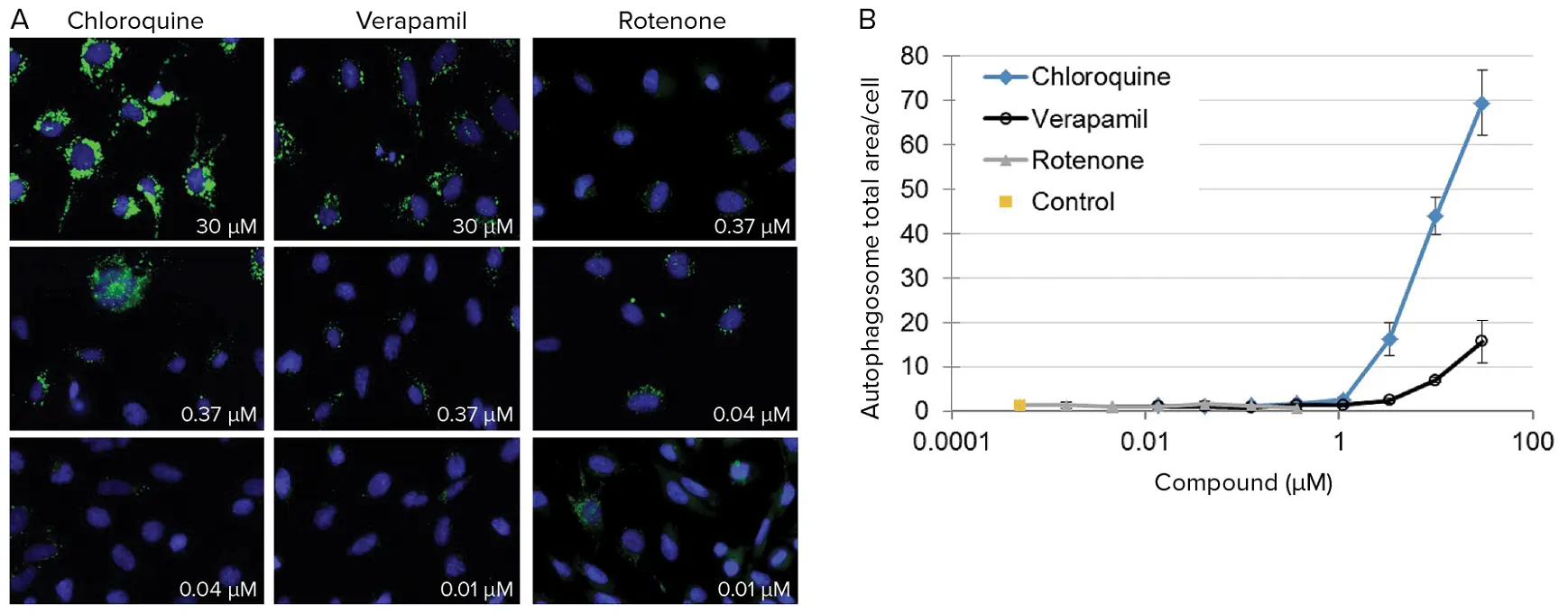
図4. ラットPC-12細胞における化合物曝露の影響の定量化。(A)3種類の化合物を3つの濃度で曝露した後のラットPC-12細胞の代表的な60X倍率画像。オートファゴソーム(緑)は明確に可視化および測定可能です。(B)クロロキン、ロテノン、ベラパミルがラットPC-12細胞のオートファゴソーム総面積に与える用量反応効果。オートファゴソームは化合物曝露により阻害または刺激される可能性があります。
リソソーム応答はオートファジー経路の破綻を示唆
ヒトニューロン
リソソームのアッセイは、前述の手順と同じウェルで実施しましたが、リソソーム染料を追加しました(図5)。
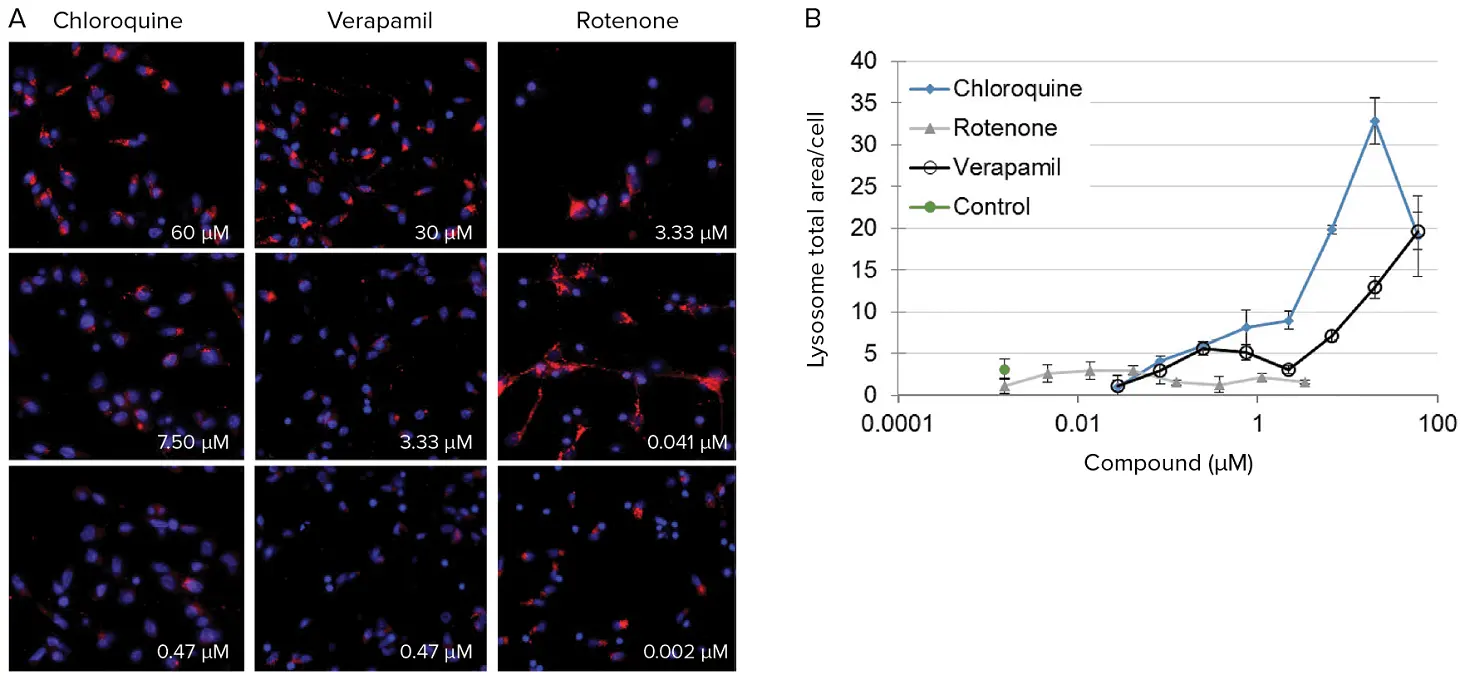
図5. ヒトニューロンにおけるリソソーム応答の定量化。(A)3種類の化合物を3つの濃度で曝露した後のiPSC由来ニューロンの代表的画像。リソソーム(赤)は応答検出のために可視化および測定可能です。(B)クロロキン、ロテノン、ベラパミルがニューロンのリソソーム総面積に与える用量反応効果。リソソーム測定は、オートファゴソームとリソソームの融合という最終ステップでのオートファジー経路の破綻を示唆します。
ラットPC-12細胞
PC-12細胞でも同様に、複数の毒性イベントを測定するアッセイを実施しました。細胞内リソソームへの影響を評価するため、複数のパラメータを測定しました(図6)。
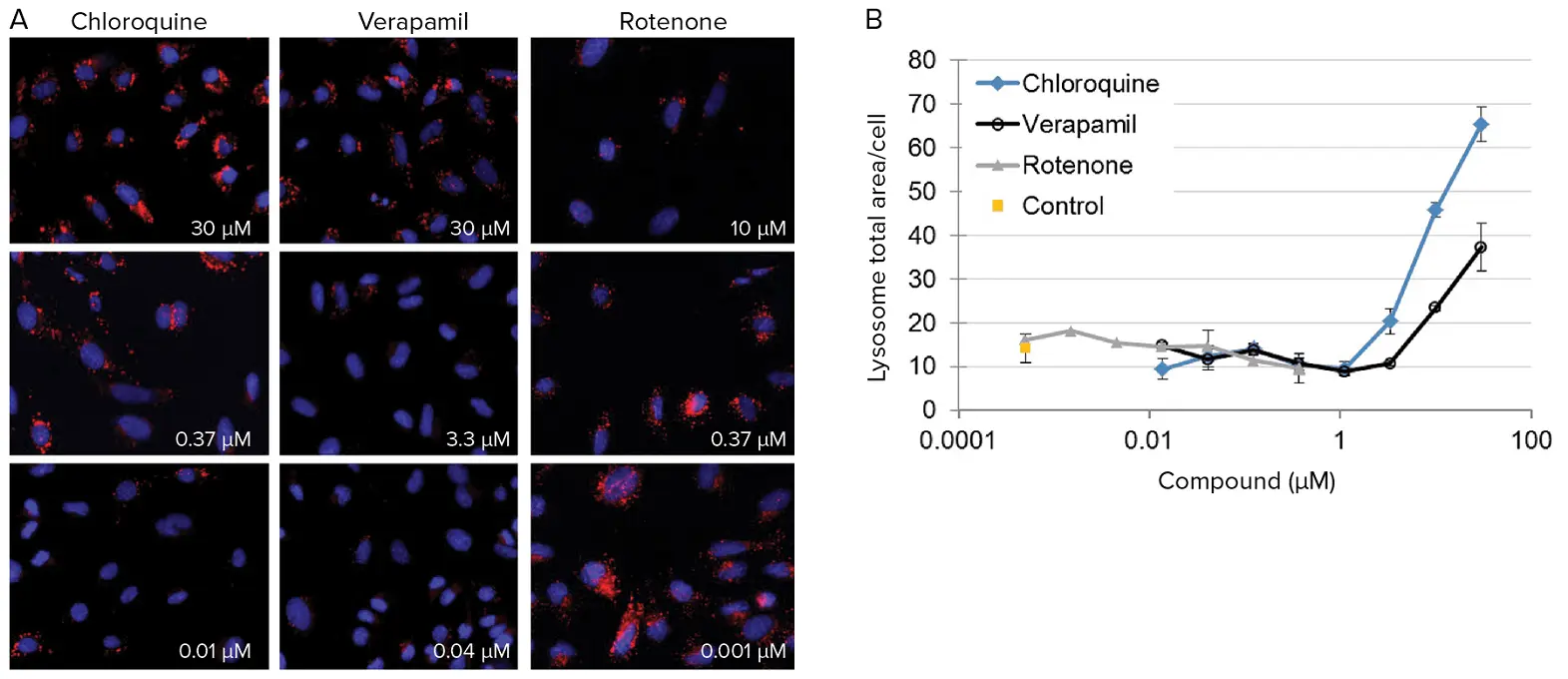
図6. ラットPC-12細胞におけるリソソーム応答の定量化。(A)3種類の化合物を3つの濃度で曝露した後の代表的画像。画像は60X PF対物レンズで取得。リソソームは赤で表示。細胞内リソソームの減少または増加を定量化することで、化合物の毒性メカニズムを推定できます。(B)クロロキン、ロテノン、ベラパミルがラットPC-12細胞のリソソーム総面積に与える用量反応効果。リソソームは化合物曝露により阻害または刺激される可能性があります。
透過光画像を用いた正確なニューロンセグメンテーション
神経突起の遠位部に存在するオートファゴソームを検出することは困難です。非染色細胞体の明視野画像を取得することで、長い突起を持つ細胞のセグメンテーションが容易になります。ニューロンに関連する染色オルガネラのみを正確に定量化するため、カスタムモジュールを構築しました。これにより、染色アーティファクトやデブリではなく、目的の細胞構造のみを検出できます(図7)。
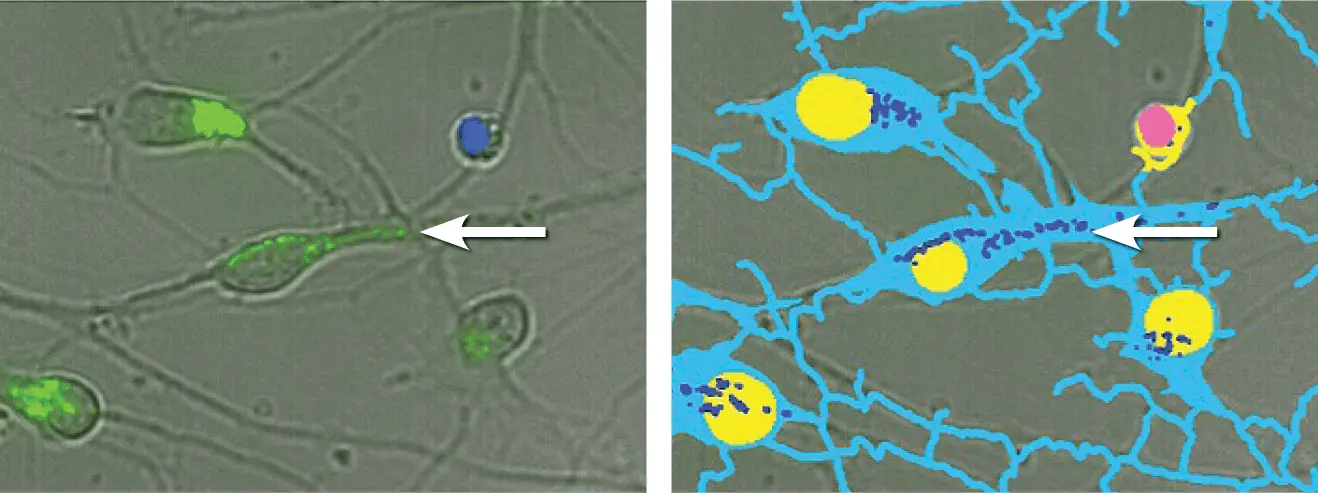
図7. カスタムモジュールを用いたニューロンセグメンテーション。(左)透過光画像(灰色)、Hoechst染色核(青)、CYTO-ID染色オートファゴソーム(緑)の40X倍率ズーム画像のオーバーレイ。(右)セグメンテーションマスクでは、透過光画像から細胞体と突起をティールで、健常核を黄色、アポトーシス核をピンク、オートファゴソームをロイヤルブルーで識別。矢印で示すように、細胞体から離れた位置にあるオートファゴソームもカウント可能です。
カスタムモジュール解析から得られた読み出しの用量反応曲線は、AcuityXpress™ Analysis Softwareで作成しました(図8)。ベラパミルとクロロキンの両方で、オートファゴソーム形成に明確な用量依存的応答が認められました。オートファジーの阻害または刺激を示すEC₅₀値は、オートファゴソームおよびリソソーム形成に基づき図9に示されています。
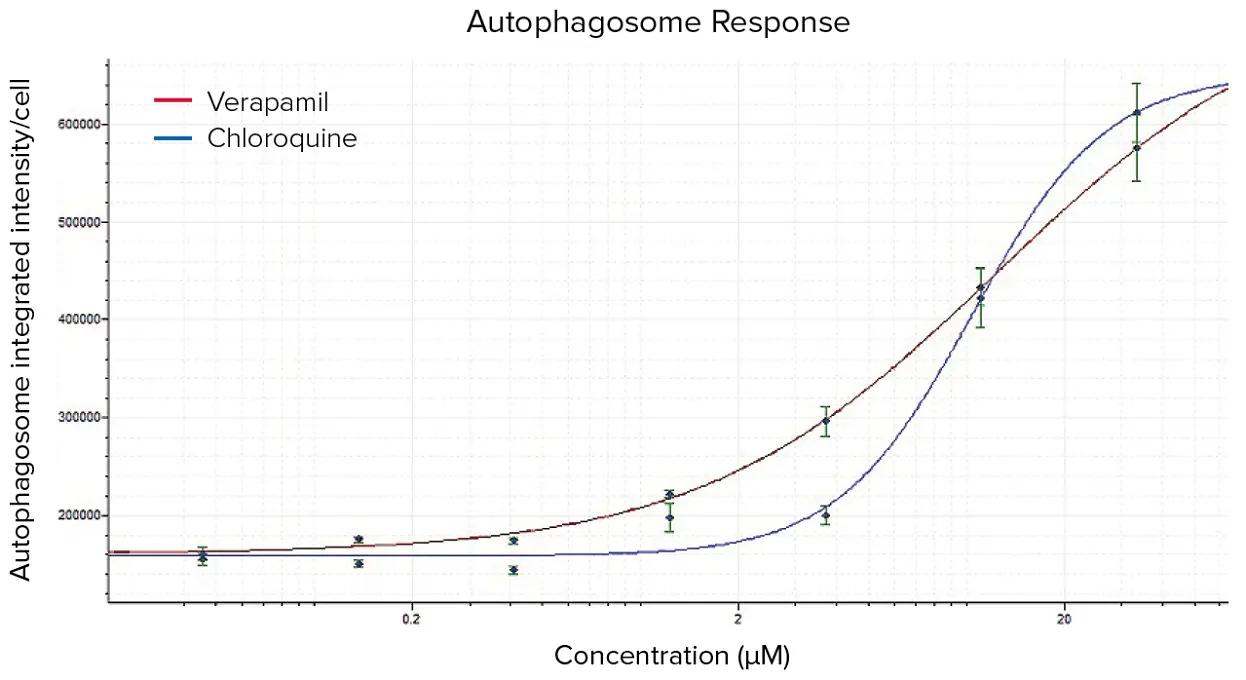
図8. ベラパミルおよびクロロキンに対するオートファゴソーム形成の用量反応曲線。画像は図7で定義されたカスタムモジュールを用いて解析され、得られた測定値をAcuityXpress Analysis Softwareでプロットしました。
| EC₅₀ | オートファゴソーム | リソソーム |
||
|---|---|---|---|---|
| Compound | PC-12 | Neuron | PC-12 | Neuron |
| Chloroquine | 5.5 µM | 5.8 µM | 4.4 µM | 2.0 µM |
| Verapamil | 21 µM | >60 µM | 18.8 µM | 9.5 µM |
| Rotenone Flat, no fit | Flat, no fit | Flat, no fit | 73 nM | Flat, no fit |
図9. 試験化合物のEC₅₀値。EC₅₀値は、オートファジーを阻害または刺激する化合物について、用量反応曲線を非線形モデルにフィットさせて算出しました。細胞種によって薬剤曝露に対する感受性が異なることは予想される結果です。
結論
本研究では、実験条件に応じた特定のニューロン培養におけるオートファジー評価の可能性を示しました。これにより、研究者はニューロンのオートファジーに対する化合物の用量反応効果を調べたり、オートファジーおよび神経変性疾患に関連する生理学的メカニズムに影響を与える可能性のある化合物ライブラリーをスクリーニングする機会を得られます。
ImageXpress Microシステムは、384ウェルマイクロプレートで培養されたヒトおよびラットニューロン細胞の画像取得を可能にする、ワイドフィールド高解像度明視野および多波長蛍光顕微鏡機能を備えています。MetaXpressソフトウェアは、これらの画像を解析し、オートファゴソーム、リソソーム、その他の細胞構造の総面積を測定することで、実験条件とオートファジー発生の関係を定量化しました。
参考文献
- Mizushima, Yoshimori and Levine (2010) Methods in Mammalian Autophagy Research. Cell 140:313-326.
- Jin H. Son, et. al. (2012) Neuronal autophagy and neurodegenerative diseases. Experimental and Molecular Medicine 44, 2:89-98.
PDF版(英語)