Application Note 透過光画像解析による
セルカウントおよび細胞毒性影響の評価
- 透過光イメージングによるオブジェクトのセグメンテーションとセルカウント
- 透過光画像を用いた細胞増殖のモニタリング
- 染色を行わずに細胞毒性の影響を評価
- 増殖抑制作用および細胞毒性を有する化合物の影響を評価
PDF版(英語)
はじめに
Oksana Sirenko|研究員|モレキュラーデバイス
多くの生物学的アプリケーションでは、蛍光マーカーやその他のラベルを使用せずに、複数のタイムポイントにおけるセルカウント、細胞の健康状態、コンフルエンシー(細胞密度)、および増殖のモニタリングが求められます。特に、透過光(TL)イメージングを用いて細胞を観察する際には、さまざまな細胞応答を評価するための、信頼性が高く効率的なセルカウント手法へのニーズが高まっています。
材料
- CHO細胞(ATCC)
- HeLa細胞(ATCC)
- HeLa培地(ギブコ、サーモフィッシャーサイエンティフィック)
- ヘキスト(サーモフィッシャーサイエンティフィック)
- 96ウェルマイクロプレート (Greiner Bio-One International)
- ImageXpress® Nano自動イメージングシステムとCellReporterXpress画像取得・解析ソフトウェア(モレキュラーデバイス)
透過光画像を用いたオブジェクトのセグメンテーションとセルカウント
CellReporterXpressソフトウェアでは、透過光画像を用いてオブジェクトをセグメント化し、セルカウントを行うことが可能です。本研究では、ラベルフリーでのセルカウントの精度を評価するために、透過光画像解析による細胞増殖および細胞毒性の影響評価の実現可能性を検討しました。
透過光画像でカウントされた細胞数の精度を、段階希釈法を用いて評価し、核染色によるセルカウント結果と比較しました。CHO細胞およびHeLa細胞は、それぞれ適切な培地(HeLa:MEM + 10% FBS + 1% pen/strep、CHO:Ham’s F12 + 10% FBS + 1% pen/strep)を用いて96ウェルプレートに播種しました。最上段のウェルには20,000 cells/wellを播種し、プレート全体にわたって50%の段階希釈を行いました。播種から24時間後、細胞はHoechst核染色で染色され、4%パラホルムアルデヒドで固定後、PBSで洗浄しました。各ウェルの画像はImageXpress Nanoシステムを用いて、10倍または4倍対物レンズで取得しました。384ウェルプレートでは、各ウェルにつき1枚の10倍画像を取得しました。10倍対物レンズは、約1/4ウェル領域をカバーし、1画像あたり約500~1,000細胞を撮像できる十分な解像度を提供します。4倍画像は384ウェルプレートの1ウェル全体をカバーし、96ウェルプレート換算で約1/8ウェルに相当します。画像取得後、すべての画像解析はCellReporterXpressソフトウェアを用いて実施しました。同ソフトウェアには、透過光画像によるセルカウントを定量化するための事前定義された解析プロトコールが含まれており、細胞形態に応じた複数の解析プロトコールが利用可能です。画像処理の一例として、図1にはHeLa細胞およびCHO細胞の代表的なズーム画像と、それぞれに適用された解析マスクが示されています。
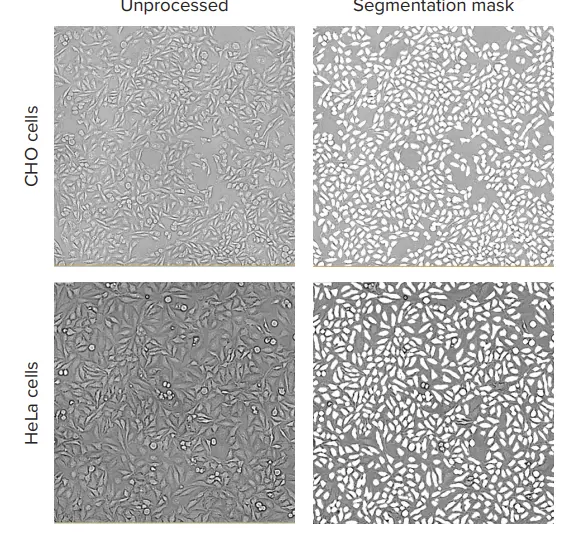
図1. HeLa細胞およびCHO細胞培養における透過光(TL)画像と解析マスクの表示 CHO細胞およびHeLa細胞の画像は、ImageXpress Nanoシステムを用いて、10倍のPlan Fluor対物レンズおよび透過光チャネルで取得されました。画像はCellReporterXpressソフトウェアを使用して処理され、TL Cell Countの「General」解析プロトコルにより解析が行われました。
10倍または4倍対物レンズを用いた透過光(TL)イメージングにおける典型的な露光時間は10~20ミリ秒でした。より良い結果を得るために、フォーカスオフセットは画像ベースのオートフォーカスから-5~-8 µmの範囲に設定しました。事前定義された「TL Cell Count, General」解析プロトコールは、HeLa細胞およびCHO細胞のいずれにおいても、異なる細胞密度における細胞を正確にセグメント化することができました(図1)。透過光画像と解析によって得られたセルカウントと、核染色を用いた標準的なセルカウントの結果を比較しました。透過光と蛍光核マーカーという2つの異なるセルカウント手法によって得られた結果は、良好な一致を示しました(図2)。
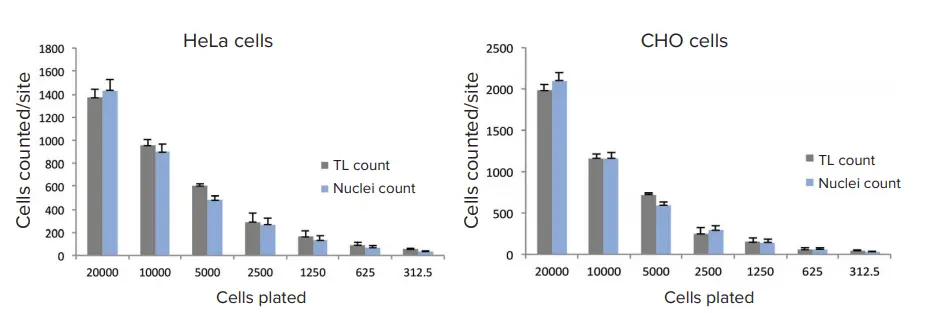
図2. 透過光解析と核染色によるセルカウントの比較 HeLa細胞およびCHO細胞は、播種後24時間培養され、Hoechst(16 µM)で染色・固定されました。画像はImageXpress Nanoシステムを用いて、10倍のPlan Fluor対物レンズおよび透過光チャネル、DAPIチャネルで取得されました。透過光画像によるセルカウントには「TL Cell Count, General」解析プロトコールを使用し、蛍光核染色によるセルカウントには標準の「Cell Count」解析プロトコールを使用しました。
蛍光ラベルを使用せずに細胞毒性の影響を評価可能
HeLa細胞は、抗がん剤であるマイトマイシンC、エトポシド、パクリタキセル、ドキソルビシンで処理され、384ウェルプレート上で6段階の濃度範囲にわたり72時間培養されました(図3)。ライブセルは透過光でイメージングされ、「TL Cell Count, General」解析プロトコールを用いて解析されました。細胞増殖および細胞死への影響は、セルカウントによって評価されました。各化合物で処理された細胞数は有意に減少しており、濃度依存的な応答が確認されました。濃度応答はHillモデルを用いて解析され、EC₅₀値が算出されました。抗がん剤で処理された細胞では、化合物濃度の上昇に伴い、細胞数の明確な減少が認められました(図3)。
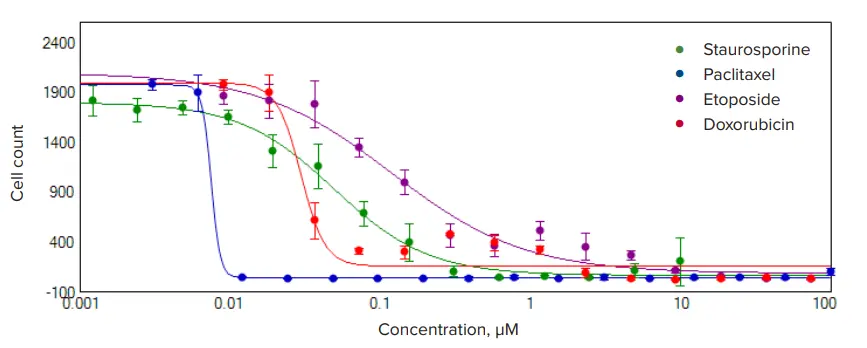
図3. 4種類の細胞毒性化合物に対する濃度依存的応答曲線 HeLa細胞は384ウェルプレートに播種され、細胞毒性化合物で72時間処理されました。画像はImageXpress Nanoシステムを用いて、10倍のPlan Fluor対物レンズにより、透過光およびDAPIチャネルで取得されました。透過光画像によるセルカウントには「TL Cell Count, General」解析プロトコールを使用しました。すべての化合物において、濃度依存的に細胞数が減少する傾向が認められました。選択された化合物については、4パラメータフィッティングによる濃度応答曲線が示されています。 算出されたEC₅₀値(nM)は以下の通りです:パクリタキセル:8.0 ± 2.0 ドキソルビシン:30 ± 4 スタウロスポリン:50 ± 5 エトポシド:121 ± 37
結論
本手法は、透過光(TL)解析がセルカウントの正確な評価だけでなく、さまざまな化合物による増殖抑制作用および細胞毒性の影響を測定するためにも有用であることを示しています。
PDF版(英語)