Application Note SpectraMax Gemini XSを用いた
高感度・安定性の高い蛍光ベースcAMP測定法
PDF版(英語)
Abbie Esterman, Jayne Hesley and Anne T. Ferguson:モレキュラーデバイス
はじめに
アデノシン3′, 5′-環状モノリン酸(cyclic AMP、cAMP)は、細胞表面受容体によって検出される細胞外環境の変化を核内の変化に結び付け、遺伝子発現パターンを変化させる普遍的なセカンダリーメッセンジャーです。cAMPは、細菌、粘菌、ショウジョウバエ、人間など多様な生物における細胞内および細胞間シグナル伝達に関与しています。cAMPは、酵素アデニル酸シクラーゼ(AC)によってATPから生成され、cAMPホスホジエステラーゼによって加水分解されます。これらの酵素の活性化により、細胞内のcAMPレベルが厳密に制御されます。
哺乳類では、ペプチドホルモンや神経伝達物質などの細胞外リガンドが、Gタンパク質共役受容体(GPCR)と呼ばれる膜貫通タンパク質と相互作用します。リガンド結合は受容体の構造変化を引き起こし、GTP結合調節タンパク質(Gタンパク質)との結合を可能にします。Gタンパク質の刺激型(Gs)に結合した場合、GPCRはACを活性化し、抑制型(Gi)に結合した場合は酵素を阻害します。Gs共役受容体の活性化はcAMP産生の増加を引き起こし、これによりcAMP依存性プロテインキナーゼ(PKA)が活性化されます。この酵素は多様なタンパク質をリン酸化し、転写因子の活性を調節し、遺伝子発現に影響を与えます。PKAの標的には、他の酵素、イオンチャネル、転写調節因子が含まれます *1。さらに、cAMPは転写因子cAMP応答エレメント結合タンパク質(CREB)に結合し、その活性を増強することで、cAMP誘導性遺伝子の発現調節に直接関与します *2。
細胞タイプによって、このシグナル伝達経路は神経および免疫応答、代謝、細胞分裂誘導、卵母細胞成熟、ショウジョウバエの嗅覚、受精、植物の種子形成など、さまざまな重要な機能を担います *1-7。したがって、cAMPレベルのモニタリングは、経路の上流要素の作用機序を理解するのに役立ち、シグナル伝達経路を活性化または阻害する化合物のスクリーニングにも利用できます。
このアプリケーションノートでは、モレキュラーデバイス社のSPECTRAmax® GEMINI XS蛍光マイクロプレートリーダーを用いて、ヒト胎児腎細胞株HEK 293におけるフォルスコリンおよびイソプロテレノールによる細胞内cAMPレベルの変化を解析する方法を説明します。これらの細胞は、新しい競合免疫アッセイ「CatchPoint™ cyclic AMP蛍光アッセイキット」の性能を評価するためのモデルシステムです。キットには、ヤギ抗ウサギIgG抗体でコーティングされた2枚の384ウェルマイクロプレートが含まれています(図1、ステップ1)。cAMPを含むサンプル、cAMPキャリブレーター(標準)、またはネガティブコントロールは、一次抗体およびcAMP-ペルオキシダーゼ(cAMP-HRP)コンジュゲートとインキュベートされ、特異的な結合反応が起こります(図1、ステップ2)。サンプルまたは標準中のcAMPは、ウサギ抗cAMP抗体への結合をめぐってcAMP-HRPコンジュゲートと競合します。
サンプル中のcAMP量が増加すると、マイクロプレートウェル底部に結合するcAMP-HRPコンジュゲートの量は減少します。未結合のコンジュゲートは、単一の洗浄ステップでウェルから除去されます(図1、ステップ2)。最後のステップでは、ウェル内容物をStoplight Red™基質とインキュベートします。一次抗体に結合したcAMP量が多いほど、ウェルに残るcAMP-HRPコンジュゲートの量は少なくなり、SPECTRAmax GEMINI XS分光蛍光計で検出されるStoplight Red蛍光シグナルも低下します(図1、ステップ3)。これにより、図3に示すようなcAMPキャリブレーターの用量反応曲線が生成されます。
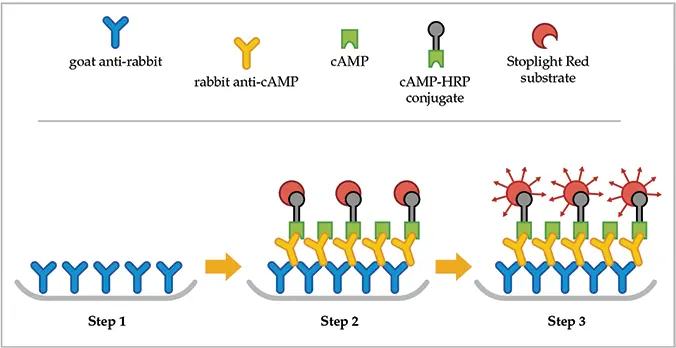
図1:CatchPoint cyclic AMP蛍光アッセイの原理 キットには、ヤギ抗ウサギIgG二次抗体でコーティングされた384ウェルマイクロプレートが2枚含まれています(ステップ1)。cAMPを含む細胞溶解液は、ウサギ抗cAMP抗体およびcAMP-HRPコンジュゲートとともにマイクロプレートウェルでインキュベートされ、液相中で結合反応が起こります(ステップ2)。1回の洗浄後、ウェル内容物はHRP基質Stoplight Redとインキュベートされます。HRP存在下で過酸化水素により酸化されると、適切な波長で励起された際に赤色蛍光を発します(ステップ3)。
材料
- 細胞 HEK 293細胞(アデノウイルスE1Aタンパク質を安定的に過剰発現するヒト胚性腎臓細胞)。
- 試薬 凍結乾燥cAMPキャリブレーター、ウサギ抗cAMP抗体、HRP-cAMP結合体、Stoplight Red™基質を含むCatchPoint cAMP Fluorescent Assay Kit(モレキュラーデバイス, cat #R8044)。DMSO、低含水(Sigma)、炭酸水素ナトリウム(Sigma)、フォルスコリン(Sigma)およびイソプロテレノール(Sigma)を含むcAMPアゴニスト、ホスホジエステラーゼ阻害剤、3-イソブチル-1-メチルキサンチンまたはIBMX(Sigma)および30%過酸化水素(H2O2)溶液(Sigma)。
- マイクロプレート:コーティングされた384ウェル、黒色固形アッセイマイクロプレート(キットに付属)、384ウェル、透明、非滅菌ポリスチレンマイクロプレート(Greiner)。
- 培地とバッファー Dulbecco's modified Eagles medium, DMEM (Irvine Scientific), 0.526 mM EDTA in PBS (Irvine Scientific), phosphate buffered saline, PBS (Invitrogen™ Life Technologies), Krebs-Ringer bicarbonate buffer (KRBG buffer) (Sigma). Cell Lysis Buffer pH 7.3、cAMP Assay Buffer pH 5.8、10X Wash Solution はすべてキットに付属しています。
- Fetal bovine serum: (FBS) heat inactivated (Irvine Scientific)。
試薬の調製
- 細胞増殖培地: 10%FBS添加DMEM
- KRGBバッファー: シグマ社の製品情報シートに、このバッファーの詳しい調製方法が記載されています。
- 800 mM IBMX:100mgのIBMXを563μLのDMSOに溶解します。20℃で保存します。IBMX は cAMP ホスホジエステラーゼによる cAMP の分解を阻害します。
- プレ刺激バッファー:KRGBバッファー10 mLに800 mM IBMX 9.4 µLを加えます。IBMXが完全に溶解するように激しくボルテックスします。このバッファー は実験当日に新しく調製します。
- 10 mM イソプロテレノール:24.8 mg を 10 mL の蒸留水に溶解します。20℃で保存します。希釈液はPBSを用いて調製します。
- 10 mM フォルスコリン:10 mg を 2.4 mL の DMSO に溶かします。20℃で乾燥保存します。希釈液はPBSを用いて調製します。
- cAMPキャリブレーター:凍結乾燥キャリブレーター1バイアルを1.25mLのPBSに再溶解します。表2に示すように、cAMPアッセイバッファーでさらに希釈します。よく混ぜて溶解させます。氷上または4℃で2週間まで保存します。
- 凍結乾燥ウサギ抗cAMP抗体およびHRP-cAMPコンジュゲート: 凍結乾燥抗体およびコンジュゲート1バイアルを10mLのcAMPアッセイバッファーに溶解し、よく混和し、氷上または4℃で2週間保存します。
- 3% H₂O₂:30%H₂O₂溶液を脱イオン水で10倍に希釈します。
- 1X洗浄液:10X洗浄液を脱イオン水で10倍に希釈します。
- Stoplight Red溶液:22 mLのSubstrate Bufferに25 µLの3% H₂O₂を加えてStoplight Red溶液を調製します。よく混合し、220 µL の 100X Stoplight Red 基質を加えてStoplight Red溶液とします。この溶液はプレーティング直前に調製することが重要です。
方法
細胞調製
HEK 293細胞は、10%ウシ胎児血清を添加したDMEMでT-75フラスコに約80%コンフルエンスまで培養し、37 ℃、5%CO₂条件下で維持しました。
ステップ1 T-75フラスコの細胞をPBSで1回洗浄後、37 ℃で5~10分間、PBS中の0.526 mM EDTA 3 mLで処理しました。
ステップ2 剥離した細胞をシングルセル懸濁液にするためにピペッティングし、10%FBSを含む培地7 mLを入れたチューブに移しました。ヘモサイトメーターで細胞数をカウントし、実験に使用可能な総細胞数を決定しました。
ステップ3 細胞を卓上遠心機で1100 rpm、5分間遠心し、KRBGバッファーで1回洗浄しました。その後、細胞をPrestimulation Bufferに再懸濁し、濃度を1 × 10⁶ cells/mLに調整しました。
ステップ4 384ウェル透明ポリスチレンマイクロプレートの一部のウェルをcAMPキャリブレーター標準曲線用に確保しました。これらのウェルには7.5 µLのPrestimulation Bufferを添加しました。他のウェルには、細胞を7.5 µL/well(7.5 × 10³ cells/well)の容量で播種しました。
ステップ5 384ウェルマイクロプレートを室温で10分間インキュベートしました。
アッセイ手順
ステップ1 cAMPキャリブレーターおよびアゴニストの希釈液を表1および表2に従って調製しました。細胞にcAMP産生を誘導するため、アゴニスト(フォルスコリンまたはイソプロテレノール)またはPBS(ネガティブコントロール)を15 µLずつ、細胞7.5 µLを含むウェルに添加しました。cAMPキャリブレーター希釈液は、Prestimulation Bufferのみを含むウェルに添加しました。各サンプルは8連複で実施しました。サンプルを軽く混合し、37 ℃、5%CO₂で15分間インキュベートしました。
| アゴニスト | 原液(pmol/mL) | 濃度(pmol/mL)¹ |
|---|---|---|
| フォルスコリンまたは イソプロテレノール | 1,500,000 | 1,000,000 |
| 500,000 | 333,333 | |
| 50,000 | 33,333 | |
| 16,667 | 11,111 | |
| 5,555 | 3,704 | |
| 1,852 | 1,234 | |
| 617 | 411 | |
| 206 | 137 | |
| 20.5 | 13.7 | |
| 2.05 | 1.37 | |
| 0.205 | 0.137 | |
| 陰性コントロール(PBS) | 1X | |
表1:細胞ベース実験で使用したアゴニストの投与量。1 細胞とアゴニストのみを含む22.5 µL容量におけるアゴニスト濃度
| cAMPキャリブレーター | 原液(pmol/mL) | 濃度(pmol/mL)¹ |
|---|---|---|
| 60,000 | 3333 | |
| 600 | 33 | |
| 200 | 11 | |
| 66.6 | 3.7 | |
| 22.2 | 1.2 | |
| 7.3 | 0.41 | |
| 2.4 | 0.14 | |
| 0.85 | 0.047 | |
| 0.29 | 0.016 | |
| 0.091 | 0.005 | |
| 陰性コントロール(PBS) | 1X |
表2:標準用量反応曲線を作成するために使用したcAMPキャリブレーターの投与量。1 アッセイ総容量60 µLにおける最終濃度
ステップ2 細胞を溶解するため、すべてのウェルに7.5 µLのCell Lysis Bufferを添加し、プレートシェーカーを用いて室温で10分間攪拌しました。
ステップ3 マルチチャンネルピペッターを使用し、各ウェルから20 µLを取り出し、384ウェル黒色アッセイマイクロプレートの別のウェルに移しました。アッセイプレートのウェル配置はポリスチレンプレートと同じにしました。
ステップ4 再構成したウサギ抗cAMP抗体20 µLをすべてのウェルに添加しました。プレートシェーカーで5分間穏やかに攪拌し、適切な混合を確保しました。
ステップ5 再構成したHRP-cAMPコンジュゲート20 µLをすべてのウェルに添加し、穏やかに混合しました。その後、室温で2時間インキュベートしました。
ステップ6 インキュベーション終了後、アッセイマイクロプレートを1X Wash Buffer 80 µL/ウェルで4回洗浄しました。
ステップ7 Stoplight Red溶液を調製しました。Stoplight Red溶液50 µLをできるだけ迅速に各ウェルに添加しました。マイクロプレートはカバーし、光から保護しました。
ステップ8 蛍光強度の測定は、以下の設定で10分および60分後に行いました。
| モード | 蛍光 |
|---|---|
| 励起波長 | 530 nm |
| 発光波長 | 590 nm |
| 発光カットオフフィルター | 570 nm |
| 読み取り | 6 |
| PMT | オート |
表3:CatchPoint cyclic AMPアッセイにおけるSpectraMax Gemini XS分光蛍光計の設定
結果
励起波長と蛍光波長の最適化
Stoplight Red基質をPBSで希釈したサンプルに対して励起および蛍光スペクトルスキャンを実施し、PBSのみで得られた蛍光シグナルと比較しました。この手順により、cyclic AMP蛍光アッセイに最適な励起波長、蛍光波長、およびカットオフフィルターを決定しました(図2)。
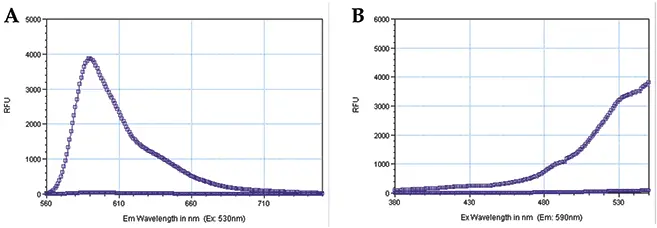
図2:Stoplight Redの励起および蛍光スペクトルスキャン スキャンは、PMTを「auto」、キャリブレーションを「on」、ウェルごとに20回読み取りで実施しました。四角記号のプロットはStoplight Red溶液を、円記号のプロットはPBSを示します。(A) 励起波長を530 nmに固定し、蛍光波長のスペクトルスキャンを実施しました。観察されたピーク蛍光波長は590 nmでした。(B) 蛍光波長を590 nmに固定し、励起波長のスペクトルスキャンを実施しました。約530 nmで大きなバックグラウンドピークの直前に小さなピークがありました。蛍光カットオフフィルターをテストした結果、570 nmカットオフフィルターが最適で、信号対バックグラウンド比は400でした。
アッセイ性能
cAMPキャリブレーター曲線
cAMPキャリブレーターを含むサンプルから得られたデータを解析した結果、図3に示すプロットが得られました。データは4パラメータ曲線にフィットしました。この場合、C値(図3Aおよび3Bでそれぞれ2.4 pmol/mLおよび3.7 pmol/mL)は曲線の中点、すなわちEC₅₀値でした。注目すべき点として、10分および60分でのEC₅₀値は類似しており、蛍光シグナルの時間的安定性を示しました。さらに、これらの値は、別の蛍光マイクロプレートリーダーAnalyst ADを用いたキットで以前得られた値(3.4 ± 0.6 pmol/mL、製品インサート参照)と一致しました。別の日に実験を行った際も、得られたEC₅₀値は3.4 pmol/mLであり、アッセイの再現性が高いことを示しました。信号対バックグラウンド比(キャリブレーターなし)は240で、検出限界(ゼロcAMPキャリブレーターコントロールとの差が標準偏差3倍)は0.1 pmol/mL cAMPでした。アッセイの最適性能範囲は、最大および最小検出可能信号の間であり、0.14~33 pmol/mLと決定されました。
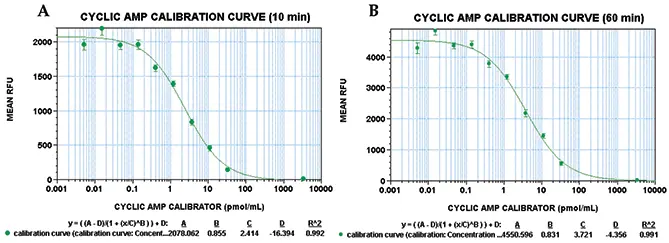
図3:cAMPキャリブレーターの用量反応曲線 用量反応は、Stoplight Red基質添加後(A)10分および(B)60分で示されています。各点は8連複サンプルの平均を表し、エラーバーは平均からの標準偏差を示します。R²値は4パラメータ曲線フィットで0.99です。この実験では、cAMPキャリブレーターのEC₅₀値は10分および60分のインキュベーションでそれぞれ約2.4および3.7 pmol/mLでした。RFUは相対蛍光単位を示します。
Z´因子の決定
Z´因子値を決定するための実験を実施しました。Z´因子値が0.5~1.0の範囲であれば、スクリーニングに適した高品質で堅牢なアッセイであることを示します *8。Z´因子は次の式で計算しました:
$$Z' = 1 - \frac{(3\sigma_{c^+} + 3\sigma_{c^-})}{|\mu_{c^+} - \mu_{c^-}|}$$
σc⁺はポジティブコントロールの標準偏差を、σc⁻はネガティブコントロールの標準偏差を示します。|µc⁺ – µc⁻|は、ポジティブコントロールの平均値とネガティブコントロールの平均値の差の絶対値を示します。この場合、最大阻害を達成したcAMPキャリブレーター濃度(33 pmol/mL)がポジティブコントロールとして使用され、最小阻害を達成した濃度(0.14 pmol/mL)がネガティブコントロールとして使用されました。SpectraMax Gemini XS分光蛍光計を用いたCatchPoint cAMP蛍光アッセイキットで得られたZ´因子は0.84でした。
HEK 293細胞のフォルスコリンおよびイソプロテレノールへの応答
HEK 293細胞は、アデニル酸シクラーゼ活性の内在レベルが低いため、cAMPの調節を研究するための適切なモデルシステムです⁹。HEK 293細胞は、0~1 mMの範囲のフォルスコリンまたはイソプロテレノールで処理されました(図4、図5)。フォルスコリンは、すべてのアデニル酸シクラーゼアイソフォームを活性化する天然ジテルペンであり、イソプロテレノールはβ-アドレノセプターアゴニストです *9-10。フォルスコリンで得られたEC₅₀値は13 µMであり、他の製品で得られた値と一致しています(NEN/Perkin Elmerの[FP]²™キット、製品情報)。
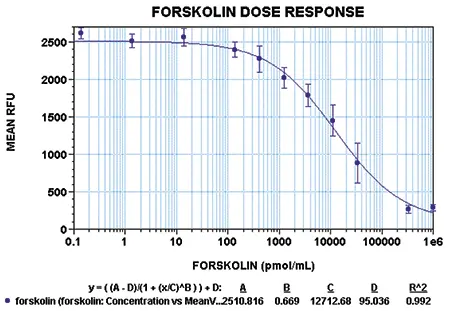
図4:フォルスコリン処理HEK 293細胞の用量反応曲線 各点は、アクチベーターの1濃度に対する8連複サンプルの平均RFUを示します。プレートはStoplight Red基質で60分間インキュベート後に読み取りました。エラーバーは平均からの標準偏差を示します。実験のR²値は4パラメータ曲線フィットで0.99でした。アデニル酸シクラーゼアクチベーターであるフォルスコリンの用量反応は、EC₅₀値13 µMを示しました。
イソプロテレノールで得られたEC₅₀値は82 nMであり、別の細胞株で得られた値と一致しています(図5A10)。Stoplight Red基質でわずか10分間インキュベート後にも同じEC₅₀値が得られました(データ非表示)。これは、アッセイの蛍光シグナルの安定性を裏付けるものです。SoftMax Pro®ソフトウェアを使用し、図3に示す標準曲線に対してデータを補間し、図5Bのグラフを得ました。
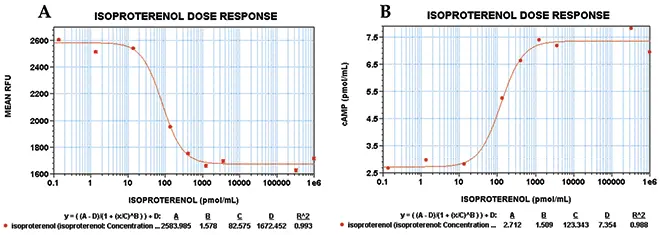
図5:イソプロテレノール処理HEK 293細胞の用量反応曲線 各点は、アゴニストの1濃度に対する8連複サンプルの平均RFUを示します。エラーバーは変動係数のパーセントを示します。両実験のR²値は4パラメータ曲線フィットで0.99でした。(A)の曲線はStoplight Red基質で60分間インキュベート後に得られました。(B)の曲線は(A)のデータを図3の標準曲線を用いて補間したものです。EC₅₀値はRFUとcAMP濃度の比較でそれぞれ82 nMおよび123 nMでした。
結論
モレキュラーデバイス社のCatchPoint cyclic AMP蛍光アッセイキットとSpectraMax Gemini XS分光蛍光計は、基礎研究や創薬における細胞内cAMP変化のモニタリングに最適なツールセットを提供します。cAMP検出のためのシンチレーションプロキシミティアッセイ(SPA)やラジオイムノアッセイ(RIA)などの放射性方法と比較して、この蛍光ベースアッセイは迅速で、廃棄物処理のコストが不要であり、感度は少なくとも10倍高いです。具体的には、SPAの典型的な感度は非アセチル化cAMPで2 pmol/mLですが、CatchPointアッセイキットでは0.1 pmol/mLです。さらに、CatchPointアッセイキットは蛍光偏光法によるcAMP測定(1.25 pmol/mL)より約10倍高感度です。
アッセイ完了速度と感度の観点では、ある発光ベースキットはCatchPoint cyclic AMP蛍光アッセイキットより4倍低感度であり、シグナル検出に特別な装置を必要とします。最後に、安定したシグナルを得るために必要な短いインキュベーション時間(10分~24時間)は、CatchPointアッセイキットをハイスループットスクリーニングに理想的なものにします(図3およびイソプロテレノールデータ)。特筆すべきは、Z´因子およびcAMPキャリブレーターEC₅₀値の再現性により、キットが高品質なスクリーニングアッセイを提供することが実証された点です。結論として、CatchPoint cyclic AMP蛍光アッセイキットは、簡便で便利な手順と、現在市場で最も高感度な細胞内cAMP測定試薬の1つを提供します。
参考文献
- Weiner, R. I. and Charles, A. (2001). Regulation of gonadotropin-releasing hormone release by cyclic AMP signalling pathways. Growth Horm. IGF Res. 11: S9–S15.
- Mayr, B. M., Canettieri, G., and Montminy M. R. (2001). Distinct effects of cAMP and mitogenic signals on CREB-binding recruitment impart specificity to target gene activation via CREB. Proc. Natl. Acad. Sci. USA 98: 10936–10941.
- Monneret, G., Gravel, S., Diamond, M., Rokach, J., and Powell, W. S. (2001). Prostaglandin D(2) is a potent chemoattractant for human eosinophils that acts via a novel DP receptor. Blood 98: 1942–1948.
- Zalatan, F., Krause, J. A., and Blask, D. E. (2001). Inhibition of isoproterenolinduced lipolysis in rat inguinal adipocytes in vitro by physiological melatonin via a receptor-mediated mechanism. Endocrinology 142: 3783–3790.
- Etgen, A. M., Ansonoff, M. A., and Quesada, A. (2001). Mechanisms of ovarian steroid regulation of norepinephrine receptor-mediated signal transduction in the hypothalamus: implications for female reproductive physiology. Horm. Behav. 40: 169–177.
- Martin, F., Charro, M. J., and Alcorta E. Mutations affecting the cAMP transduction pathway modify olfaction in Drosophila. (2001). J. Comp. Physiol. 187: 359–370.
- Moutinho, A., Hussey P. J., Trewavas, A. J., and Malho, R. (2001). cAMP acts as a secondary messenger in pollen tube growth and reorientation. Proc. Natl. Acad. Sci. USA 98: 10481–10486.
- Zhang, J-H., Thomas, T.D.Y., and Oldenburg, K. R. (1999). A simple statistical parameter for use in evaluation and validation of high throughput screening assays. J. Biomol. Screening 4: 67–73.
- Hanoune, J., Pouille, Y., Tzavara, E. Shen, T. Lipskaya, L., Miyamoto, N., Suzuki, Y., and Defer, N. (1997). Adenylate cyclases: structure, regulation and function in an enzyme superfamily. Mol. Cell. Endocrinol. 128: 179–194.
- Cary, D. A., and Mendelsohn, F. A. O. (1987). Effect of forskolin, isoproterenol and IBMX on angiotension converting enzyme and cyclic AMP production by cultured bovine endothelial cells. Mol. Cell. Endocrinol. 53: 103–109.
PDF版(英語)