Application Note 2D・3D乳がんモデルで薬剤応答を
発光アッセイで迅速評価
- 3D培養における細胞生存率の迅速評価
- 高感度な発光測定
- Uボトムマイクロプレートで簡単に行える3D細胞培養とアッセイセットアップ
PDF版(英語)
はじめに
長年にわたり、平坦な培養面で単層に細胞を増殖させる 2D細胞培養 は、疾患メカニズムの研究や新規薬剤候補の効果評価に便利なシステムとして利用されてきました。2Dで培養されたがん細胞株は、由来するがんの実験的代替モデルとして長く用いられてきました。近年では、がん細胞やその他の細胞を 3Dフォーマット で培養し、多層構造を形成させることで、生物学的により関連性の高い新しいがん研究モデルが可能になっています。
薬剤候補が複雑な 3D細胞モデル に与える影響を詳細に把握するためには、イメージングやハイコンテント解析が必要になることが多いですが、全体的な細胞生存率といった単一パラメータを評価できる、シンプルな細胞ベースアッセイも求められています。アデノシン三リン酸(ATP)アッセイは、処理が細胞生存率に与える影響を評価するために広く使用される方法です。代謝的に活性な細胞はATPをエネルギー源として利用し、損傷や栄養枯渇時には細胞質ATPが急速に減少します。ATP測定用アッセイは通常、ATPを必要とするホタルルシフェラーゼ反応に基づく 発光検出 を行い(図1)、細胞や試薬に背景発光がないため非常に高感度です。ATPアッセイによる迅速な測定は、多数の化合物をスクリーニングし、細胞生存率に大きな影響を与えるサブセットを特定するのに役立ちます。この絞り込まれた化合物群は、その後、より詳細な表現型情報を得るための労力を要するフォローアップ実験に使用されます。
ここでは、CellTiter-Glo® 3D Cell Viability Assay(Promega)を用いて、2Dおよび3D細胞培養 における細胞生存率を測定する小規模な研究を紹介します。以下の2種類の細胞を 2Dおよび3D で培養し、既知の複数の化合物 *1で処理して生存率を評価しました:MCF-7(エストロゲン受容体(ER)およびプロゲステロン受容体(PR)陽性の乳がん細胞株)と、患者由来腫瘍エクスプラントから得られたTU-BcX-4IC(ER、PR、HER2陰性のトリプルネガティブ亜型を示す化生性乳がん)*2です。検出にはSpectraMax iD5 マルチモードマイクロプレートリーダーを使用しました。このリーダーは低背景発光と高感度を実現する超低温PMTを搭載しています。すべてのデータはSoftMax Proソフトウェアで解析し、カーブフィッティングおよびIC₅₀計算を行いました。
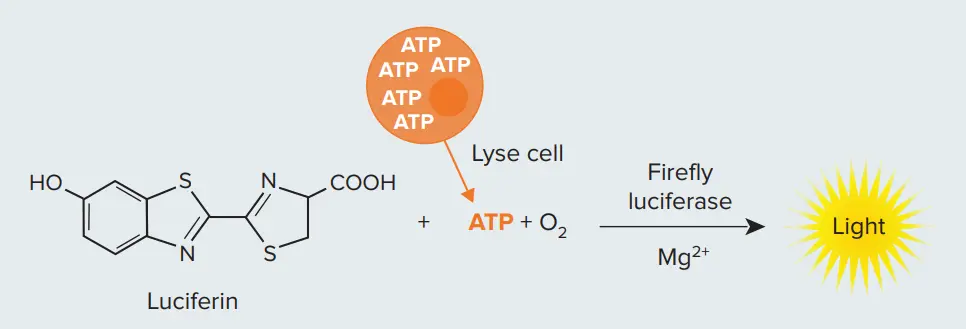
図1. 細胞生存率測定に用いるルシフェラーゼ反応 細胞を溶解し、ルシフェラーゼ反応に加えることで、光を生成するために必要なATPを供給します。生きている細胞が多いほど、生成される光の量も増加します。
材料
- CellTiter-Glo 3D 細胞生存率アッセイ(Promega)
- MCF7乳がん細胞株(ATCC)
- TU-BcX-4IC患者由来原発性トリプルネガティブ乳がん細胞(Tulane大学M. Burow研究室より提供)
- MCF7用増殖培地:MEM(Corning)+10%ウシ胎児血清(FBS、Avantor Seradigm)+1%抗生物質-抗真菌剤(Gibco)+0.01%mg/mLヒト組換えインスリン(Gibco)
- TU-BcX-4IC用増殖培地: DMEM(Corning cat.#15-017-CV)+10%ウシ胎児血清(FBS、Avantor Seradigm)+1%抗生物質-抗真菌剤(Gibco)+1%NEAA(Gibco)+0.01%mg/mLインスリン、ヒト遺伝子組換え(Gibco)
- 384ウェルPrimeSurface 3D白色培養プレート、超低吸着、U底マイクロプレート(Sbio)
- 384ウェル白色組織培養処理ソリッドボトムマイクロプレート(サーモフィッシャーサイエンティフィック社)
- 試験化合物:
・ボルテゾミブ (Tocris)
・イブルチニブ(Tocris)
・イダルビシン塩酸塩(Selleck Chemicals)
・パノビノスタット(セレック・ケミカルズ)
・ロミデプシン(R&D Systems)
・トラメチニブ(セレック・ケミカルズ)
- SpectraMax iD5 マルチモードマイクロプレートリーダー(モレキュラーデバイス)
方法
細胞調製
3Dスフェロイド:MCF7またはTU-BcX-4IC細胞を、384ウェルUボトムマイクロプレートに1ウェルあたり2,500細胞で播種しました。プレートを1,000 rpmで1分間遠心し、細胞を凝集させました。その後、37°C、5% CO₂で72時間インキュベートしました。
2D単層培養:MCF7細胞を384ウェルフラットボトムマイクロプレートに1ウェルあたり5,000細胞で播種し、37°C、5% CO₂で24時間インキュベートしました。TU-BcX-4IC細胞は1ウェルあたり2,500細胞で播種し、48時間インキュベートしました。
化合物処理
TU-BcX-4ICおよびMCF7細胞を 2Dおよび3D で培養し、ロミデプシンを50 nMから0.006 nMまでの1:5希釈系列で4重複ウェルに処理しました。細胞は化合物とともに37°C、5% CO₂で72時間インキュベートしました。
さらに、TU-BcX-4IC細胞は両方の培養フォーマットで、ボルテゾミブ、イブルチニブ、イダルビシン塩酸塩、パノビノスタット、トラメチニブでも処理しました。細胞は同様に37°C、5% CO₂で72時間インキュベートしました。
インキュベーション後、CellTiter-Glo 3D試薬をアッセイウェルに添加しました。3Dスフェロイドの場合、プレートを5分間振とうし、その後室温で30分間インキュベートして細胞溶解を促進してから測定しました。2D培養の場合、プレートを2分間振とうし、その後室温で10分間インキュベートしてから測定しました。プレートはSpectraMax iD5プレートリーダーで 発光検出モード を使用し、表1に示す設定で読み取りました。すべてのデータ解析とグラフ作成はSoftMax Proソフトウェアで行いました。
| パラメータ | セッティング |
|---|---|
| 読み取りモード | 発光 |
| タイプを読む | エンドポイント |
| 波長 | 全波長 |
| プレートタイプ | 96ウェルスタンダード不透明 384ウェル 標準不透明 |
| 純水 | 積分時間: 1000 ms 読み取り高さ 各プレートタイプに最適化 |
| その他の設定 | 読み取り前の最適化オプションを表示 |
表1. CellTiter-Glo 3DアッセイにおけるSpectraMax iD5プレートリーダー設定 設定はSoftMax Proソフトウェアのプレートセクションで指定します。読み取り高さは、「その他の設定」内の「Show Pre-Read Optimization Options」のチェックボックスをオンにし、読み取り開始後に表示される指示に従って最適化します。
結果
各化合物処理細胞の結果はSoftMax Proソフトウェアで4パラメータロジスティックを用いてグラフ化し、各カーブのCパラメータをIC₅₀値として採用しました。ロミデプシンで処理したMCF7細胞では、3D培養細胞のIC₅₀濃度は単層培養よりやや高めでした(図2)。一方、TU-BcX-4IC細胞では、ロミデプシン処理時に3D培養細胞のIC₅₀が2D培養細胞よりわずかに低い値を示しました(図2E)。その他の化合物では、IC₅₀値は3D培養細胞で高い傾向があり、3Dと2Dの差は2~3倍程度になることが多く見られました(図3、表2)。
ロミデプシン処理において、TU-BcX-4ICとMCF7細胞間で顕著な差が見られました。2D培養では両細胞のIC₅₀値はほぼ同程度(1.13 nM vs. 1.88 nM)でしたが、3D培養ではTU-BcX-4IC細胞のIC₅₀値が0.443 nMと12倍低く、MCF7の5.28 nMと比較して大きな差がありました。このことは、TU-BcX-4IC細胞の培養方法が薬剤応答に与える影響が、MCF7細胞よりも大きいことを示唆しています。
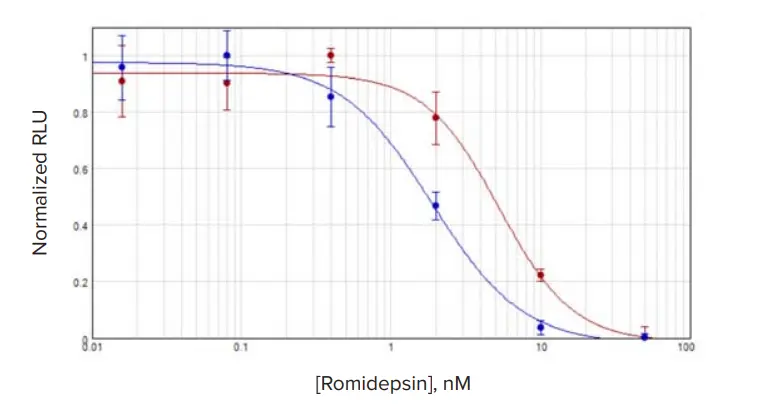
図2. 3D vs. 2D培養MCF7細胞における化合物応答 MCF7細胞を**3D培養(赤)と2D培養(青)**でロミデプシン処理。IC₅₀値は3Dで5.28 nM、2Dで1.88 nM。
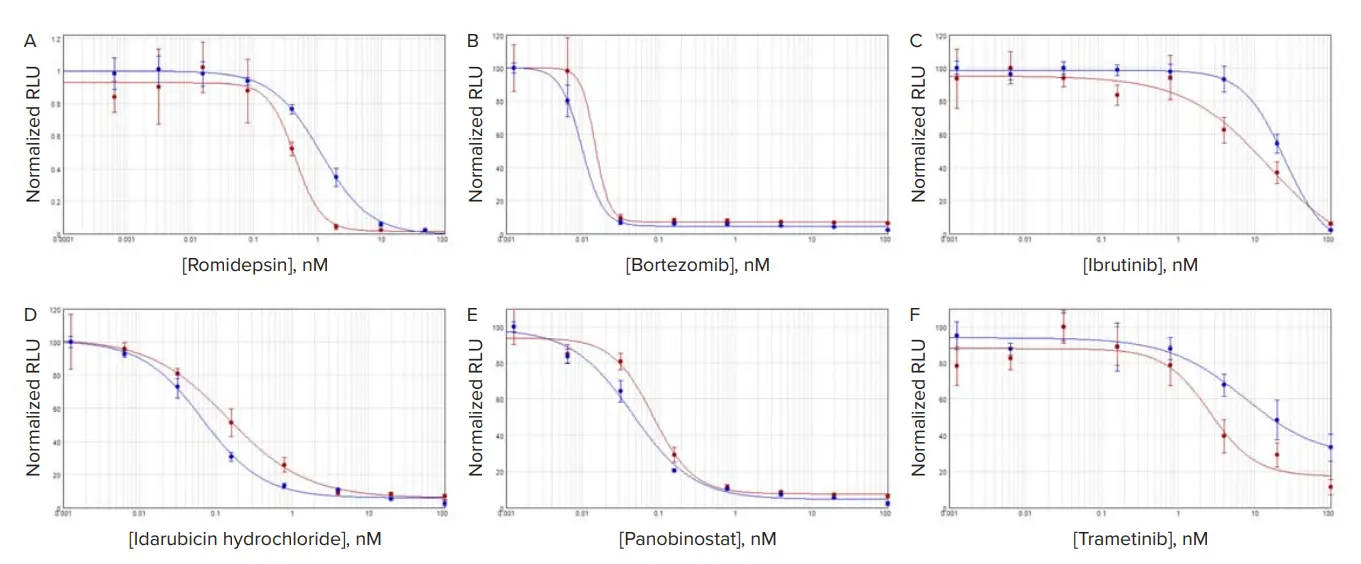
図3. TU-BcX-4IC細胞における3D vs. 2D培養での化合物応答 赤プロットは3D培養細胞、青プロットは2D培養細胞を示します。A:ロミデプシン、B:ボルテゾミブ、C:イブルチニブ、D:イダルビシン、E:パノビノスタット、F:トラメチニブ。
| TU-BxC-4IC | MCF7 | |||
|---|---|---|---|---|
| 3D | 2D | 3D | 2D | |
| ロミデプシン | 0.443 | 1.13 | 5.28 | 1.88 |
| 試薬 | ブランクバッファー 300 µL | 純水 5 µL | 純水 5 µL | 純水 5 µL |
| ボルテゾミブ | 0.015 | 0.010 | ||
| イブルチニブ | 15.8 | 25.0 | ||
| イダルビシン塩酸塩 | 0.145 | 0.067 | ||
| パノビノスタット | 0.084 | 0.046 | ||
| トラメチニブ | 7.34 | 2.62 | ||
表3. 化合物処理細胞のIC₅₀値 MCF7およびTU-BcX-4IC細胞をスフェロイド(3D)または単層(2D)で培養した場合の値を示します。IC₅₀濃度はnM単位。
結論
異なる実験条件下で細胞内ATP濃度を相対的に発光で検出するルシフェラーゼアッセイは、細胞生存率を迅速に評価する便利な方法です。細胞はUボトムプレートに播種することで容易にスフェロイドを形成し、ウェルの洗浄やスフェロイドの移送を行うことなく、化合物処理からATPアッセイまで一連の操作が可能です。得られた細胞生存率データは単独でも有用であり、ハイコンテントイメージングなど他の方法による追加検討が必要な化合物や処理を研究者に示唆することもあります。
本アプリケーションノートでは、CellTiter-Glo 3Dアッセイを用いて、異なる化合物処理が2種類の細胞(スフェロイドまたは単層培養)に与える影響を比較する実験の実現可能性を示しました。ここで紹介した細胞培養方法とアッセイはセットアップが容易で、中~高スループットスクリーニングに適しています。SpectraMax iD5 プレートリーダーは、堅牢なアッセイ結果に必要な高感度を提供し、SoftMax Proソフトウェアによるデータ解析とカーブフィッティングを自動化します。
参考文献
- Sirenko O, Brock CK, Lim A, Macha P, Nikolov E, Olsen C, McConnell EC, Wright M, Collins-Burow BM, Cromwell EF, and Burow ME. Evaluating Drug Response in 3D Triple Negative Breast Cancer Tumoroids with High Content Imaging and Analysis. 3 August 2022, PREPRINT (Version 1) available at Research Square https://doi.org/10.21203/rs.3.rs-1859525/v1.
- .. Matossian MD, Chang T, Wright MK, Burks HE, Elliott S, Sabol RA, Wathieu H, Windsor GO, Alzoubi MS, King CT, Bursavich JB, Ham AM, Savoie JJ, Nguyen K, Baddoo M, Flemington E, Sirenko O, Cromwell EF, Hebert KL, … Burow ME. In-depth characterization of a new patient-derived xenograft model for metaplastic breast carcinoma to identify viable biologic targets and patterns of matrix evolution within rare tumor types. Clin Transl Oncol 24, 127–144 (2022). https://doi.org/10.1007/s12094-021-02677-8
PDF版(英語)