Application Note 自動細胞イメージングと解析による
GPCR活性の定量化
PDF版(英語)
はじめに
GPCRはシグナル伝達を担う膜貫通型タンパク質群の中で最大のグループであり、タンパク質コード遺伝子の約4%を占めています。味覚、嗅覚、視覚といった感覚入力への応答から、細胞増殖、心血管系や免疫系の調節に至るまで、幅広い生物学的経路において重要な役割を果たしています。また、自己免疫疾患、がん、代謝性疾患、心血管疾患、神経疾患など、さまざまな疾患との関連も報告されています。GPCRはリガンドに対して高い特異性と親和性を示すため、創薬において重要なターゲットとなっています。さらに、相互作用するリガンドが未発見のGPCR、いわゆるオーファン受容体も多数存在しています。
自動イメージングと解析は、GPCR研究やスクリーニングにおいて有用なツールです。ImageXpress® Nano自動細胞イメージングシステムとCellReporterXpress自動画像取得・解析ソフトウェアによる高解像度の細胞・細胞内画像の取得と解析により、粒状性、タンパク質凝集、GPCR活性の定量化など、実施可能なアッセイの範囲が広がります。従来のGPCRスクリーニングは、受容体結合、グアニンヌクレオチド結合、セカンドメッセンジャーアッセイ *1に焦点を当てており、GPCRが相互作用するGタンパク質(Gs、Gi/o、Gq、G12、またはGトランスデューシン)に関する知識が必要でした。TransfluorアッセイはGタンパク質非依存型のアッセイであり、脱感作という共通経路(図1)を利用して、既知およびオーファンGPCR、その機能、リガンドをスクリーニングします。このアッセイでは、目的のGPCR遺伝子を過剰発現し、蛍光標識されたβ-arrestinを発現するように遺伝子改変された細胞株を使用します。
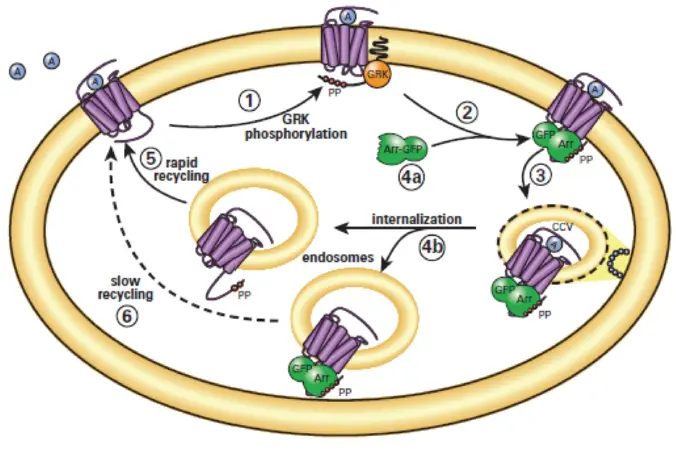
図1. Transfluorアッセイ技術 GPCRの脱感作および再感作モデルにおけるarrestinの役割。
(1) アゴニストで活性化されたGPCRは、カルボキシル末端のテールでGRK(Gタンパク質共役受容体キナーゼ)によりリン酸化されます。
(2) Arrestin(Arr)は細胞膜上でアゴニスト結合かつGRKリン酸化された受容体に移動し結合します。
(3) Arrestinは脱感作された受容体をクラスリン被覆ピットへ誘導し、エンドサイトーシスを促進します。
(4a) 一部の受容体はarrestinと低親和性で結合し、細胞膜付近でarrestinから解離します。
(5) これらの受容体はarrestinなしでエンドサイトーシス小胞に取り込まれ、迅速にリサイクルされます。
(4b) 他の受容体はarrestinと高親和性で結合し、受容体-arrestin複合体としてエンドサイトーシス小胞に取り込まれます。
(6) これらの受容体はゆっくりとリサイクルされます。
本実験では、強化型および野生型(wt)のβ2アドレナリン受容体(β2AR)とβ-arrestin2-GFP(βarr2-GFP)を発現するU20S細胞をモデル系として使用しました。wt-β2ARは小さな蛍光ピットを可視化するために使用しました。強化型細胞株では、β2AR-βarr2-GFP複合体が細胞膜からクラスリン被覆小胞へと陥入する際に持続します(図2)。両方の細胞タイプは、β2ARに選択的なβ交感神経模倣薬であるイソプロテレノールで処理しました。
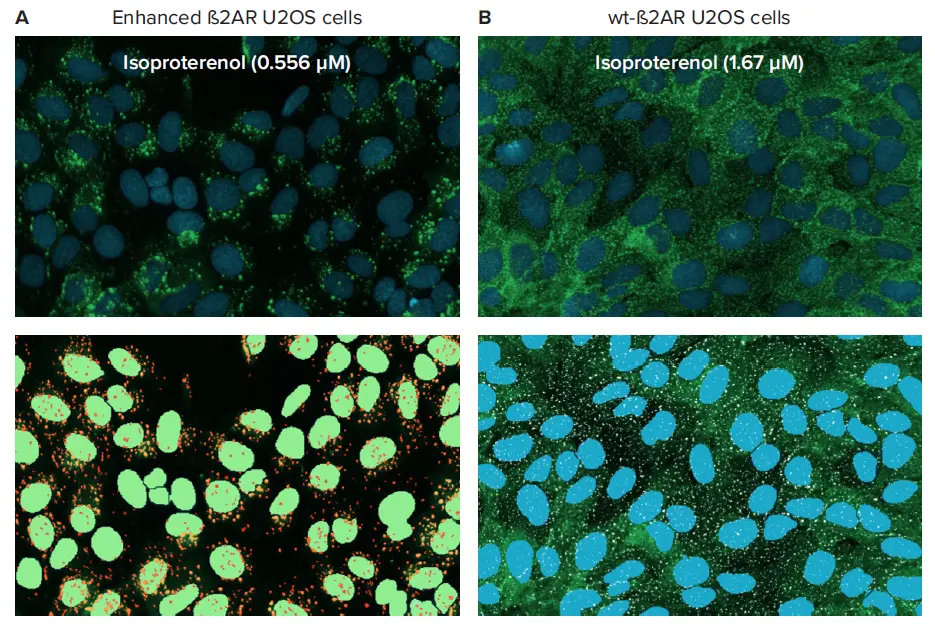
図2. イソプロテレノール処理によるTransfluorアッセイの細胞フェノタイプ ß-arrestin-GFPを発現するß2AR-U2OS細胞をイソプロテレノールで処理し、ImageXpress Nanoシステムで20倍対物レンズを用いてイメージングしました。細胞の拡大画像とソフトウェアによるセグメンテーションオーバーレイを以下に示します:(A)強化型ß2ARの小胞形成(核マスクは緑、小胞マスクはオレンジ)、(B)ß2AR-wtのピット形成(核マスクは青、ピットマスクは白)U20S細胞。
材料
- Transfluor Assay Kit(モレキュラーデバイス); Transfluor® Evaluation kit (モレキュラーデバイス)
- ß-arrestin 2-GFP (ßarr2-GFP) ß-2-アドレナリン受容体 (ß2AR) 発現 U2OS 細胞 (モレキュラーデバイス)
- U2OS培地 MEM(Gibco)に10%熱不活性化FBS(Gibco)、10 µg/mLゲンタマイシン(Gibco)、10 mM HEPES(Gibco)、0.4 mg/mL Zeocin(Gibco)、および0.4 mg/mL G418(Gibco)を加えたもの
- アッセイ希釈バッファー(飢餓培地): 血清、フェノールレッド、抗生物質を含まないMEM(Gibco)
アスコルビン酸添加アッセイ希釈バッファー:スターベーション培地中のアスコルビン酸(L-アスコルビン酸ナトリウム、Sigma) - イソプロテレノール原液: (-)-イソプロテレノール(+)-酒石酸塩(Sigma Cat. #I2760)の細胞培養グレードDMSO(Sigma)中の5 mMストック溶液。
- Hoechst 33342、10 mg/mL(Invitrogen)
- 塩化カルシウムおよび塩化マグネシウムを含まないDPBS(Sigma)
- 4%メタノールフリーホルムアルデヒド:16%メタノールフリーホルムアルデヒド(Polysciences Cat.#18814-20)を塩化カルシウムおよび塩化マグネシウムを含むDPBSで希釈したもの(Gibco)
- ImageXpress Nano自動イメージングシステムとCellReporterXpress自動画像取得・解析ソフトウェア(モレキュラーデバイス)。
方法
強化型ß2ARおよび野生型ß2AR U2OS細胞を、384ウェルの透明底マイクロプレートにU2OS培地50 µLで1ウェルあたり7,000細胞の密度で播種しました。細胞は37°C、5% CO₂で一晩インキュベートし、増殖とウェル底への接着を促しました。24時間後、培地をAssay Dilution Buffer(ADB;MEM培地+10 mM HEPES)に置換し、37°C、5% CO₂で45~60分間の血清飢餓処理を行いました。血清飢餓中に、イソプロテレノールの2倍濃度溶液をADB(MEM培地+10 mM HEPES、アスコルビン酸1 mg/mL含有)で調製しました。血清飢餓後、細胞にイソプロテレノールを1:3の希釈系列で処理し、最終濃度は5 µMから6.27 pMまでとしました。その後、細胞を37°C、5% CO₂で30分間インキュベートしました。さらに、Hoechst 33342溶液(1 µL/mL)の10 µLを添加し、追加で30分間インキュベートしました。イソプロテレノール処理の総時間は60分間でした。
次に、各ウェルから培地を吸引し、4%ホルムアルデヒド溶液50 µLで細胞を固定しました。プレートは室温で暗所にて30分間固定しました。
固定後、細胞をPBSで2回洗浄し、10 mMアスコルビン酸を含むPBS 50 µLで保存しました。プレートはImageXpress NanoシステムとCellReporterXpressソフトウェアを用いてイメージングしました。画像取得時には「Vesicles and Pits」解析モジュールを使用し、細胞内小胞とピットを定量化しました。
画像取得と解析の組み合わせにより迅速なアッセイ結果を生成
マイクロプレート全体を20倍Plan Fluor対物レンズでイメージングし、蛍光性の細胞内顆粒を可視化しました(図2)。小胞はピットよりも大きく、蛍光強度が高いことで識別されました。強化型ß2AR U2OS細胞は1サイトでイメージングし、1視野で最大600細胞を取得し、小胞数の統計的に有意な結果を得ました。野生型ß2AR U2OS細胞は4サイトでイメージングし、最大2,600細胞を取得してピット測定の統計精度を高めました。細胞は2チャンネルでイメージングされ、DAPIはHoechst染色核、FITCはGFP発現ß2AR-ßarr2-GFP小胞とピットを検出しました。プレート定義のプリセットと自動レーザー・画像ベースのオートフォーカスにより、2チャンネルのフォーカスオフセット調整を最小限に抑えつつ高品質なフォーカスを迅速に取得できました。露光時間はFITCで200 ms、DAPIで40 msと適切で、迅速な画像取得が可能でした。
ピットと小胞を個別に識別するためのサイズと強度パラメータは、事前定義された「Pits and Vesicles」解析モジュール内で対話的に決定しました。ユーザー選択可能な定量出力として、細胞単位または画像単位で報告される総小胞・ピット数、平均数、総面積、平均強度、GFPの積分強度などがあり、イソプロテレノールの細胞への影響を包括的に評価できます。ユーザーは取得中に画像を即時解析することも、プレート全体の画像を保存して後で評価することも可能です。
化合物処理細胞の用量反応曲線を生成
強化型および野生型ß2AR U2OS細胞は、βアドレナリン受容体アゴニスト活性を持つエピネフリン類似体イソプロテレノールで処理され、TransfluorアッセイによるGPCRリガンド活性化のモニタリング性能を実証しました。両細胞タイプで明確な用量反応が確認され、イソプロテレノール濃度の増加に伴い小胞とピットの形成が増加しました。これは細胞あたりの平均形成数で測定されました(図3および図4)。イソプロテレノール処理のEC₅₀値は、用量反応曲線の4パラメータ対数カーブフィットから算出され、強化型ß2AR U2OS細胞で0.002 µM、野生型ß2AR U2OS細胞で0.012 µMでした。
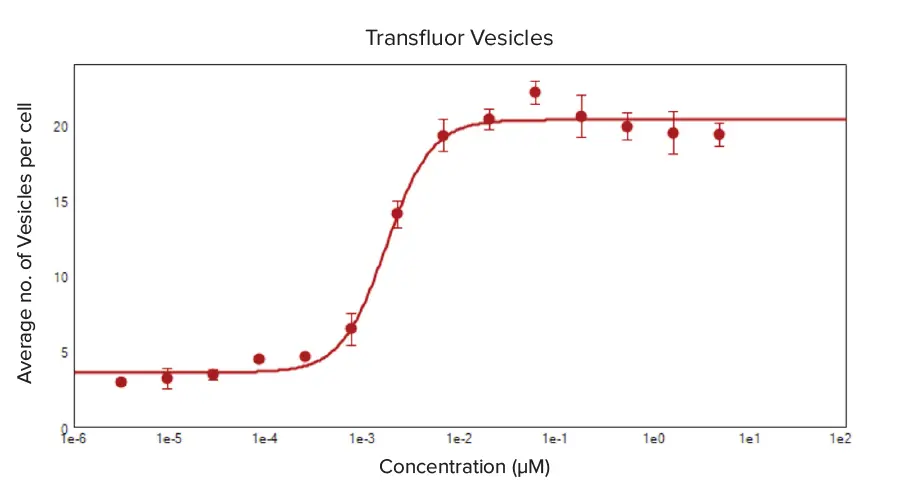
図3. イソプロテレノール処理による細胞あたりの平均小胞形成数の用量反応曲線 強化型ß2AR U2OS細胞は、イソプロテレノールの1:3段階希釈(5 μM~6.27 pM)処理によりß-arrestin-GFPエンドサイトーシス小胞を形成しました。CellReporterXpressソフトウェアの「Pits and Vesicles」解析で用量依存的な小胞形成を解析しました。細胞あたりの平均小胞数に対する4パラメータカーブフィットをイソプロテレノール濃度に対してプロットし、EC₅₀値は0.002 μMでした。
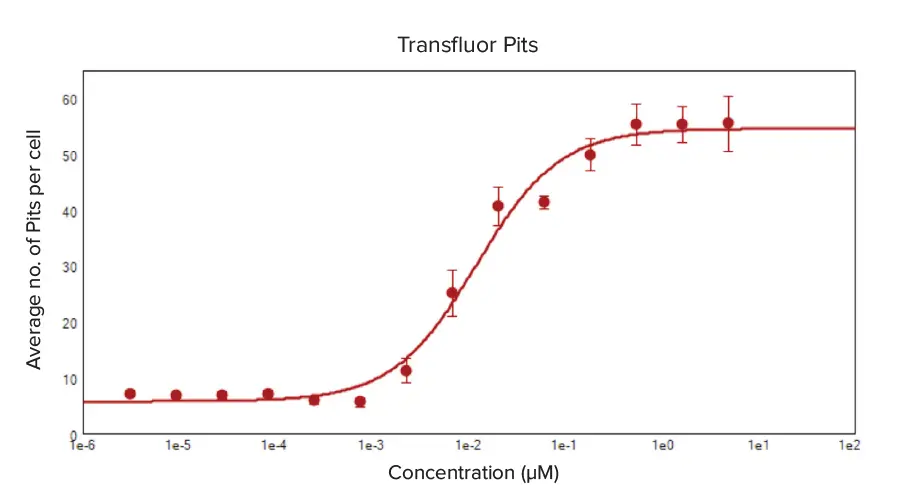
図4. イソプロテレノール処理によるß2AR-wt U2OS細胞のピット形成の用量反応曲線 野生型ß2ARを発現するU2OS細胞は、イソプロテレノールで4重複処理され、緑色蛍光を発するß2AR-ßarr-2-GFPピットを形成しました。CellReporterXpressの事前定義された「Pits and Vesicles」解析モジュールを最適化し、ピットの位置特定とカウントを行いました。ソフトウェア解析アルゴリズムにより細胞あたりの平均ピット数を算出し、各濃度のイソプロテレノール処理における4重複ウェルのデータを平均して4パラメータカーブフィットの用量反応曲線を作成しました。イソプロテレノールのEC₅₀値は0.012 μMでした。
結論
ImageXpress Nano自動イメージングシステムとCellReporterXpressソフトウェアは、ß2ARリガンドがTransfluor U2OS細胞に与える形態学的およびフェノタイプ的変化を効果的に評価しました。高解像度画像取得と多パラメータ画像解析の同期により、Transfluorアッセイの結果を効率的かつ正確に解析しました。CellReporterXpressソフトウェアの事前定義された「Pits and Vesicles」解析モジュールは、活性化されたß2AR GPCRへのß-arrestin-GFPのトランスロケーションによって形成されたピットと小胞を明確に識別・定量化しました。高度に情報性かつ生物学的に関連性の高いフェノタイプデータを生成することで、自動イメージングシステムとソフトウェアはリガンドとGPCRの関係解明を可能にします。
参考文献
- Doucette, Christopher, Kevin Vedvik, Elizabeth Koepnick, Aaron Bergsma, Brian Thomson, and Tammy C. Turek-Etienne. “Kappa Opioid Receptor Screen with the Tango™ ß-Arrestin Recruitment Technology and Characterization of Hits with SecondMessenger Assays.” Journal of Biomolecular Screening 14.4 (2009): 381-94. Web.
- Fennell, Myles. Transfluor Assay Development. 16 Sept. 2006. FLIPR Users Meeting. https://support.moleculardevices.com/s/. com/pdfs/Fennell_Wyeth.pdf
PDF版(英語)