Application Note スフェロイドの成長および形態の定量評価
- 簡便な取得および解析技術を用いた3Dスフェロイドの迅速な評価
- 化合物の影響をより深く理解するための集団レベルの情報の評価
- ラベルフリー技術を用いた生物学的相互作用の最小化
PDF版(英語)
はじめに
Andy Bashford博士|フィールドアプリケーションサイエンティスト|モレキュラーデバイス
Matteo Cattaneo博士|フィールドアプリケーションサイエンティスト|モレキュラーデバイス
3D細胞培養を用いたスクリーニングアッセイの開発は、近年ますます注目を集めています。一般的な手法としては、細胞を細胞外マトリックス内で培養することで、隣接する細胞との相互作用が促進され、より複雑な構造形成が可能になります。本稿では、ヒト大腸がん細胞株に対する抗がん剤の細胞毒性を評価するための簡便なアッセイをご紹介します。この方法は、スフェロイドの成長および大まかな形態的特徴を定量化するための、迅速かつ容易なアプローチを提供します。構造は蛍光核染色を用いて検出でき、CellReporterXpress®画像取得・解析ソフトウェアを使用することで、ウェル単位のサマリー情報および集団レベルの情報を評価することが可能です。また、ラベルフリー解析を用いることで、アッセイ準備時間を短縮したり、生細胞環境下での成長をモニタリングすることもできます。
本アッセイは、ImageXpress® Pico自動細胞イメージングシステムを用いて、3Dスフェロイドを自動的に評価するライブセル研究の初期段階でよく用いられる一般的な手法を示しています。この種のアッセイは、より複雑なメカニズム研究を行うための基礎情報を提供することができ、ImageXpress® Micro Confocalハイコンテントイメージングシステムなどの共焦点イメージングシステムを用いて実施することが可能です(*1–3)。
使用材料
- HCT 116細胞(ATCC)
- McCoy’s 5a培地 + 2 mMグルタミン + 10%胎牛血清(FBS)
- Corning® Matrigel膜マトリックス フェノールレッドなし(Corning)
- Corning® 96ウェル ハーフエリア ハイコンテントイメージング フィルム底マイクロプレート(Corning)
- DMSO溶解エトポシド;ウェル内最終濃度:3 μMおよび100 μM(Merck)
- メタノールフリー・超高純度ホルムアルデヒド;16%ストック溶液を4%に希釈(Polysciences)
- Hoechst 33342;PBS中75 μg/mLストック溶液を15 mg/mLに希釈(Invitrogen)
- ImageXpress® Pico自動細胞イメージングシステムおよびCellReporterXpress画像取得・解析ソフトウェア(モレキュラーデバイス)
- MetaXpress®ハイコンテント画像取得・解析ソフトウェア(モレキュラーデバイス)
方法
・HCT 116細胞を、96ウェルハーフエリアマイクロプレートにより:\( \frac{4{,}000\ \text{cells}}{50\ \mu\text{L}} = 80\ \text{cells}/\mu\text{L} \) で播種しました。ゲルの形成後、ゲルの上に50 μLの培地を加え、細胞を24時間培養しました。
・細胞にエトポシドを添加し、最終濃度が3 μMおよび100 μMとなるように調整し、72時間インキュベートしました。 培養物を室温で8時間ホルムアルデヒド固定しました。
・PBSで2回洗浄後、Hoechstで室温6時間染色しました。
・PBSで洗浄後、プレートを封印し、イメージングの準備を整えました。
・3D細胞培養は、ImageXpress® Pico自動細胞イメージングシステムを用いて、DAPIおよび透過光チャネルでイメージングしました。各ウェルにつき2箇所を10倍対物レンズで取得し、ハードウェアベースのオートフォーカスを用いて10 μm間隔の2つのZプレーンを取得しました。DAPI画像は、CellReporterXpress画像取得・解析ソフトウェアを用いて、ベストフォーカスの2D投影で解析しました。
・ラベルフリー画像解析は、MetaXpress®ハイコンテント画像取得・解析ソフトウェアを用いて実施しました。画像はMetaXpressソフトウェアにインポートされ、Custom Module Editorを使用して解析設定を行いました。
結果
スフェロイドのサイズと数に対する化合物の影響を評価
3Dスフェロイドは、Zスタック機能を用いることでマトリックス全体にわたってイメージングすることが可能です。10倍の倍率により、1視野あたり多数のスフェロイドを取得することができました。取得した画像は、2Dの最大投影およびベストプレーン投影画像に圧縮され、保存容量と解析時間の削減につながりました。
DAPI核染色を用いて3Dスフェロイドを解析し、スフェロイドの平均サイズと数を評価しました(図1A)。エトポシドは用量依存的にスフェロイドの平均サイズを減少させる効果を示しました。サイズは小さくなったものの、処理されたウェル内には多数のスフェロイドが依然として観察されました(図1B)。エトポシドの最高濃度では、デブリやシングルセルが多く発生しました。解析の精度を高めるため、これらは解析対象から除外し、スフェロイドのみを定量しました。
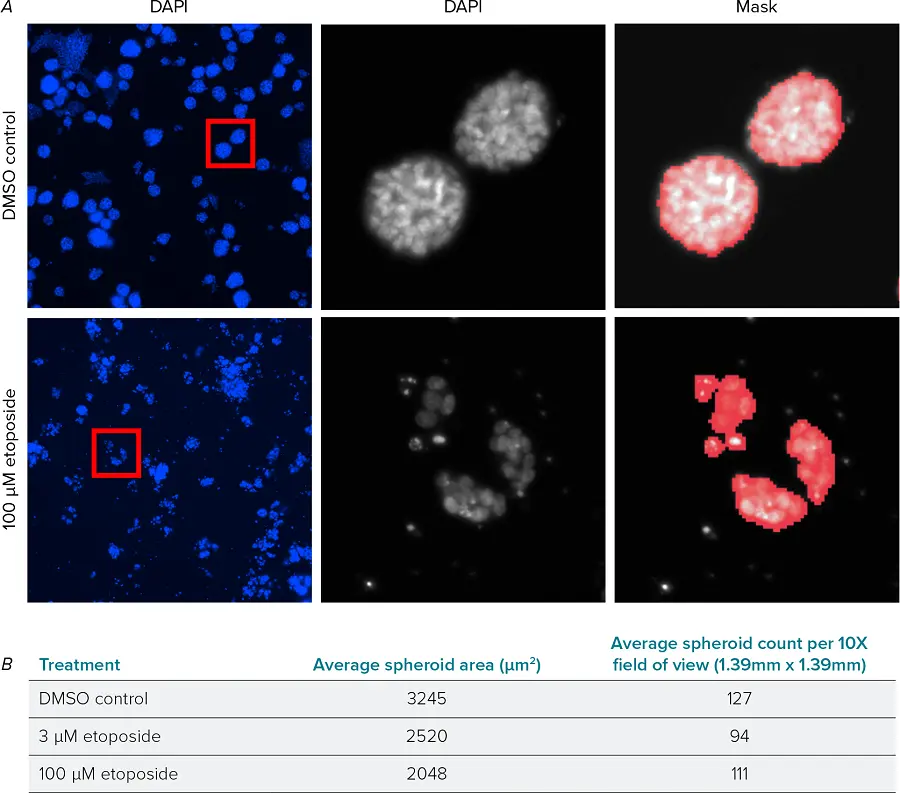
図1. DAPIで標識したスフェロイドの解析 A)ImageXpress® Pico自動細胞イメージングシステムで取得した、DMSOコントロール(上段)およびエトポシド処理(下段)ウェルのDAPI画像。視野全体(左)、切り出したスフェロイド(中央)、CellReporterXpress画像取得・解析ソフトウェアで作成した解析マスク(右)。B)DMSOコントロールおよびエトポシド処理ウェルにおける、平均スフェロイド面積および視野あたりの平均スフェロイド数を示すサマリー測定結果。各条件につき4ウェル、各ウェルにつき2視野から平均化。
スフェロイドの分布特性をオブジェクトレベルで評価
CellReporterXpressソフトウェアを使用して、ウェル内の各スフェロイドの集団をより深く理解するために、スフェロイド単位のデータを確認しました。また、集団レベルの測定データは.csv形式でエクスポートし、Microsoft Excelでさらに解析を行いました。データをボックスプロットとして可視化したところ、各条件において、集団の中で外れ値となる大きなスフェロイドが複数存在することが示されました(図2A)。一方、データを頻度プロットとして可視化すると、エトポシドの低濃度および高濃度のいずれにおいても、サイズが2500–5500 μm²の大きなスフェロイドの数が減少していることが分かりました(図2B)。 興味深いことに、高濃度のエトポシド処理では、サイズが500–2000 μm²の小さな構造体の数が増加していました。このことは、大きなスフェロイドサイズの減少には増殖抑制が関与している可能性がある一方で、より高濃度の化合物処理では細胞死やスフェロイド構造の崩壊がより大きな役割を果たしている可能性を示唆しています。
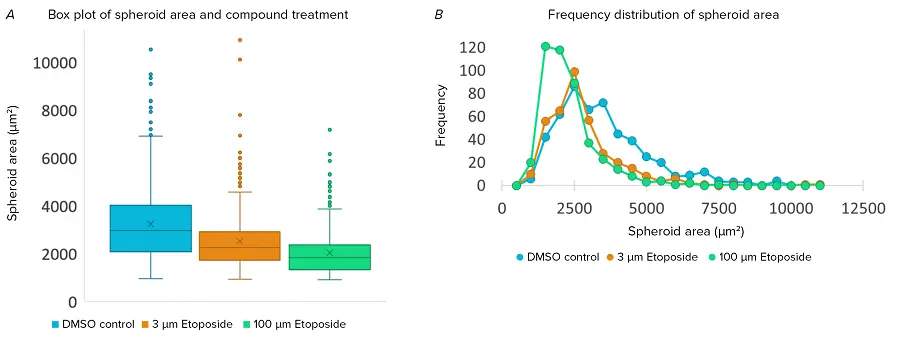
図2. スフェロイド面積の集団解析 A)スフェロイド面積の分布を示すボックスプロットとウィスカープロット。0 μMエトポシド(青)、3 μMエトポシド(オレンジ)、100 μMエトポシド(緑)。各条件につき4ウェルからデータを収集し、各ウェルにつき2視野を解析対象としました。B)スフェロイド面積の頻度分布(ビンサイズ:500 μm²)。処理済みウェルから得られた集団データを統合して表示しています。
スフェロイド形態のラベルフリー解析
透過光画像を用いたラベルフリー解析は、生物学的要因に干渉することなくスフェロイドの成長をモニタリングする優れた方法です。透過光画像はMetaXpressソフトウェアにインポートされ、スフェロイド構造のマスキングに使用されました。Custom Module Editorの柔軟性により、精度向上のために境界に接触している構造体を除外することが可能となり、形態学的データの抽出が行われました(図3)。
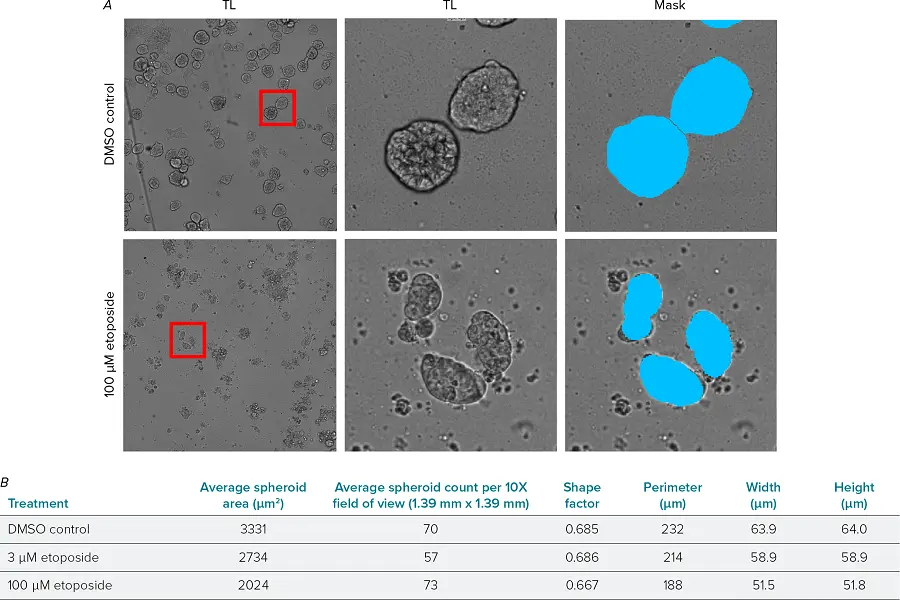
図3. スフェロイドのラベルフリー解析 A)DMSOコントロール(上段)および100 μMエトポシド処理(下段)ウェルの透過光(TL)画像。左:10倍の全視野画像、中央:切り出されたスフェロイド、右:Custom Module Editorを用いて作成された解析用マスク。 B)ラベルフリー解析によって得られた平均面積、スフェロイド数、形状係数、幅、高さの測定結果。各条件につき4ウェル、各ウェルにつき2視野から平均化したデータを使用しています。
平均スフェロイド面積の測定結果は、蛍光マーカー解析によって得られた値と非常に類似していました。低濃度のエトポシド(3 µM)処理では、平均スフェロイド面積が減少しましたが、形状係数はDMSOコントロールと同程度でした。一方、高濃度のエトポシド(100 µM)処理では、スフェロイドがより小さくなり、形状係数もわずかに低下しており、スフェロイドの形状がより不規則になっていることが示されました。このようなラベルフリー解析は、固定や染色の必要性を排除できるため、アッセイをより迅速かつ簡便に実施することが可能になります。また、ライブセル培養において、成長や形態の変化を経時的に追跡する用途にも活用できます。
結論
本研究では、蛍光ベースまたはラベルフリー解析を用いて、スフェロイドの成長および形態を評価するためのシンプルな手法を紹介しています。本アッセイでは、化合物処理に応じてスフェロイドサイズが用量依存的に減少することが示されました。イメージングプロトコールは、マルチウェルプレート全体にわたって容易に設定・自動化でき、3D細胞培養から迅速かつ簡便に結果を得たい場面において、幅広く応用可能です。また、ラベルフリー解析の有用性も示されており、ライブセル実験において3D培養の成長や形態変化を経時的にモニタリングする用途にも適しています。このような研究は、ImageXpress Picoシステムを用いることで容易に実施できます。本システムには、zスタックイメージング、Digital Confocal®による2Dオンザフライデコンボリューション、さらに「ディスコンティニュアス・タイムラプス」などのイメージング機能が搭載されており、後者は長時間のライブセル実験において、必要なタイミングでプレートを装置に戻すことが可能です。
得られたデータは、低濃度の化合物処理では増殖抑制が、そして高濃度では細胞死およびスフェロイド構造の崩壊が主な要因であることを示唆しています。作用機序をより深く理解するためには、スフェロイドの3D構造を体積的に解析し、細胞構成要素を定量化するような高度な実験が有効であり、これはImageXpress Micro Confocalシステムを用いて実施可能です(参考文献1–3)。これら2つのシステムを組み合わせることで、アッセイの複雑さに応じた最適な解析結果を得ることが可能になります。
参考文献
- アプリケーションノート:腫瘍モデルにおける毒性測定のための マルチパラメーター・イメージング・アッセイ
- アプリケーションノート:がん治療薬スクリーニングのための スフェロイドのハイスループット共焦点イメージング
- アプリケーションノート:ヒトiPSC由来神経細胞培養液を用いた3Dマトリックスにおける 神経細胞発生の形態学的特性評価のためのハイコンテントアッセイ
補足的な取得と分析方法
スフェロイドの成長と形態の定量化-化合物スクリーニングのための迅速でシンプルなアプローチ
プレートセットアップ
実験開始前に、細胞増殖に使用する同じバッチの空のマイクロウェルをImageXpress Picoシステムに挿入し、Measure Plate Dimensionsオプションを使用してウェル深さ、底厚、プレートクリアランスを設定しました。残りのプレート寸法は、製造元の文書に従って記入しました(図 S1)。
図 S1. CellReporterXpress ソフトウェアを用いて測定した Corning 96 A/2 フィルムボトム、ハイコンテントマイクロプレートのプレート寸法。
取得
Focus methodを'PlateAndWellBottom'に設定し、Focus offsetを0 μmに設定し、ExposureをDAPIおよび透過光ともに10 msに設定しました(図S2)。Zスタック画像取得を有効にし、Focus Stepを10μmに設定した2平面のスタックを、ウェルの底から+10および+20の位置で取得しました(図S3)。蛍光チャネルと透過光チャネルには、それぞれ最大投影と最良平面投影を選択しました。
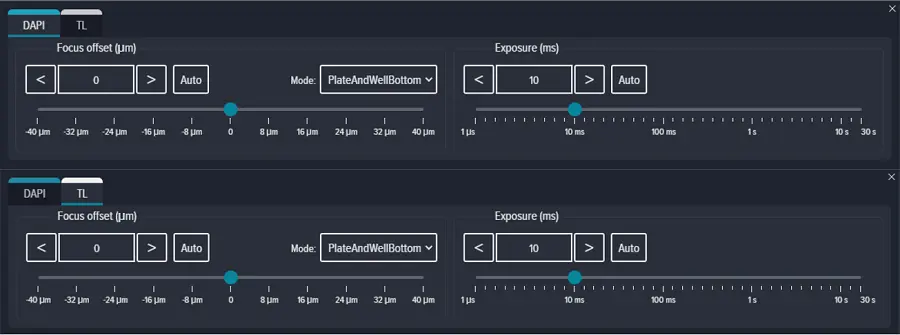
図S2. DAPIとTLチャンネルのプレーティングフォーカスオフセットと露光。
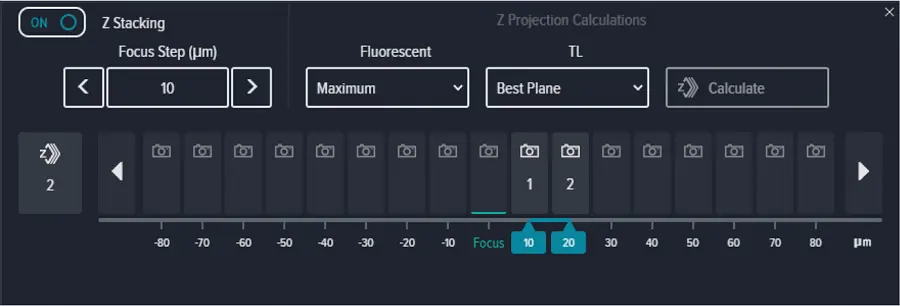
図S3. Z-スタック設定による最大面と最良面の2Dプロジェクション画像。
CellReporterXpress による分析
まず、Plate Annotation ツールを用いて、プレートに化合物と濃度をアノテーションしました。
蛍光 DAPI イメージは、CellReporterXpress ソフトウェアの Cell Count 解析(蛍光強度 = 100、最小幅 = 30、最大幅 = 100)を用いて解析しました。すべての Summary と Cell Measurements は「ON」に選択しました(図 S4)。
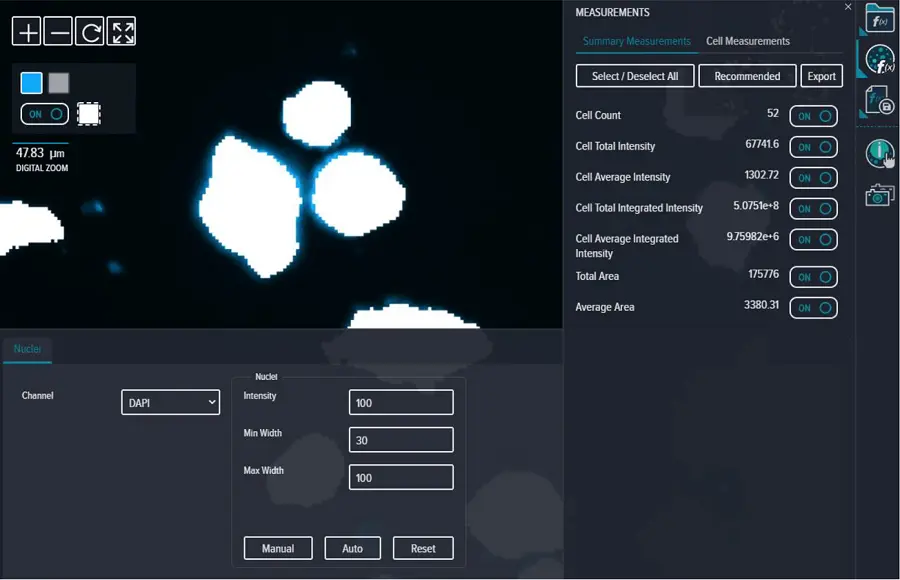
図S4. DAPI染色を用いたスフェロイド同定のための解析設定。
分析はプレート全体に対して実行され、対物レンズデータは「.csv」形式でエクスポートされました。このデータをMicrosoft Excelで開き、Box Plotと度数分布を用いて母集団情報を表示しました。
MetaXpress解析
Export Experiment Images ツールを用いて、CellReporterXpress ソフトウェアからフルサイズの'.tif' フォーマッ トとして、整理されたフォルダ構造で画像をエクスポートしました。
画像は MDCStore Xchange ツールとフォルダ構造と命名規則を認識するテンプレートを使用して、MetaXpress® ソフトウェアにインポートしました(図 S5、テンプレートはリクエストに応じて提供可能)。
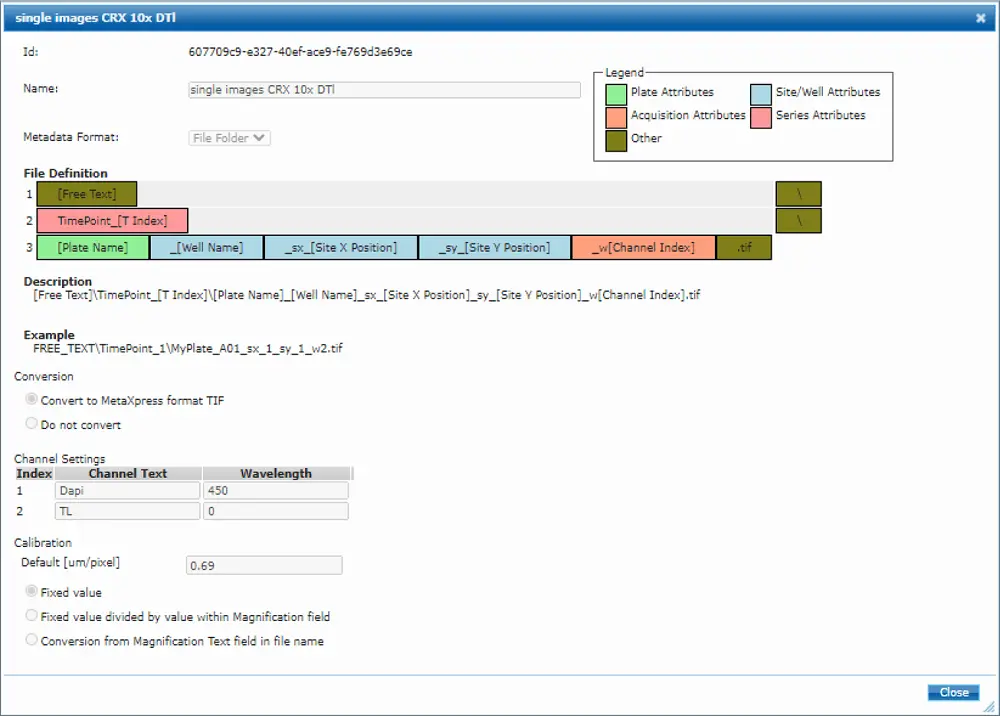
図S5. MetaXpress®ソフトウェアに画像をインポートするためのMDCStore Xchangeテンプレート。
透過光画像をカスタムモジュールエディターで解析しました。構造を認識し、エッジに接触しているものを除去するモジュールが設計されました(カスタムモジュールのダウンロードリンクは下記を参照)。解析はプレート全体に対して実行されました。
カスタムモジュールの手順
- HBasinThreshold = 1800
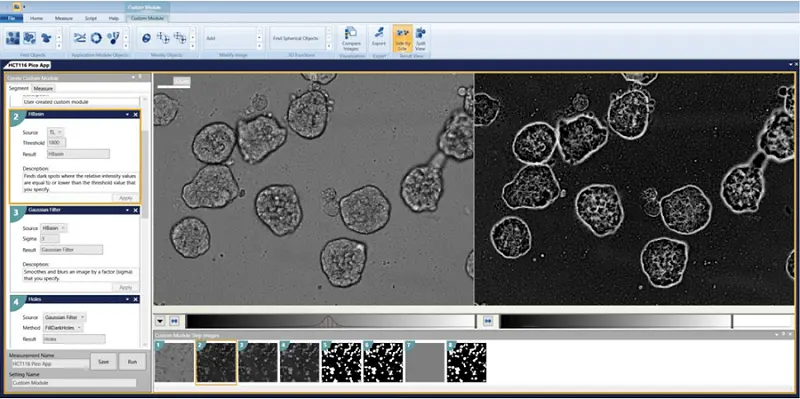
- Gaussian Filter Sigma = 3
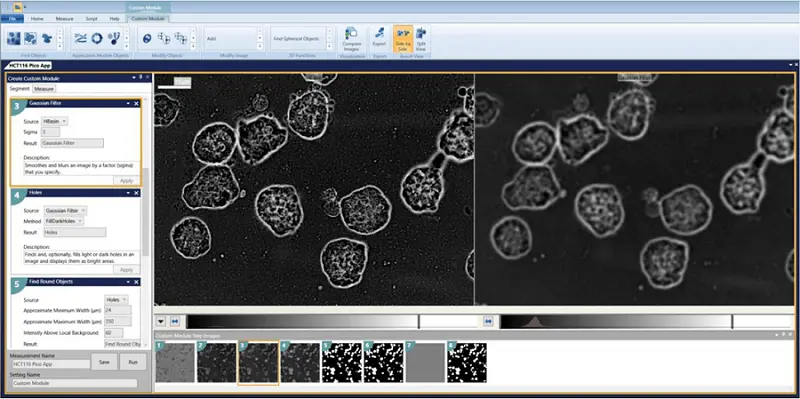
- Holes = FillDarkHoles
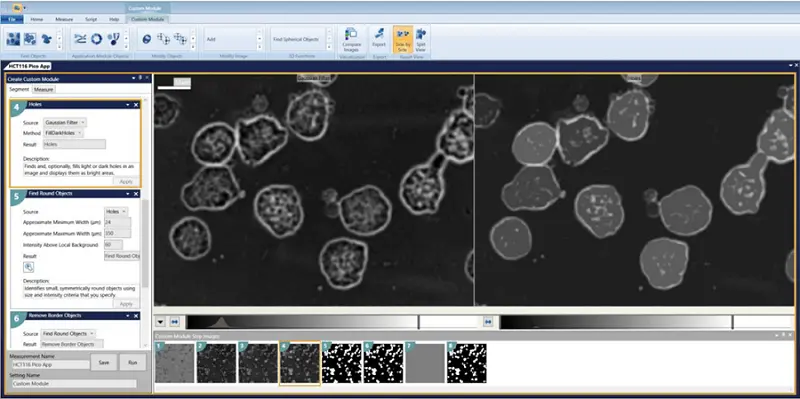
- Find Round Objects Minimum width = 24 Maximum width = 350 Intensity above local background = 60
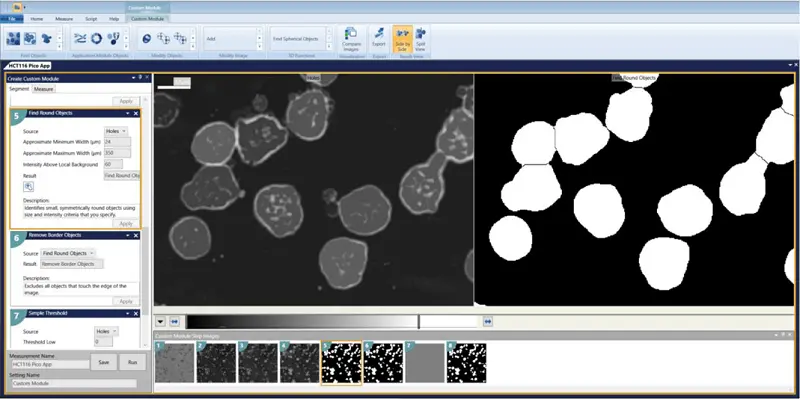
- Remove Border Objects
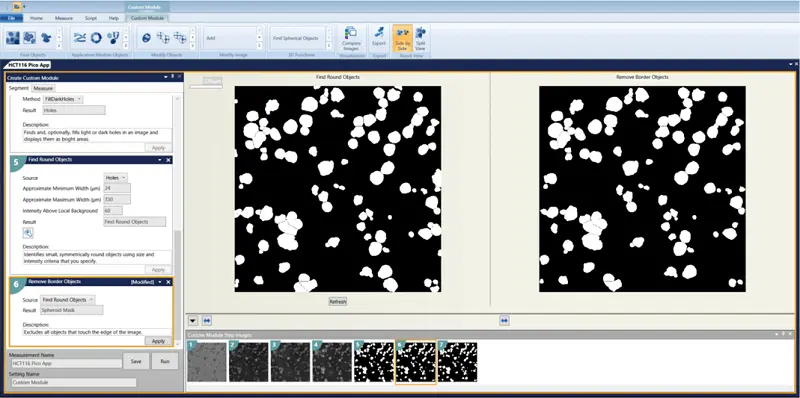
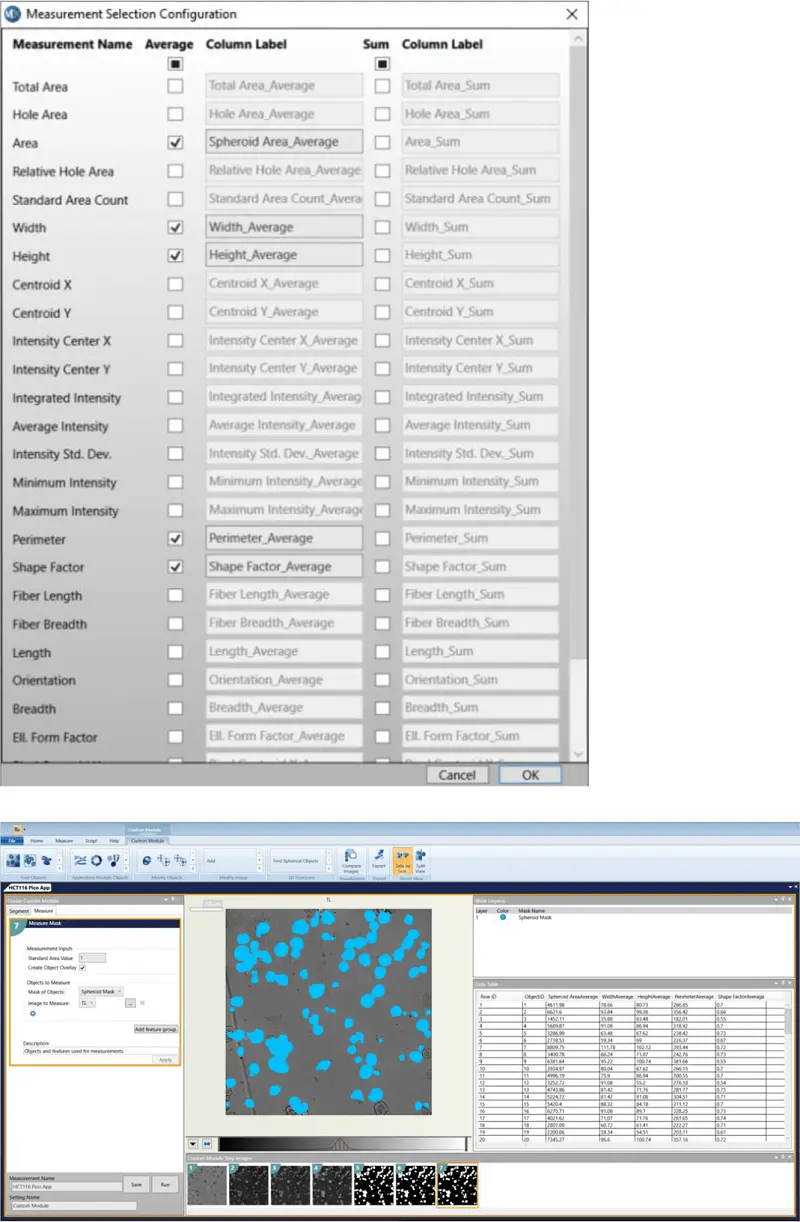
- Measurements to select: Area, Width, Height, Perimeter, Shape Factor
*ImageXpress Picoデジタルコンフォーカルは、AutoQuant 2D リアルタイムデコンボリューションを使用しています。
PDF版(英語)