Application Note カルシウムイメージングを用いた
網膜オルガノイドにおける光受容体の機能的活性の評価
- 網膜オルガノイドのリアルタイム機能評価を実現
- オルガノイド内の各領域におけるカルシウム振動をマッピングすることで、細胞機能に対する理解をより深めることが可能
- 神経・心筋・感覚器官オルガノイドなど、他のモデルにも応用可能であり、疾患モデルの構築や治療薬のハイスループットスクリーニングに幅広く活用が可能
PDF版(英語)
はじめに
Prathyushakrishna Macha、Oksana Sirenko|モレキュラーデバイス
Hardeep Singh、Yi Ting Lai、Nalinda Wasala、Alexandra Collin de l’Hortet|エピクリスパー・バイオテクノロジーズ社
ヒト人工多能性幹細胞(hiPSCs)由来の3D網膜オルガノイドは、網膜疾患の理解とモデル化を進める上で有望な手段です。これらのモデルは、網膜における空間的および時間的な分化を模倣し、網膜に存在する細胞種からなる層状構造を形成します。具体的には、光を感知する視細胞(通常オルガノイドの外縁部に位置)、網膜色素上皮(RPE)細胞(通常暗色)、および神経節細胞など、網膜に存在する多様な細胞種が再現されます。
本研究では、野生型(WT)またはロドプシン遺伝子にヘテロ接合変異を有するiPSCsを用いて網膜オルガノイドを作製しました。オルガノイドは、網膜様組織の形成を促進する成長因子を添加した培地中で150〜200日間培養されました。網膜細胞種の分化は、明瞭な構造の出現、外縁部の位相明るい層の形成、ならびに各細胞種に特異的なマーカーを用いた免疫蛍光解析により確認されました。
視細胞の機能評価は、自動化された共焦点イメージングシステムを用いてカルシウム濃度変動のイメージングおよび解析を行うことで実施されました。405/20nmの青色光による刺激に応答して生じるカルシウム活動のスパイクを解析する手法を開発し、網膜オルガノイドの外節/視細胞層におけるカルシウム振動を時系列データとして記録・解析しました。
領域特異的なカルシウム振動パターンについては、蛍光強度の標準偏差、ピーク数、振幅などの指標を用いて時間経過に沿って評価しました。野生型モデルでは、ベースラインと刺激後でパターンに明確な差異が認められ、蛍光強度の標準偏差が大きく増加しました。同一群内ではカルシウム動態およびパターンの一貫性が高く保たれておりましたが、疾患モデルでは明確なパターンは確認されませんでした。
この新たな手法は、ヒトiPSC由来網膜オルガノイドにおけるカルシウム振動の機能的特徴づけをハイコンテントイメージングおよび解析により実現するものであり、ハイスループットアッセイに適しているとともに、非対称性や領域特異性を有する多様なオルガノイドの比較に有望な手段を提供します。
方法
網膜オルガノイドの作製および培養
網膜オルガノイドは、STEMdiff™ Retinal Organoid Kitを用いて、野生型(WT)のヒトiPS細胞(hiPSC)から作製しました。hiPSCは、網膜組織の発生を促進する成長因子を添加した培地で培養されました。iPSCを播種後、チェッカーボードスクレイピング法によりオルガノイドを形成し、2〜3日ごとに培地交換を行いながら150〜200日間培養しました。この培養期間中に、オルガノイドは層状構造を形成し、外側領域には光受容体、さらにRPE細胞や神経節細胞などの特徴的な構造が発達しました。
網膜細胞種の同定
網膜細胞種の分化は、外縁部に位相明るい層が出現するなど、特徴的な網膜構造の形成を視覚的に確認することで評価いたしました。さらに、免疫蛍光染色を用いて網膜細胞種の存在を検証いたしました。桿体視細胞、双極細胞、神経節細胞に特異的なマーカーを用いて、それぞれの細胞種の分化を確認しております。画像取得および解析は、ImageXpress® Micro ConfocalシステムとMetaXpress® ハイコンテント画像取得・解析ソフトウェアを用いて実施し、免疫染色および細胞種特異的マーカーの定量化ならびにサンプル間の一貫性を確保しました。このハイスループット解析により、オルガノイドの形態を詳細に評価し、分化した細胞種の識別精度を向上させることが可能となります。
カルシウムイメージングおよび機能アッセイ
網膜オルガノイドにおけるカルシウム機能活性は、視細胞層におけるカルシウムスパイクおよび振動の記録を通じて評価されました。これらのカルシウム動態は、ピーク数、振幅、蛍光強度の変動といった指標に基づいて解析されました。イメージング前には、モレキュラーデバイスのCalcium 6 Dye Kitを用いて、培地とCalcium 6色素を1:1で混合した最終濃度5 µMの溶液にて2時間処理を行いました。早期活性化を防ぐため、インキュベーション中は暗所で保管されました。処理後、405/20nmの青色光による刺激を加えてカルシウム振動を誘導し、自動化された共焦点イメージングシステムを用いてカルシウム活性の時系列データを取得し、カルシウムフラックス動態を精密に定量化いたしました。この手法により、ベースラインと刺激後の状態を比較するハイスループット解析が可能となり、光刺激に対するオルガノイドの機能的応答性に関する詳細な知見が得られました。
ヒトiPSC由来網膜オルガノイドは、STEMdiff Retinal Organoid Kit(アルファテスト)を用いて作製されました。培養150日目(D150)には桿体視細胞の外節が出現し始め、200日目(D200)付近では外節が豊富に形成された成熟網膜オルガノイドが得られました。
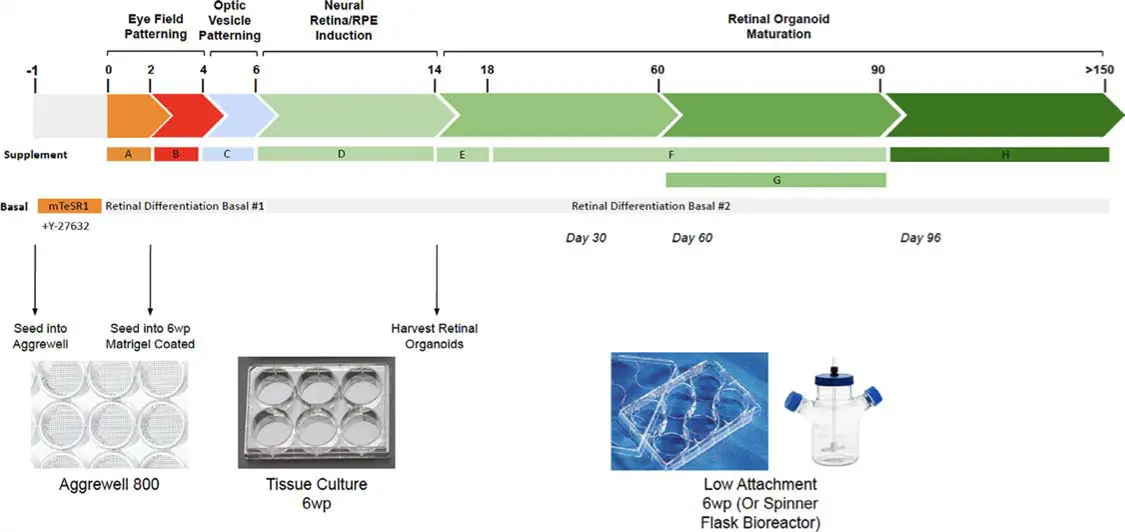
図1. 網膜オルガノイドの成長および分化の模式図
オプトジェネティクスのイメージング設定
このオプトジェネティクス実験では、複数波長対応のハイコンテントイメージングシステムを用いて、オルガノイドの刺激および活動の記録を行いました。実験では、DAPI(405/20nm)による選択的励起を行い、その後、FITC(520/28nm)を用いて光受容体の応答を記録しました。
オプトジェネティクス刺激には、DAPIチャネルを使用し、照射強度25%、露光時間30,000 msで励起を行いました。オートフォーカスはレーザーを用いて、Zオフセット -16.02 µm に設定しました。Zスタックはステップサイズ2.47 µm、範囲61.73 µmで取得し、深さ方向の正確なイメージングを確保しました。タイムラプスイメージングは、実験開始時のみ画像を取得する設定とし、励起に対するベースライン応答を記録しました。
応答の記録には、FITCチャネルを使用して蛍光の発光を検出し、露光時間は100 msに設定しました。照射強度は50%とし、明瞭な蛍光検出を可能にしました。オートフォーカスは、DAPIチャネル(W1)からのZオフセット0 µmで調整しました。Zスタックのステップサイズおよび範囲はDAPIチャネルと同様に設定しました。記録はすべてのタイムポイントで画像を取得するように構成し、蛍光変化の継続的なモニタリングを可能にしました。
これらの設定により、オプトジェネティクスによる活性化とそれに続く蛍光応答を精密に追跡することができ、オルガノイド内の神経活動の解析を高精度で実施することが可能となりました。
結果
網膜オルガノイドは、ヒト網膜の主要な特徴を再現しており、特に視細胞層においては、桿体および錐体細胞が秩序だった外節構造を形成し、光の検出に関与しています。これらの視細胞は頂端側へと伸長し、光の捕捉および視覚シグナルの開始に寄与します。ただし、すべての網膜オルガノイドが明瞭な網膜色素上皮(RPE)層を形成するわけではなく、特に成熟度の高いオルガノイドではその形成にばらつきが見られます。RPEが明確に形成されていない場合でも、視細胞は機能的な活性を示すことが可能です。
免疫蛍光(IF)染色により、網膜オルガノイドの層状構造が明示され、ヒト網膜に特徴的な桿体視細胞や双極細胞などの主要な網膜細胞種が同定されました。
これらの結果は、オルガノイド内で網膜細胞種が分化・組織化されており、ヒト網膜の構造に類似していることを示しています。
イメージング後、MetaXpressソフトウェアを使用して、光受容体層内の特定領域を選択し、活動解析を行いました。時間と蛍光強度の標準偏差を測定することで、光受容体の応答のばらつきを定量化します。このデータはグラフ化することで、異なる領域間の活動を比較でき、時間経過に伴う光受容体機能の理解に役立ちます。
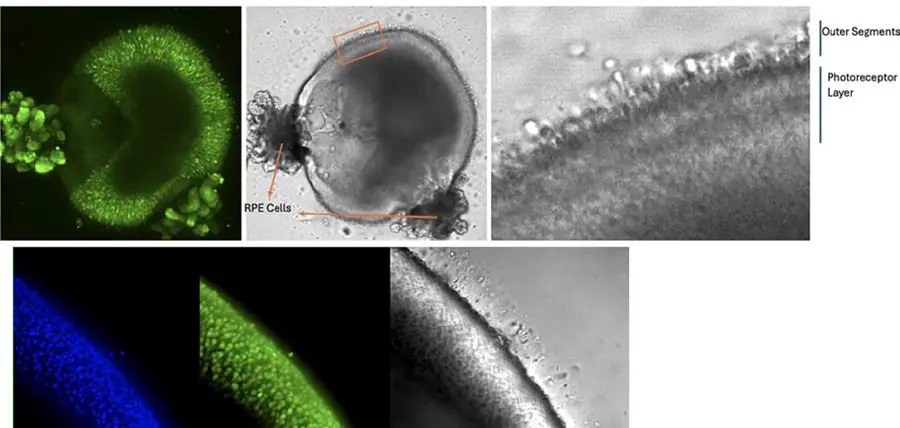
図2. 網膜オルガノイドの各種染色画像の提示 この図では、異なる染色法を用いてイメージングされた網膜オルガノイドの画像をそれぞれ示しています。DAPI(青)は細胞核を染色し、Phalloidin(緑)はアクチンフィラメントを可視化します。透過光(TL)画像では、オルガノイド全体の構造が確認できます。TL画像において、光受容体の外節領域には毛状の構造が見られ、これは成熟を示唆するものです。
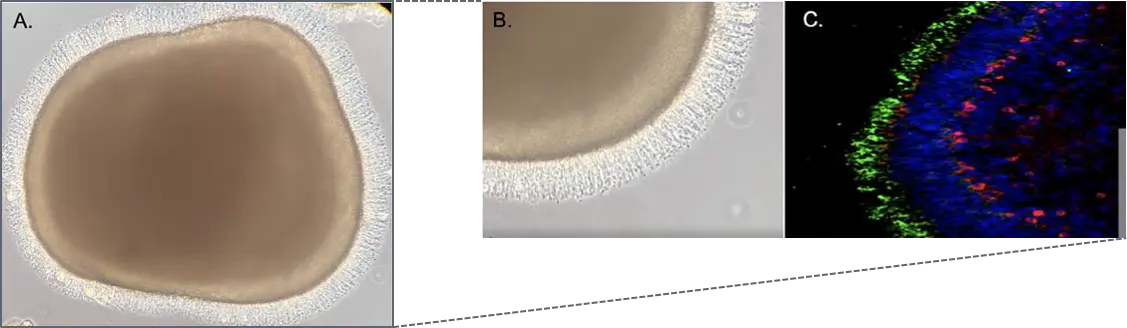
図3. AおよびBは、200日目のhiPSC由来網膜オルガノイドの透過光(TL)顕微鏡画像であり、光受容体の外節が豊富に形成されている様子が確認できます。Cは、222日目の野生型hiPSC由来網膜オルガノイドを凍結切片化し、免疫蛍光染色(IF)を行った画像です。染色結果では、青色が細胞核、緑色が桿体光受容体の外節に存在するロドプシン、赤色が双極細胞の特異的マーカーであるPKCαをそれぞれ示しています。
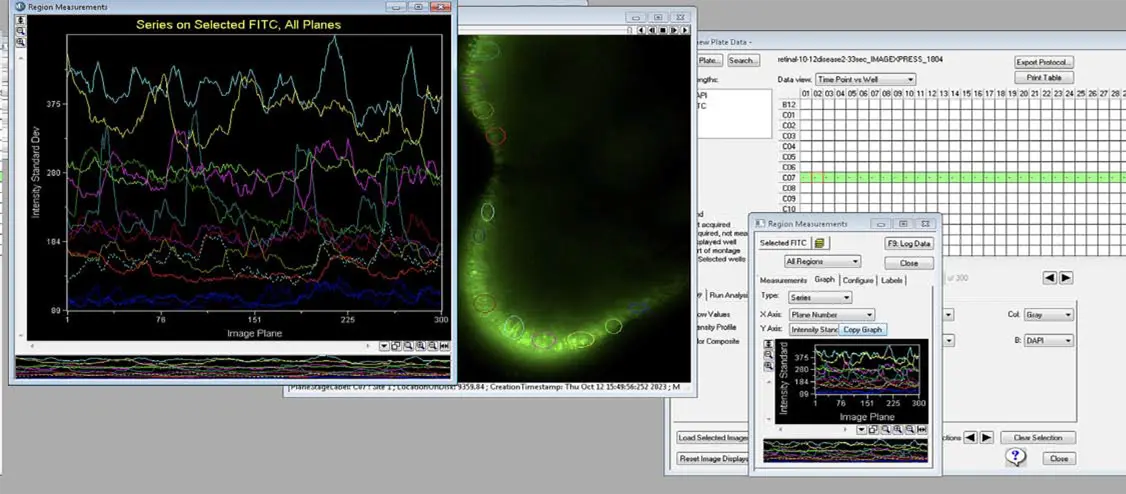
図4. MetaXpressソフトウェアによる領域選択設定と、視細胞活動の時間×強度標準偏差プロット
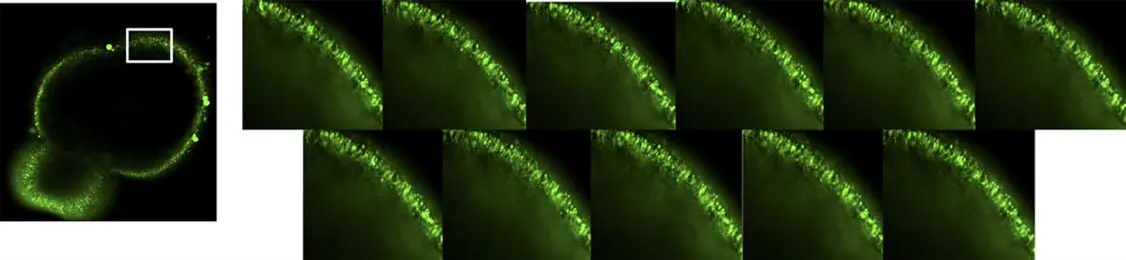
図5. 網膜オルガノイドの断面画像と視細胞活動の時系列変化 ImageXpress Micro Confocalシステムを用いて取得した網膜オルガノイドの4倍断面画像(左)と、同一領域の20倍画像を提示しています。100秒間にわたる時系列画像により、視細胞活動の変化とオルガノイド内部の動的応答が明らかとなりました。
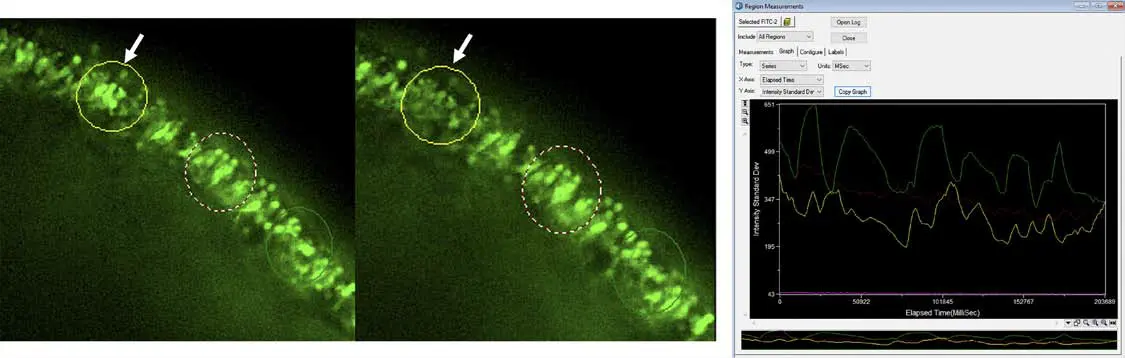
図6. 0倍画像では、網膜オルガノイド内でCalcium 6による蛍光活性が認められる特定領域が強調されています。強度の標準偏差と時間の関係を示すプロットにより、最も顕著な強度変化が(矢印で)示されています。Calcium 6の活性は、カルシウム流入および光受容体の活性化を制御する細胞膜上のゲート機構を調節します。
オルガノイドの解析(刺激応答および基礎活性)
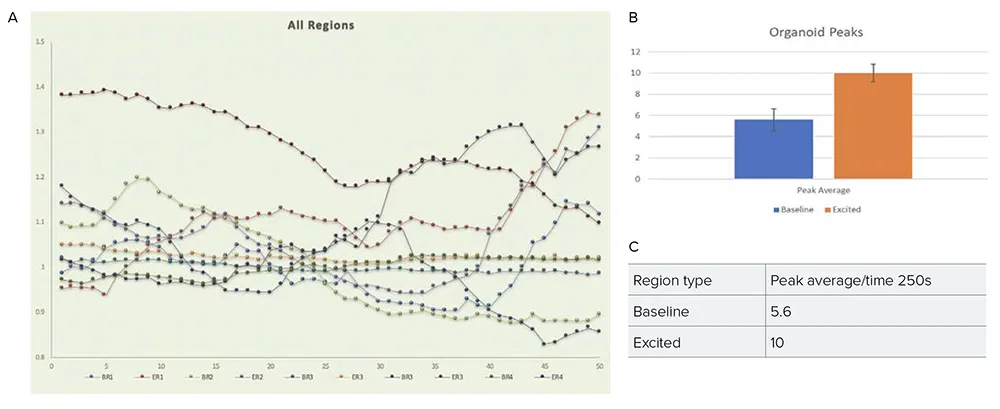
図7. 青色光(405/20nm)によるオプトジェネティクス刺激におけるカルシウムフラックスシグナルの代表的な時間経過トレース(強度の標準偏差)を示します。BR1〜BR4は、網膜オルガノイドの領域1〜4における基礎状態でのシグナル読み出しを示しており、ER1〜ER4は、同一領域に対して青色光刺激(405/20nm)を行った後の興奮状態での読み出しを示しています。
基礎活性を示さないオルガノイドを用いた解析
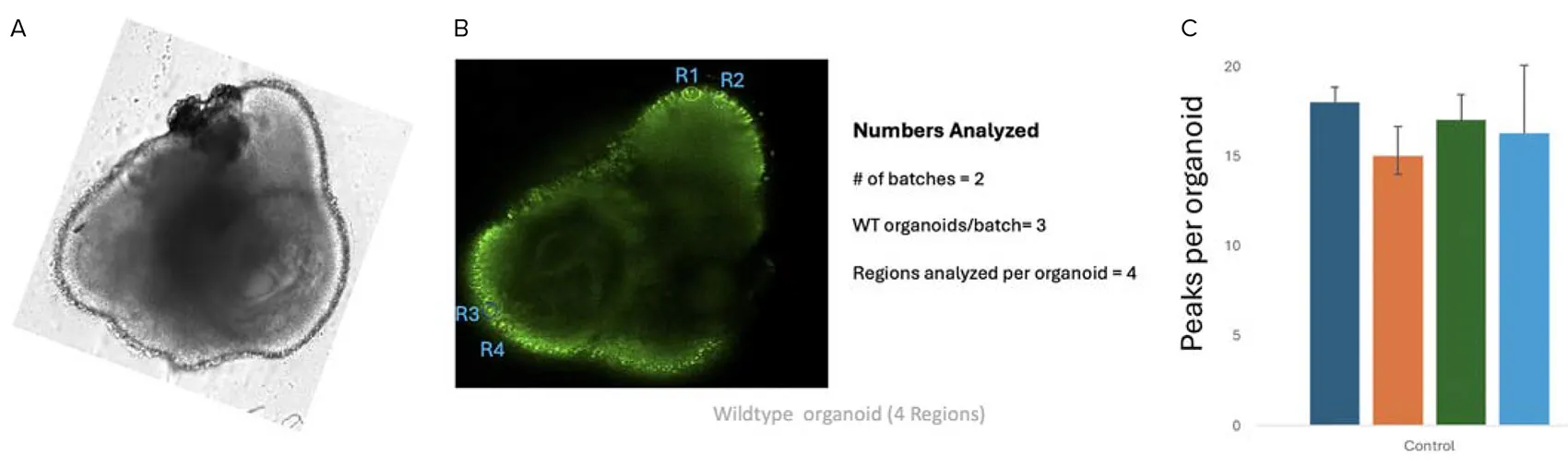
図8. A. 代表的な野生型網膜オルガノイドの透過光(TL)画像を共焦点顕微鏡で取得し、解析対象として選択された毛状の光受容体領域を強調表示しています。B. FITCチャネル(発光波長:520/28nm)で取得された網膜オルガノイドのCalcium 6画像。取得後に4つの領域(R1、R2、R3、R4)が選択されました。この解析では、1バッチあたり3つの野生型オルガノイドを含む2バッチを使用し、各オルガノイドから4領域を選定しています。C. 2つのバッチに含まれる野生型オルガノイドにおけるピーク数を示しており、各オルガノイドの各領域で観察されたピークの数を表しています。D. 同一オルガノイドの4領域(R1、R2、R3、R4)におけるFITCチャネル(発光波長:520/28nm)で記録された強度の標準偏差の時間変化プロット。これらのプロットは、オプトジェネティクス刺激後の各領域の活性を示しており、カルシウムフラックスの動態を時間的に捉えています。
結論
私たちは、hiPSC由来網膜オルガノイドにおける光受容体機能を評価するために、青色光刺激(405/20nm)に応答する領域特異的なカルシウム振動を解析するハイコンテントイメージング手法を開発しました。自動化された共焦点イメージングとハイコンテントアッセイ解析を用いて、強度の変動を定量化し、オルガノイド内の領域間で非対称な活性が存在することを明らかにしました。この手法により、野生型と疾患モデルオルガノイド間の機能的差異を検出することが可能となり、網膜研究における堅牢かつハイスループットなツールとして活用できます。さらに、本手法は疾患関連の機能障害の研究や治療候補化合物のスクリーニングに有用な枠組みを提供し、網膜オルガノイドをヒト網膜の生理・病態理解のモデルとして発展させることに貢献します。また、このイメージングおよび解析ワークフローは、他のオルガノイド系における非対称的な活性の研究にも応用可能であり、複雑な組織モデルへの展開が期待されます。
PDF版(英語)