Application Note SpectraMax i3 マルチモードマイクロプレートリーダーによる
GFPトランスフェクションの最適化
- トランスフェクト細胞と非トランスフェクト細胞の識別が容易
- 相対的トランスフェクション効率の定量データが正確に取得できます
- トランスフェクション前の細胞コンフルエンスを測定
- SoftMax Proソフトウェアを使用することで、レポーターアッセイの結果をより迅速に得ることができます
PDF版(英語)
はじめに
蛍光タンパク質、例えば緑色蛍光タンパク質(GFP)の発現は、しばしばレポーター遺伝子アッセイのリードアウトとして用いられます。典型的なレポーターアッセイでは、目的の遺伝子の制御配列は、容易に検出・測定できるレポーター遺伝子に結合されます。GFPレポーターを用いると、目的の遺伝子の活性が上昇で、細胞内での蛍光タンパク質の発現が増加し、蛍光マイクロプレートリーダーや蛍光イメージサイトメーターで測定することができます。
レポーターアッセイを行う最初のステップは、真核細胞にDNAを導入するトランスフェクションです。最良の結果を得るためには、まずトランスフェクションを最適化する必要があります。これには、異なるトランスフェクション試薬、異なるDNA量、DNAとトランスフェクション試薬の異なる比率を試すことが含まれます。細胞密度も重要であるため、いくつかの異なる細胞密度でトランスフェクションをテストすることは有益でしょう。異なるトランスフェクション条件の相対的有効性は、蛍光マイクロプレートリーダーやイメージングサイトメーターでモニターすることができます。
このアプリケーションノートでは、トランスフェクションが成功の鍵となるアッセイにおいて、SpectraMax® i3 マルチモードマイクロプレートリーダーとSpectraMax MiniMax® 300イメージングサイトメーターを使用してトランスフェクション効率をモニターし、結果を得るまでの時間を短縮する方法を示します。
方法
トランスフェクションの前日、96ウェル黒壁透明底プレートに、ウェル当たり15000、10000、および5000個の細胞を播種しました。翌日、トランスフェクションの直前に、SpectraMax MiniMax 300細胞計で透過光(TL)チャンネルを用いて細胞をイメージングし、SoftMax® ProソフトウェアとStainFree™ Cell Detection Technologyを用いて、各播種密度についてコンフルエンス率を算出しました。
各細胞密度において、細胞をトリプリケートウェルでトランスフェクションしました。DNAとトランスフェクション試薬の最適量を決定するために、4つの異なるトランスフェクション条件をテストしました(表1)。
| Test condition | DNA (µg) | Attractene(μL) |
|---|---|---|
| 1 | 0.1 | 0.25 |
| 2 | 0.1 | 0.37 |
| 3 | 0.2 | 0.5 |
| 4 | 0.2 | 0.75 |
表1. トランスフェクション条件。4つの異なるトランスフェクション条件を各細胞密度でテストしました。2種類のDNA量と4種類のトランスフェクション試薬量を評価しました。
| Tube | Opti-MEM (µL) | DNA µg (µL) | Attractene(μL) | Total Vol(µL) | Add to well (μL) |
|---|---|---|---|---|---|
| 1 | 500 | 1.0 (10) | 2.5 | 512.5 | 51 |
| 2 | 500 | 1.0 (10) | 3.7 | 513.7 | 51 |
| 3 | 500 | 2.0 (20) | 5 | 525 | 52 |
| 4 | 500 | 2.0 (20) | 7.5 | 527.5 | 53 |
表2. トランスフェクションのセットアップ。トランスフェクション複合体は、Opti-MEM培地、DNA、およびトランスフェクション試薬をバルク反応で結合させることにより形成しました。各テスト条件について10ウェルのトランスフェクションに十分な量の複合体を調製しました。
トランスフェクション後16時間目に、プレートリーダーで全蛍光強度を測定し、イメージングサイトメーターを用いてトランスフェクト細胞の割合を決定しました。細胞はTLと緑色蛍光チャンネルの両方を用いてイメージングしました。SoftMax® Proソフトウェアを用いて、TL画像中の細胞をStainFree解析アルゴリズムで同定し、さらにソフトウェアの分類機能により陽性(GFP発現)または陰性に分類しました。
結果
トランスフェクションの直前に細胞をイメージングし、StainFree解析を用いて各細胞密度におけるコンフルエンスパーセントを算出しました(図1)。
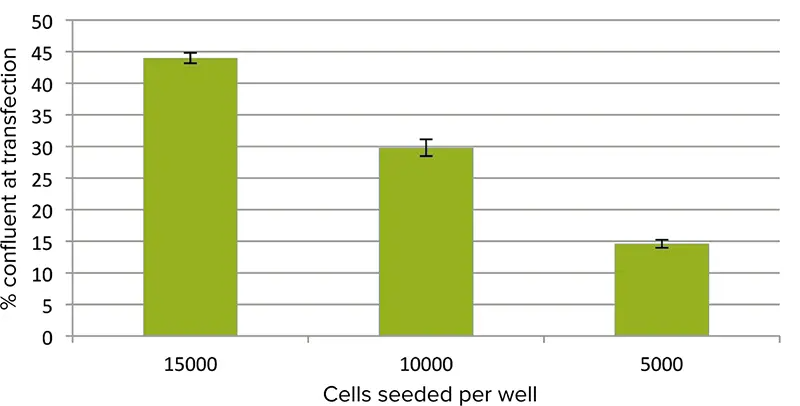
図1. 細胞コンフルエンス。トランスフェクション直前の細胞コンフルエンスのパーセントをイメージングサイトメーターを用いて測定しました。ウェルあたりの初期播種密度が15000、10000、および5000細胞の場合、測定されたコンフルエンスパーセントはそれぞれ44、30、および15でした。
トランスフェクション後16時間と21時間に、SpectraMax® MiniMax® 300イメージングサイトメーターのTLおよび緑色蛍光チャンネルを用いて細胞をイメージングしました(図2)。StainFree解析を用いて各ウェル内の個々の細胞を同定し、さらにSoftMax Proソフトウェアの分類機能を用いて細胞をGFP陽性またはGFP陰性に分類しました。細胞を陽性または陰性に分類するために、ソフトウェアの分類ツールを用いて、代表的な画像上の少数の細胞を陽性または陰性と定義しました。その後、アルゴリズムがこの情報をすべての画像に適用しました。ソフトウェアが算出したパラメータには、陽性率、平均対物レンズ強度、対物レンズ数、真円性、その他数種類が含まれます。
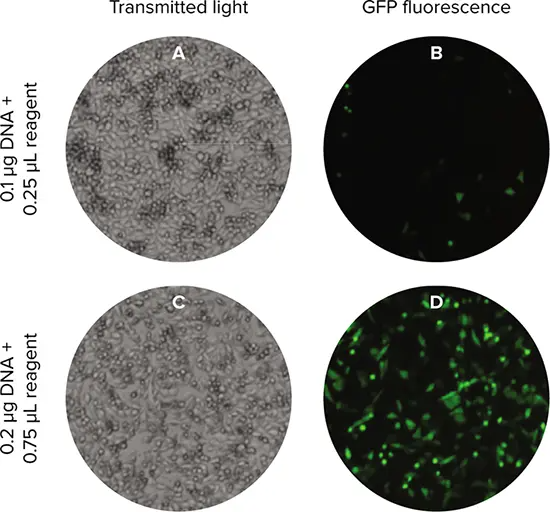
図2. トランスフェクト細胞イメージング。SpectraMax MiniMax® 300イメージングサイトメーターのTL(A、C)および緑色蛍光(B、D)チャンネルを使用してトランスフェクト細胞をイメージングしました。表示されている細胞は、1ウェルあたり15000細胞で播種しました。低トランスフェクション効率と高トランスフェクション効率の2つのトランスフェクション条件を示します。
テストした4つのトランスフェクション条件のうち、0.2 µg DNAと0.5 µLまたは0.75 µLのトランスフェクション試薬の組み合わせが、GFP発現細胞の割合が最も高くなると決定されました(図3A)。これらの条件では、細胞あたりの平均蛍光強度も最も高くなりました(図3B)。GFP発現はトランスフェクション後21時間の方が16時間よりも高かったです(16時間のデータは示していません)。
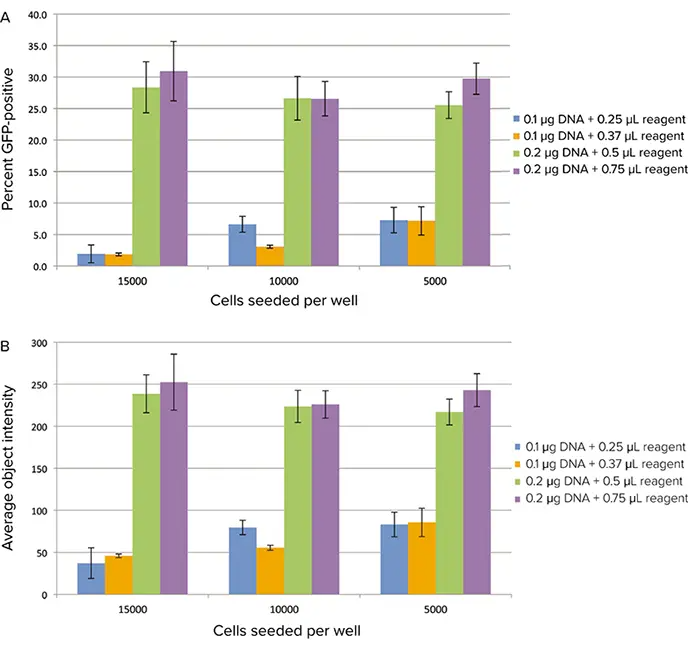
図3. サイトメーターで画像化したGFP発現。トランスフェクションした細胞をSpectraMax® MiniMax® 300イメージングサイトメーターでイメージングしました。A:ソフトウェアの分類機能を用いて計算したGFP陽性細胞の割合。B:細胞の平均蛍光強度。
GFP 発現は SpectraMax i3 プレートリーダーの蛍光プレート Read モードでも検出できました。トランスフェクション条件の違いによって、蛍光のレベルが異なることが明 確に識別できました(図4)。各ウェルの全蛍光が検出されたので、最も最適なトランスフェクション条件では、より高密度の細胞を封じ込めたウェルでより高いシグナルが検出されました。より完全な評価は、各細胞とその相対的な蛍光レベルを区別できる蛍光イメージングサイトメーターによって提供されます。
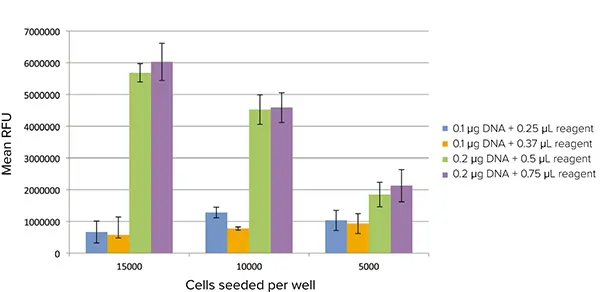
図4. プレートリーダーで検出されたGFP発現。トランスフェクトした細胞をSpectraMax i3 マルチモードマイクロプレートリーダーの蛍光モードで読み取りました。各トランスフェクション条件について、バックグラウン ドを差し引いた平均RFU値がプロットされています。
結論
蛍光レポーター遺伝子のトランスフェクション効率は、様々な方法でモニターすることができます。一つの方法は、マイクロプレートリーダーで蛍光を測定することです。この方法では、各テストウェルの全体的な蛍光レベルを評価することができますが、トランスフェクションされた細胞のパーセンテージは得られません。トランスフェクション効率を評価するためのより有益な方法は、検出可能な蛍光を発現している細胞数を全細胞数と比較できるイメージングサイトメーターを用いて細胞を分析することです。イメージングサイトメーターには、トランスフェクション前に細胞のコンフルエンスを計算できるという利点もあり、この情報をアッセイ開発の一部として利用することができます。
SpectraMax i3 マルチモードマイクロプレートリーダーとSpectraMax MiniMax 300イメージングサイトメーターは、GFPベースのレポーターアッセイのトランスフェクション条件を評価する両方の方法を可能にします。プレートリーダーでは、ウェルあたりの平均蛍光を高速かつシンプルに読み取ることができ、一方、サイトメーターでは、総細胞数や検出可能なGFPを発現している細胞の割合など、より詳細な情報を得ることができます。SoftMax Proソフトウェアは、これらすべてのデータの取得と解析を簡素化します。トランスフェクションを最適化する効率的なワークフローは、レポーターアッセイの結果までの時間を短縮します。
PDF版(英語)