Application Note FLIPR膜電位測定キットによる
NaV1.5チャネルアッセイの最適化
- 電位依存性イオンチャネルを標的とした化合物による膜電位変化の評価
- 洗浄ステップ不要のクエンチ技術でアッセイのばらつきを低減
- 2種類のクエンチ技術から選択可能なアッセイ最適化
PDF版(英語)
はじめに
Carole Crittenden|アプリケーションサイエンティスト|モレキュラーデバイス
電位依存性イオンチャネルは、心臓、骨格筋、脳、神経細胞などの興奮性細胞膜に存在しています。これらのチャネルを阻害または調節することは、治療効果をもたらす一方で、正常な細胞機能に干渉する可能性もあります。そのため、電位依存性イオンチャネルに作用する化合物は創薬において重要なターゲットとなっています。心筋NaV1.5チャネルは「テトロドトキシン(TTX)抵抗性 *1」に分類されており、抗不整脈薬の作用標的であるほか、リドカインなどの局所麻酔薬によっても阻害されます *2。
従来の電気生理学的手法では、NaV1.5チャネルはリドカインのような化合物によって状態依存性および使用依存性の阻害を示します。状態依存性阻害とは、チャネルが特定の電位依存性構造状態(例:閉状態、開状態、不活性状態)にあるときに、阻害剤がより結合しやすくなる現象です。使用依存性阻害とは、電圧パルスの繰り返し刺激によってチャネルが構造状態を循環することで、阻害剤が結合部位に累積的にアクセスしやすくなる現象です *3。これらの現象により、膜電位アッセイとパッチクランプ法の間で一部の化合物のIC₅₀値が変化することがあります。
FLIPR®膜電位測定キットは、電位依存性イオンチャネルを調節または阻害する化合物によって引き起こされる膜電位の変化を、迅速かつ信頼性の高い蛍光ベースの方法で検出することができます。試験化合物と膜電位色素の相互作用により、蛍光応答が変化し、化合物活性の推定値が変化する可能性があることが報告されています *4。
モレキュラーデバイスでは、FLIPR膜電位測定キットの洗浄不要タイプとして「Blue」と「Red」の2種類の製品を開発しました。両キットは同一の独自色素を使用しつつ、異なるクエンチャーを組み合わせることで、細胞株/チャネル/化合物への適用性を最大化し、データのばらつき要因を排除しています。ライブラリー中の化合物の化学的性質、自己蛍光の違い、色素が細胞種や受容体に与える影響などに応じて、片方のキットがより良好な応答を示す場合があります。アッセイ開発時には、スクリーニング対象ライブラリーの代表的な化合物を用いて両キットを比較することで、最適な応答条件を経験的に決定できます。本テクニカルノートでは、心筋NaV1.5チャネルを発現させたCHL細胞を用いて、テトロドトキシンおよびリドカインによる膜電位アッセイの機能性の違いを示し、FLIPR膜電位測定キット(RedおよびBlue)をFLIPR Tetra®システム上で最適化した結果を紹介します。
材料
- セルライン CHL(チャイニーズハムスター肺細胞)で安定発現させた電位依存性ナトリウムチャネルNaV1.5
- 培地 ダルベッコ変法イーグル培地(サーモフィッシャー)、5%ウシ胎児血清(Hyclone)、1%Pen/Strep/グルタミン(サーモフィッシャー)、450μg/mL Geneticin(サーモフィッシャー)
- アッセイバッファー: フェノールレッド無添加HBSS(サーモフィッシャー)および20mM HEPES(サーモフィッシャー)
- FLIPR膜電位測定キット(モレキュラーデバイス、赤のカタログ番号R8123、青のカタログ番号R8034)
- 384ウェル黒色壁、滅菌、TC処理、透明底プレート(Corning)
- ナトリウムチャネル調節薬:
◦ベラトリジン (シグマ)
◦リドカイン (シグマ)
◦テトロドトキシン (シグマ) - FLIPR Tetraシステム(モレキュラーデバイス)
方法
アッセイプレートの準備
384ウェルアッセイプレートを作製するために、NaV1.5細胞をトリプシン処理後、培地に再懸濁し、黒壁・透明底の384ウェルプレートに1ウェルあたり12,500細胞(25 µL)で播種しました。プレートは37°C、湿度95%、CO₂ 5%の条件で一晩インキュベートしました。
FLIPR膜電位測定アッセイ
膜電位アッセイの準備として、FMP RedおよびFMP Blue Assay Explorer Kitの試薬バイアル各1本を、それぞれ10 mLのアッセイバッファーに完全に溶解し、2枚分の染色用バッファーを調製しました。細胞プレートをインキュベーターから取り出し、培地や洗浄を行わずに、各ウェルに25 µLのRed染色バッファーを直接添加しました。染色後、プレートは37°Cで30分間インキュベートし、FLIPR Tetra®システムでアッセイを実施しました。ポリプロピレン製384ウェルプレートには、電位依存性ナトリウムチャネル開口剤であるベラトリジン、およびナトリウムチャネル遮断剤であるリドカインとTTXの5倍濃度の用量反応系列を調製しました。FLIPR Tetraシステム上で、NaV1.5細胞プレートにベラトリジンを添加し、細胞膜の脱分極に伴う蛍光変化を記録しました。ベラトリジンの80%最大応答濃度(EC₈₀)を決定しました。別の染色済み細胞プレートには、10倍濃度のチャネル遮断化合物を12.5 µL添加し、室温で15分間インキュベートしました。その後、FLIPR Tetraシステム上でEC₈₀濃度の5倍ベラトリジンを添加し、膜脱分極時の蛍光変化を記録しました。アッセイ終了後、リドカインおよびテトロドトキシンのIC₅₀濃度を算出し、GraphPad Prism 6グラフ作成ソフトウェアで結果を可視化しました。
| パラメータ | 設定 |
|---|---|
|
励起/発光波長 |
510–545/565–625 nm |
|
LED強度 |
80% |
|
カメラゲイン |
50 |
|
露光時間 |
0.4秒 |
|
読み取り間隔 |
1秒 |
|
ディスペンス量 |
12.5 µL |
|
ディスペンス高 |
20 µL |
|
ディスペンス速度 |
25 µL/秒 |
|
排出量 |
0.5 µL |
|
ディスペンスチップ上昇速度 |
6 mm/秒 |
表1. FLIPR膜電位測定アッセイ(384ウェルプレート)におけるFLIPR Tetraシステムの設定
結果
ベラトリジン:チャネル開口剤
電気生理学的アッセイでは、細胞膜に電圧を加えることでナトリウムチャネルを開状態にし、その後すぐに不活性状態へ移行させます。膜電位蛍光アッセイでは、ベラトリジンがチャネルの開状態を維持し、不活性化を防ぎます。これは、6つのトポロジー的に分離された毒素結合部位のうち、部位2に結合することで実現されます *5。細胞内へのNa⁺の急速な流入により膜が脱分極し、蛍光が増加します。図1に示すように、FMP RedおよびBlue Assay Kitを用いたベラトリジンへの細胞応答は類似しており、EC₅₀濃度はRedキットで26.6 µM、Blueキットで20.6 µMと、Redキットの方がわずかに右方シフトしています。
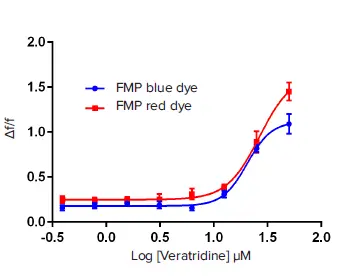
図1. ベラトリジンによるNaV1.5チャネル応答 遮断アッセイにおいて電位依存性チャネル開口剤として使用されたベラトリジンのEC₈₀濃度は33 µMと算出されました。
テトロドトキシン:チャネル遮断剤
テトロドトキシン(TTX)は、日本のフグから単離された強力なナトリウムチャネル遮断剤です。NaV1.5細胞にTTXの5倍濃度の用量反応系列を添加し、ベラトリジン(EC₈₀濃度)を加える15分前にチャネル開口を阻害しました。結果として、FMP RedキットのIC₅₀は6.2 µM、FMP Blueキットは6.3 µMであり、両キット間の蛍光変化は同等でした(図2)。さらに、ZファクターはRedキットで0.68、Blueキットで0.78でした。モレキュラーデバイスのIonWorks® Quattroシステムを用いた電気生理学的アッセイによるTTXの用量反応曲線(図3)では、IC₅₀値は2.4 µMでした。膜電位アッセイの結果は、従来のパッチクランプデータと類似しています *1。
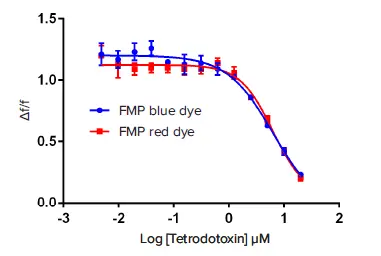
図2. CHL細胞におけるテトロドトキシンによるNaV1.5チャネルの調節 FLIPR膜電位測定キット(RedおよびBlue)を用いたテトロドトキシンのIC₅₀曲線の比較。
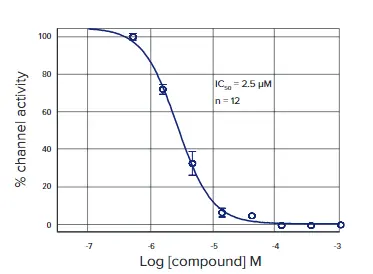
図3. 電気生理学的アッセイによるテトロドトキシンの用量反応曲線 IonWorks HT装置を用いた電気生理学的アッセイにより、TTXのIC₅₀値は2.4 µMと算出されました。PatchPlate™基板(1ウェル1ホール)を使用し、各データポイントは12ウェル分をプールしています。化合物添加後に残存する電流の割合の平均 ± SD をプロットしています。
リドカイン:使用依存性チャネル遮断剤
リドカインは、ナトリウムチャネルを使用依存的に遮断する局所麻酔薬です。IonWorksによる電気生理学的データ(図4、パネルA)では、Pulse 1からPulse 10までの電流を比較し、パルストレインとNa⁺電流の生データを示しています。リドカインの用量反応曲線(図4、パネルB)では、Pulse 1でのIC₅₀は886 µM、Pulse 10では262 µMでした。使用依存性の証拠として、Pulse 1からPulse 10に進むにつれて、チャネルが閉状態、開状態、不活性状態を循環し、リドカインが開状態および不活性状態に曝露される時間が累積的に増加します。これにより、Pulse 10での用量反応曲線が左方シフトする結果となります。
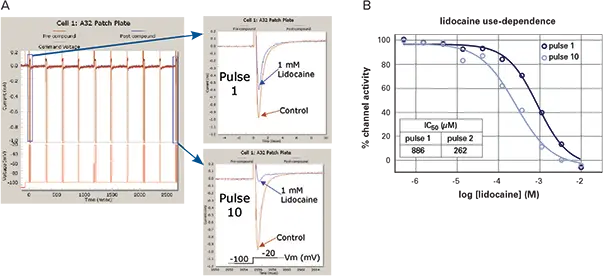
図4. 使用依存性の測定(A)使用依存性を測定するための電圧パルスプロトコール(左)。保持電位 -100 mV から試験電位 -20 mV への10パルスプロトコールにより電流を誘発。パルストレイン電圧プロトコールにおけるPulse 1(右上)およびPulse 10のNa⁺電流の生データ。データは、モレキュラーデバイスのIonWorks Quattro™装置を用いてPopulation Patch Clamp™(PPC)モードで取得。PPCでは、各ウェルに存在する64ホールに密着した細胞からの平均電流を測定。各データポイントは、化合物添加後に残存する電流の割合を示す単一PPCウェルの電流を表す。
FLIPR膜電位測定キットの結果(図5)では、FMP RedキットのIC₅₀は約52.4 µM、FMP BlueキットのIC₅₀は約135.6 µMでした。Z’ファクターは両キット間で同等でした。このアッセイでは、電気生理学的アッセイと比較して高いポテンシーが測定されることが予想されます。これは、ベラトリジンがチャネルを開状態に固定することで、リドカインへの曝露が最大化され、見かけ上のポテンシーが増加するためです。FLIPRアッセイで有望な化合物が同定された場合は、自動パッチクランプ法によるフォローアップスクリーニングが推奨されます。
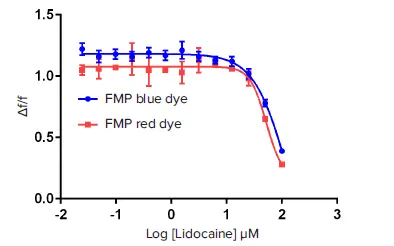
図5. CHL細胞におけるリドカインによるNaV1.5チャネルの調節 リドカインのIC₅₀曲線の比較。NaV1.5チャネルの使用依存性により、FLIPR膜電位測定キットで得られたIC₅₀値は、図4に示されたパッチクランプ結果と比較して左方シフトしています。
結論
ベラトリジンは、電圧の代わりにナトリウムチャネルを開く手段として使用でき、ハイスループット膜電位スクリーニング戦略において、チャネル調節化合物の同定に有効です。電気生理学的アッセイのPulse 1でのIC₅₀値と比較すると、FMPアッセイでのリドカインのIC₅₀値は大幅に小さく、これは既報と一致しており、CHL細胞中のNaV1.5チャネルの多くが閉状態ではないことを示唆しています。2種類のキットオプションがあることで、特定の細胞種や化合物クラスに対して最適な膜電位アッセイを構築することが可能です。本研究では、FLIPR膜電位測定キット(RedおよびBlue)の両方が、ベラトリジン、テトロドトキシン、リドカインに対して良好な結果を示しました。
参考文献
- J. Satin, J.W. Kyle, M. Chen, P. Bell, L.L. Cribbs, H.A. Fozzard, et al. A mutant of TTX-resistant cardiac sodium channels with TTX-sensitive properties. Science 1992; 256:1202-1205.
- W.A. Catterall, A.L. Goldin, S.G. Waxman. International Union of Pharmacology. XLVII. Nomenclature and structure-function relationships of voltage-gated sodium channels. Pharmacol Rev 2005; 57:397-409.
- B. Hille. Ion Channels of Excitable Membranes, Edn. Third. (Sinauer Associates, Sunderland; 2001).
- C. Wolff, B. Fuks, P. Chatelain. (2003) Comparative Study of Membrane Potential Sensitive Fluorescent Probes and Their Use in Ion Channel Screening Assays. J Biomol Screen, 8, 533 – 543.
- S. Cestele, R.B. Ben Khalifa, M. Pelhate, H. Rochat, D. Gordon. Alpha-scorpion toxins binding on rat brain and insect sodium channels reveal divergent allosteric modulations by brevetoxin and veratridine. J Biol Chem 1995; 270: 15153-15161.
- J. Zhang, et. al. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays, J Biomol Screen 1999, Vol. 4, (2) 60-73.
PDF版(英語)