Application Note ImageXpress Picoで実現する
細胞フェノタイプの高精度評価
- さまざまな細胞フェノタイプを取得し、自動イメージングの効率性について学びます
- あらかじめ設定された解析モジュールを使用して数値データを取得します
- 化合物処理に応答する多様な形態変化を評価します
PDF版(英語)
はじめに
Matthew Hammer、Oksana Sirenko(PhD)|アプリケーションサイエンティスト|モレキュラーデバイス
自動細胞イメージングは、形態、細胞生存率、マーカー発現など、細胞フェノタイプに対する化合物の影響を解析する効率的な方法です。ここでは、ImageXpress® Pico 自動細胞イメージングシステムとCellReporterXpress 画像取得・解析ソフトウェアを用いて、化合物の影響に関するフェノタイプ解析を実施する方法をご紹介します。イメージングおよび解析手法は、細胞生存率の評価、細胞形状の特徴付け、細胞接着とスプレッディング、細胞骨格の完全性、ミトコンドリア膜電位など、複数のリードアウトを特徴付けるためのツールを提供します。
材料
- HeLa細胞(ATCC)
- HeLa培地
◦DMEM:CellGro、L-グルタミン入り(コーニング)
◦10% FBS (BenchMark™; Gemini)
◦1% ペニシリン/ストレプトマイシン
- スタウロスポリン(Sigma)
- マイトマイシンC(Sigma)
- パクリタキセル(Sigma)
- エトポシド(Sigma)
- ドキソルビシン(Sigma)
- カルセインAM
- EarlyTox Live Cellアッセイキット(Explorer Kit、モレキュラーデバイス P/N R8342)
- Hoechst 33342(Thermo Fisher)
- MitoTracker Orange cMTMRos(Thermo Fisher)
- AF488標識ファロイジン(Thermo Fisher)
- 384ウェル黒色透明底マイクロプレート(Corning Falcon)
- ImageXpress Pico 自動細胞イメージングシステムおよび CellReporterXpress 画像取得・解析ソフトウェア
方法
化合物が細胞フェノタイプに与える影響をモニタリングするため、HeLa細胞に細胞増殖を阻害し細胞死を誘導することが知られている薬剤を処理しました。HeLa細胞は、384ウェル黒色クリアボトムマイクロプレートに、1ウェルあたり2,000細胞、培地総量25 µLで播種し、37°C、5% CO₂で24時間インキュベートしました。その後、スタウロスポリン、マイトマイシンC、パクリタキセル、エトポシド、ドキソルビシンを含む化合物の段階希釈液で72時間処理しました。化合物処理は3連または4連で実施しました。
72時間後、細胞は複数の染色剤で染色しました:核染色Hoechst 33342、生存率染色Calcein AM、膜電位が保持されたミトコンドリア検出用MitoTracker Orange™ CMTMRos試薬。2倍濃度の染色液を培地に直接添加し、最終濃度はHoechst 33342が3 µM、MitoTracker Orange CMTMRosが0.2 µM、Calcein AMが1 µMでした。細胞は染色液とともに37°C、5% CO₂で30分間インキュベートしました。
細胞はライブイメージングで、Hoechst、Calcein AM、MitoTracker Orangeに対してそれぞれDAPI、FITC、TRITCチャネルを使用してイメージングできます。10X対物レンズを用いて、各ウェルの1サイトで単一画像を取得しました。露光時間はDAPIで20 ms、FITCで10 ms、TRITCで200 msに設定しました。細胞は固定して後でイメージングしたり、追加の細胞マーカーでさらなる処理を行うことも可能です。注:Calcein AMはライブセル評価に使用され、固定後は検出できません(データ非表示)。MitoTracker OrangeおよびHoechst 33342核染色は固定後も安定です。
アクチン細胞骨格の完全性を評価するため、細胞は固定後に追加処理を行いました。Mitotracker OrangeとHoechst 33342で染色後、細胞は4%ホルムアルデヒド溶液で固定し、PBSで2回洗浄しました。次に、細胞膜をDPBS + 0.01%サポニン + 1% FBSで10分間透過化しました。AlexaFluor® 488(AF488)標識ファロイジン染色を用いて細胞骨格の完全性を評価しました。ファロイジンは透過化バッファーで1:50に希釈し、37°Cで2時間インキュベートしました。細胞はPBSで洗浄後、CellReporterXpressソフトウェアのCell Scoring解析モジュールを用いて、AF488で染色された細胞骨格を定量化するためにイメージング・解析しました。
ライブセルまたは固定細胞をImageXpress Picoシステムでイメージングし、CellReporterXpressソフトウェアで解析しました。1つはFITCをマーカーとして検出し、カルセインAMまたはファロイジン陽性細胞の数を定量化するもので、もう1つはTRITCをマーカーとして検出し、ミトコンドリア染色陽性細胞を分析するものです。両分析プロトコールとも、細胞数と核の特徴付けには核染色を用いました。
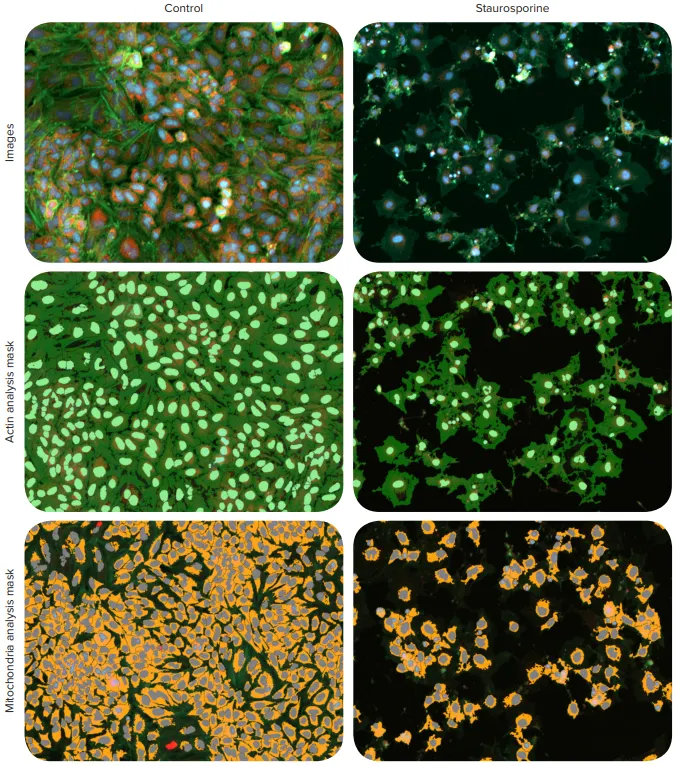
図1. 細胞生存率と形態のマルチパラメトリック解析のための画像と解析マスク HeLa細胞は複数の化合物で72時間処理後、核染色(Hoechst 33342)、アクチン細胞骨格染色(AlexaFluor 488(AF488)標識ファロイジン)、ミトコンドリア染色(MitoTracker Orange CMTMRos)で染色しました。代表的な画像と解析マスクは、コントロール細胞と0.1 µMスタウロスポリン処理細胞の比較を示します。細胞はImageXpress Picoシステムで10X Plan Fluor対物レンズを用い、DAPI、FITC、TRITCチャネルでイメージングしました。画像(上)は核(青)、アクチン細胞骨格(緑)、ミトコンドリア(オレンジ)を示します。画像はCellReporterXpressソフトウェアで解析され、ファロイジン陽性細胞の定量化に最適化されたCell Scoring解析モジュール(中)とMitoTracker Orange陽性細胞(下)を使用しました。解析マスクは、ライトグリーン=アクチン陽性核、ダークグリーン=アクチン細胞骨格、ブルー=ミトコンドリア陽性核、レッド=ミトコンドリア陰性核、オレンジ=膜電位保持ミトコンドリアを示します。
フェノタイプ効果の自動イメージングと解析による定量化
典型的な自動細胞ベースアッセイのワークフローには、細胞播種、化合物処理、自動イメージングが含まれます。マルチカラー・マルチパラメータアッセイでは、Calcein AMを使用してライブセル数や細胞スプレッディングを定義し、細胞形態を識別できます。核染色はセルカウント、増殖評価、核の強度や形状測定に使用します。MitoTracker染色はミトコンドリアの完全性や膜電位を定義できます。細胞はライブイメージングまたは固定後に追加試薬(例:ファロイジン)で染色し、細胞骨格やその他のリードアウト情報を取得できます。ファロイジンによるアクチン細胞骨格染色は、細胞骨格の構造、スプレッディング、形態評価、完全な細胞数の定量化に使用できます。
CellReporterXpressソフトウェアは、事前設定された解析モジュールを用いて、画像取得と解析を同時に実行し、アッセイ結果の作成を効率化します。Cell Scoringは、細胞生存率、ミトコンドリアの健全性、細胞骨格の完全性を解析するために最適化されています。解析では、総セルカウント、マーカー特異的細胞数の定量化、マーカーの強度および積分強度値、細胞の総面積と平均面積、核の平均面積と強度など、複数のリードアウトが生成されます。
図1は、核染色Hoechst、アクチン細胞骨格染色AlexaFluor 488(AF488)標識ファロイジン、ミトコンドリア膜電位評価用MitoTracker Orange染色の3種類で染色したコントロール細胞とスタウロスポリン処理細胞の複合画像を示します。検出された核、完全なアクチン細胞骨格、完全なミトコンドリアの解析マスクが両処理条件下で表示されています。
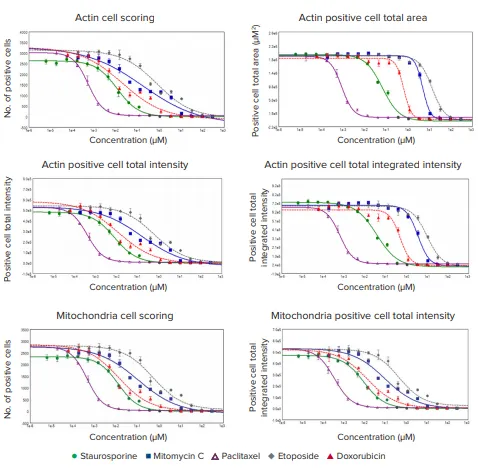
図2. 濃度反応曲線は化合物処理がさまざまなパラメータに与える影響を示します HeLa細胞はImageXpress Picoシステムでイメージングし、CellReporterXpressソフトウェアで解析しました。Cell Scoringモジュールは、AlexaFluor 488ファロイジンで染色された完全なアクチン細胞骨格と、MitoTracker Orangeで標識された完全なミトコンドリアを測定するよう最適化されています。4パラメータロジスティック曲線プロットは、CellReporterXpressで生成されたデータポイントを使用し、SoftMax® Proソフトウェアで作成しました。濃度反応曲線は、複数のリードアウトに対する各化合物の影響を示します。対応するEC₅₀値は表1に記載されています。
異なるリードアウトに対する濃度依存性は図2に示されています。ファロイジン染色細胞の総数で決定されたライブセルは、化合物濃度の増加に応じて減少しました(図2)。同様の傾向がMitoTracker陽性細胞でも観察されました。ファロイジンおよびMitoTracker染色の強度低下も、細胞毒性化合物の濃度増加と一致しました。細胞スプレッディングへの影響は、細胞面積の評価によって特徴付けることができます。異なるリードアウトに対するEC₅₀値は表1にまとめられています。
|
EC₅₀ (µM) ± Standard Deviation |
|||||
|---|---|---|---|---|---|
| 解析読み出し | Staurosporine | Mitomycin C | Paclitaxel | Etoposide | Doxorubicin |
| アクチン陽性細胞数 | 0.012 ± 0.001 | 0.178 ± 0.140 |
5.46 x 10-4± 3.48 x 10-5 |
0.820 ± 0.340 | 0.020 ± 0.012 |
| アクチン陽性細胞総面積 | 0.067 ± 0.009 | 4.952 ± 0.354 |
8.56 x 10-4± 5.69 x 10-5 |
13.54 ± 1.229 | 0.649 ± 0.054 |
| アクチン陽性細胞総強度 |
0.008 ± 7.45 x 10-4 |
0.164 ± 0.093 |
3.95 x 10-4± 2.82 x 10-5 |
0.603 ± 0.239 | 0.012 ± 0.007 |
| アクチン陽性細胞積算強度 | 0.038 ± 0.005 | 3.614 ± 0.378 |
6.33 x 10-4± 4.21 x 10-5 |
10.10 ± 1.301 | 0.501 ± 0.078 |
| ミトコンドリア陽性細胞数 | 0.013 ± 0.001 | 0.110 ± 0.045 |
4.50 x 10-4± 2.64 x 10⁻⁵ |
0.543 ± 0.190 | 0.014 ± 0.006 |
| ミトコンドリア陽性細胞積算強度 | 0.017 ± 0.002 | 1.691 ± 0.222 |
4.18 x 10-4± 2.98 x 10-5 |
6.336 ± 1.086 | 0.197 ± 0.053 |
| ミトコンドリア陽性細胞総強度 |
0.009 ± 9.81 x 10-4 |
0.094 ± 0.039 |
3.35 x 10-4± 3.00 x 10-5 |
0.451 ± 0.147 | 0.013 ± 0.005 |
表1. 解析リードアウトのEC₅₀値 Cell Scoringモジュールは、複数のフェノタイプ変化に対する化合物の影響を記述する複数のリードアウトを解析します。EC₅₀値は図2の4パラメータロジスティック曲線プロットに対応します。
結論
自動細胞イメージングは、化合物の毒性、細胞生存率、形態への影響を評価するための効率的なツールです。さまざまな細胞応答を調べる能力は、作用機序に関する重要な情報を提供します。ImageXpress Pico 自動細胞イメージングシステムとCellReporterXpressソフトウェアは、複数の測定を解析し、複雑なフェノタイプ効果をより適切に特徴付けるための複数のリードアウトを可能にします。
PDF版(英語)