Application Note 細胞増殖および細胞周期をリアルタイムでモニタリング
- 環境制御およびタイムラプスイメージングを用いてライブセル実験を実施
- 細胞分裂および化合物の効果をリアルタイムでモニタリング
- タイムラプスデータをMP4形式で簡単にエクスポートし、動画として保存可能
PDF版(英語)
はじめに
Oksana Sirenko, PhD|シニアリサーチサイエンティスト|モレキュラーデバイス
Felix Spira, PhD|アプリケーションサイエンティスト|モレキュラーデバイス
András Málnási-Csizmadia, PhD|教授|エトヴェシュ・ロラーンド大学、ハンガリー
生物学的研究や創薬において、細胞ベースアッセイの多様性と複雑性を拡張するニーズが高まっています。ライブセルアッセイは、細胞応答をリアルタイムでモニタリングでき、化合物処理の影響や生物学的な複雑性に関する重要な知見を提供します。私たちは、ImageXpress® Pico 自動細胞イメージングシステムを用いたリアルタイム定量セルイメージングアッセイにより、抗がん化合物が細胞モデルに与える複雑な影響をモニタリングしました。
抗がん化合物の影響を評価するため、HeLa子宮頸がん細胞に対する時間依存的な細胞増殖および細胞周期への影響をモニタリングしました。環境制御(EC)チャンバーを使用して、所望のCO₂およびO₂濃度を供給しました。透過光によるタイムラプスイメージングを用いて、細胞数、コンフルエンシー、細胞面積を定量化し、蛍光マーカーを用いて化合物処理が細胞周期に与える影響を評価しました。
細胞ベースアッセイは、ImageXpress PicoシステムとCellReporterXpress® 画像取得・解析ソフトウェアを組み合わせて実施しました。このイメージングシステムは、透過光(明視野)に加えて5チャンネルの蛍光イメージングおよびカラーイメージングに対応しています。環境制御チャンバーと高精度ステージにより、長時間のタイムラプスイメージングが可能となり、細胞増殖、分化、化合物毒性、その他多様な細胞ベースアッセイの自動モニタリングを実現します。
方法
環境制御およびタイムラプスモニタリング
ImageXpress Picoシステムには、温度、CO₂およびO₂濃度、湿度の制御とモニタリングが可能な環境制御チャンバーが搭載されています。タイムラプスイメージングと組み合わせることで、低酸素条件を含むライブセル実験を効率的に実施できます。
細胞培養
HeLa細胞(ATCCより取得)を、384ウェルの黒色・透明底マイクロプレート(Corning, #3603)に1ウェルあたり3,000細胞の密度で播種し、環境制御チャンバー内で37°C、CO₂ 4%の条件下で24時間培養しました。化合物処理は図1〜図4に示す通り、24時間実施しました。mCherry-H2Bヒストンタンパク質およびTubulin-GFPを安定発現するHeLa細胞は、Dr. Málnási-Csizmadiaより提供され、通常のHeLa細胞と同様に培養および処理を行いました。
細胞イメージング
細胞の可視化および細胞増殖・細胞死のモニタリングのため、10X対物レンズを用いて透過光で1〜2時間ごとに24時間イメージングを行いました。画像解析は取得中に実施され、透過光セルカウント汎用解析プロトコールを使用しました。この解析により、細胞数、平均細胞面積、細胞が覆う総面積が測定されました。
結果
透過光セルカウントによる化合物の細胞生存率および増殖への影響評価
フェノタイプの変化は、タイムラプスイメージングによって時間経過に沿ってモニタリングされました。細胞は環境制御チャンバー内で24時間にわたり、透過光または蛍光マーカーを用いて観察されました。HeLa細胞は、96ウェルまたは384ウェルマイクロプレートに、それぞれ1ウェルあたり12,000または3,000細胞の密度で播種されました。透過光画像は、10X対物レンズを用いて、96ウェルでは1ウェルあたり4領域、384ウェルでは1領域を、1〜2時間ごとに24時間取得しました。
画像取得中に自動画像解析が実施されました。解析では、透過光画像から細胞を検出し、細胞数、個々の細胞面積、細胞が覆う面積を計測しました(図1)。死細胞はサイズや形状に基づいて識別され、セルヘルス解析から除外されました。グラフツールを用いて、細胞増殖の動態曲線を表示しました。図2では、96ウェルプレートの各ウェルにおける時間経過に伴う細胞数の増加が示されており、増殖の指標となっています。
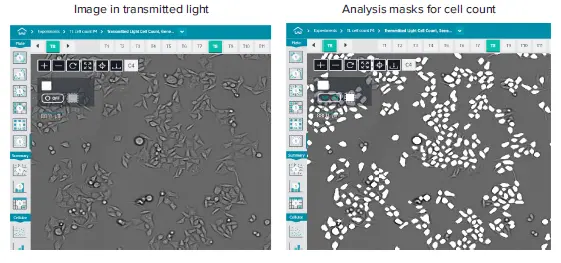
図1. HeLa細胞の透過光イメージング画像(10X対物レンズ使用)細胞カウント解析マスクは白色オーバーレイとして表示されています(画像の20%を表示)。重要な点として、解析プロトコールはイメージング中に最適化する必要があり、取得後に変更・調整することはできません。露光時間は通常1〜6 msの範囲で、フォーカスオフセットは通常-8です。

図2. 細胞増殖および化合物の影響を24時間にわたりリアルタイムでモニタリング 細胞は96ウェルまたは384ウェルフォーマットに播種され、環境制御チャンバーに設置されました。透過光イメージングは10X対物レンズを用いて1〜2時間ごとに取得され、96ウェルでは1ウェルあたり4領域、384ウェルでは1領域でイメージングしました。イメージング中に自動画像解析が実施されました。IX-Pico ECカセットを使用することで、エッジ効果が生じない点にも注目してください。
抗がん化合物の影響を評価するため、透過光イメージングと解析を用いてタイムコースを取得しました。ライブセルにおける細胞増殖への化合物の影響は、2時間ごとに画像を取得し、24時間にわたってモニタリングしました。スタウロスポリンおよびマイトマイシンCによる用量依存的な細胞増殖の抑制が観察されました(図3)。化合物の影響を定量化するため、SoftMaxPro®ソフトウェアの4パラメータカーブフィットアルゴリズムを用いて、細胞増殖抑制(細胞数の減少)に対するEC₅₀値を算出しました(図3B)。
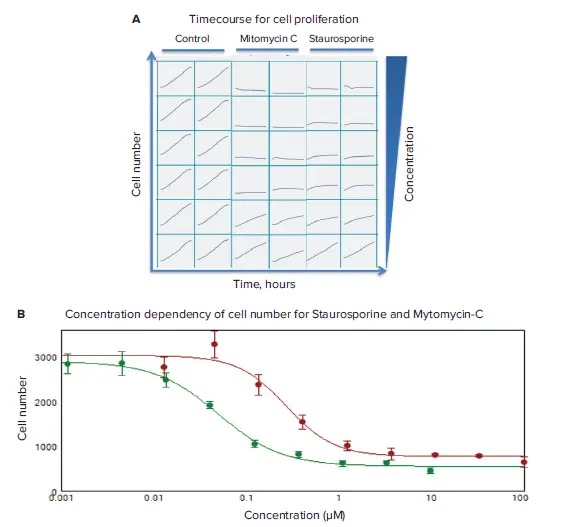
図3. 細胞増殖のタイムコースおよび濃度依存性 (A) コントロールウェルおよび化合物濃度を段階的に増加させた処理ウェル(2反復)における細胞数のタイムコースデータを表示。(B) 24時間時点での濃度依存性を示すグラフ。マイトマイシンC(赤):IC₅₀ = 0.27 µM、スタウロスポリン(緑):IC₅₀ = 0.05 µM。
蛍光マーカーを用いたリアルタイムでの有糸分裂細胞の識別
ヒストンタンパク質 mCherry-H2BおよびTubulin-GFPを安定発現するHeLa細胞において、細胞分裂をモニタリングしました。蛍光標識されたヒストンおよび細胞骨格タンパク質チューブリンを用いることで、個々の細胞が細胞周期を進行する様子を追跡することが可能です。図4では、5つの細胞がそれぞれ12時間以内に分裂する様子を示しています。細胞間ブリッジや形成中の紡錘体極も白色矢印で確認できます。有糸分裂中の細胞は、小さく明るい核を持つことで画像解析により識別可能です。細胞数および細胞の広がりは、核(H2B-mCherry)およびGFP(Tubulin)染色領域をカウントすることでモニタリングできます(図4B)。
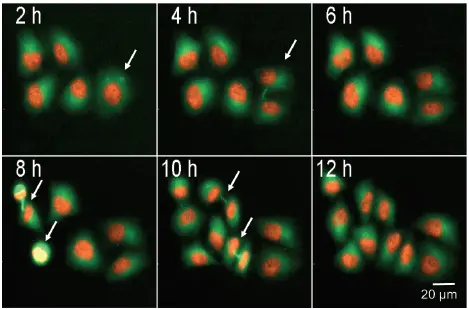
図4. ライブセルによる有糸分裂細胞の検出
mCherry-H2BおよびTubulin-GFPを安定発現するHeLa細胞が細胞分裂を行う様子を示す画像シリーズ。有糸分裂細胞は矢印で示されています。画像は10X対物レンズおよびFITC/TRITC照明を用いて、2時間ごとに25時間取得されました。有糸分裂細胞の割合(%)は、総細胞数に対する有糸分裂細胞数の比率から算出可能です。
結論
本研究の結果は、環境制御チャンバーおよびライブセルのタイムラプスイメージングが、細胞分裂および化合物の影響をリアルタイムでモニタリングするために有用であることを示しています。オンザフライでの画像解析により、実験中の細胞培養およびフェノタイプ変化を自動的にモニタリングできます。さらに、タイムラプスデータはMP4形式で簡単にエクスポートし、動画として保存することが可能です。
PDF版(英語)