Application Note SpectraMax PLUS マイクロプレートリーダーを用いたリンの微量測定:
マイクロプレート、キュベット、または試験管形式の測定方法の選択
PDF版(英語)
はじめに
無機リン(Pi)分析のためのほとんどの分光光度法は、リンモリブデン酸錯体の還元時に形成される色に基づいています。古典的な(そして現在も広く使用されている)方法は、亜硫酸塩とアミノナフトールスルホン酸を用いて還元を行うFiskeとSubbarowの方法です *1。長年にわたり、様々な還元剤と様々な濃度の反応物を用いた改良が行われてきました。Chen、Toribara、Warner *2 による、還元剤がアスコルビン酸である手順が、最も感度が高く、よく特性化された手順の一つです。
このアプリケーションノートでは、モレキュラーデバイスのSpectraMax PLUS マイクロプレートリーダーを用いた無機リンの2つの測定法について詳しくご説明します。最初の方法は、Sigma Diagnostics社から入手した市販のキットを使用するもので、オリジナルのFiske-Subbarow化学に基づいており、既製試薬の利便性をご提供します。2番目の方法は約10倍の感度があり、0.1~5.0 µg Pi/mL の試料に有効です。どちらのメソッドを使用する場合でも、SpectraMax PLUS マイクロプレートリーダーは、マイクロプレート、標準的な 1 cm キュベット、または 12 x 75 mm 試験管での吸光度測定が可能です。
Sigma Kit材料
- SpectraMax PLUS マイクロプレートリーダー
- 試験管(12 x 75 mm、ガラス製)、1 cmキュベット、または透明マイクロプレート(ポリスチレンなど)。
- サンプルの脱蛋白が必要な場合は、トリクロロ酢酸(20% w/v)。
- ピペッターとチップ
- 無機リンキット(Sigma Chemical Co.)
Sigma Kitの方法
機器とソフトウェアのセットアップ
ステップ 1 SoftMax® Proを使用して、キュベットセット(試験管/キュベットを使用する場合)またはプレートセクション(マイクロプレートを使用する場合)のいずれかを開きます。必要に応じて、ExperimentメニューからNew CuvetteまたはNew Plateを選択して、新しいキュベットセットまたはプレートセクションを作成します。
ステップ 2 図 1 に示すように、キュベット(上段)またはプレート(下段)用の装置設定ダイアログボックスを設定します。820 nmでの終点読み取りを選択します。PATHLENGTH CORRECTION は選択しないでください(PathCheck チェックボックスはオフのまま)。ホスホモリブデン酸塩の吸収帯は近赤外域まで広がっており、光路長計算に必要な測定の妨げになります。
注:Sigmaのキット添付文書では660+40 nmを推奨している。しかし、還元型リンモリブデン酸錯体のブロードな吸光度バンドは、実際には820 nm付近で最大となり、後者の波長の方が約25%感度が高くなります。
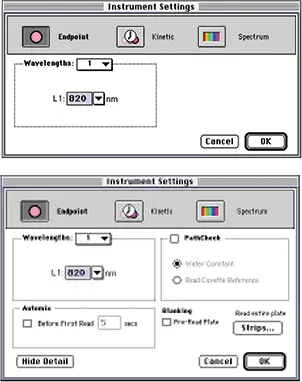
図 1:キュベット(上)またはプレート(下)用に設定された装置設定ダイアログボックス
ステップ 3 標準品と未知検体をキュベットセットまたはプレートセクションのどこに配置するかを示すテンプレートを作成します。
ステップ 4 キュベットセット(Cuvette Set)またはプレートセクション(Plate Section)ツールバーのリダク ション(Reduction)ボタンをクリックして、リダクション(Reduction)ダイアログボックスを表示します。図 2 に示すように、波長の組み合わせを L1、データモードを吸光度に設定します。

図2:縮小ダイアログボックス
試薬とサンプルの準備
ステップ1 Fiske & Subbarowのレデューサー1.0gを脱イオン水6.3mLに溶かします。レデューサー溶液は、密栓した琥珀色の瓶に入れ、室温で1ヶ月間保存できます。酸モリブデン酸試薬は、すぐに使用できる濃度でキットに含まれています。
ステップ 2 標準品は添付文書に従って希釈して調製しますが、各希釈液は 2.5 mL(5.0 mL ではありません)のみ調製し、希釈液を入れるために 12 x 75 mm のガラス管を使用します。シグマ社製キットに付属の無機標準品にはリン酸カリウムが含まれており、20 µg Pi/mL に相当します。このキットは血清検体で使用することを意図しているため、検体の 1~10 倍希釈が考慮され、標準曲線は原検体の mg/dL 単位で表示されます。
ステップ 3 添付文書で推奨されている方法で検体を調製します(尿検体を水で希釈します、血清検体をトリクロロ酢酸沈殿して蛋白質を除去するなど)。希釈した検体は 1~25 µg Pi/mL を含むはずです。それぞれ 2.5 mL を 12 x 75 mm のガラス管に分注します。
ステップ 4 0.5 mL の酸性モリブデン酸溶液と 0.125 mL の Fiske & Subbarow 溶液を各試料と標準液に加えます。ボルテックスミキサーで短時間混合します。マイクロプレート法を使用する場合は、各反応混合物 250 µL をマイクロプレートのあらかじめ指定されたウェルに正確に移します。
ステップ 5 室温で 10 分間インキュベートします。試験管を使用する場合は、SpectraMax PLUS マイクロプレートリーダーのキュベットポートで各試験管の吸光度を読み取ります。リファレンスの読み取りには「0」標準液を使用します。必要であれば、読み取る前にサンプルをキュベットに移すことができます。マイクロプレートを使用する場合は、SpectraMax PLUS のドロワーにプレートを入れてから読み取ってください。
Sigma Kitの結果
図 3 は、同じ溶液を 12 x 75 ガラス管とマイクロプレートで読み取った標準 曲線の比較です。どちらの曲線も希釈前の検体濃度に基づき、1mg/dLから25mg/dLまで優れた直線性を示します。(試薬添加前の希釈標準液の実際の濃度範囲は1~25 µg/mLです)。マイクロプレート標準曲線はチューブ曲線より約30%低く、これはウェル内の250 µL検体を通過する経路長が短いことを反映しています。
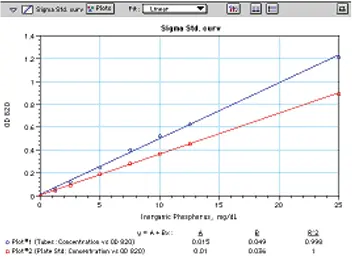
図 3: Sigma 社のキットを用いて作成したリンの標準曲線を、12 x 75 本の試験管(プロット#1)およびマイクロプレート(プロット#2)で読み取りました。
Chenなどの材料
- SpectraMax PLUS マイクロプレートリーダー
- 試験管(12 x 75 mm)
- 蓋付き透明マイクロプレート(ポリスチレンなど)
- 1cmキュベット(必要な場合)
- サンプル(各 200~300 mL、0.1~5.0 µg Pi/mL 含有)
- ピペッターとチップ
- 37℃インキュベーター(試験管/キュベット法用)
- 硫酸(試薬グレード)
- モリブデン酸アンモニウム、ACS試薬グレード
- アスコルビン酸、ACS試薬グレード
Chenなどの方法
機器とソフトウェアのセットアップ
ステップ1 SoftMax Proを使用して、キュベットセット(試験管/キュベット法)またはプレートセクション(マイクロプレート法)を選択します。必要に応じて、ExperimentメニューからNew CuvetteまたはNew Plateを選択して、新しいキュベットセットまたはプレートセクションを作成します。
ステップ 2 図 4 に示すように、キュベット(上段)またはプレート(下段)用の装置設定ダイアログボックスを設定します。820 nmでの終点読み取りを選択します。PATHLENGTH CORRECTION は選択しないでください(PathCheck チェックボックスはオフのまま)。ホスホモリブデン酸塩の吸収帯は近赤外まで広がっており、光路長計算に必要な測定を妨害します。ポリスチレンの 820 nm における吸光度はごくわずかであるため、マイクロプレートを事前に読み取る必要はありません。
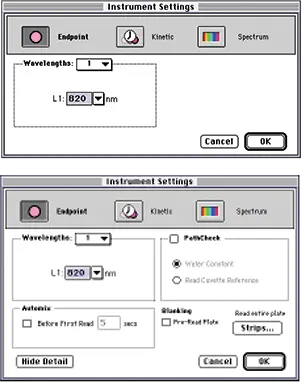
図 4:キュベット(上)またはプレート(下)用に設定された装置設定ダイアログボックス
ステップ 3 標準品と未知検体をキュベットセットまたはプレートセクションのどこに配置するかを示すテ ンプレートを作成します。
ステップ 4 キュベットセット(Cuvette Set)またはプレートセクション(Plate Section)ツールバーのリダク ション(Reduction)ボタンをクリックして、リダクション(Reduction)ダイアログボックスを表示します。図 5 に示すように、波長の組み合わせを L1、データモードを吸光度に設定します。
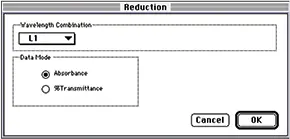
図5:縮小ダイアログボックス
ステップ5 マイクロプレート法を使用する場合、インキュベーションステップをマイクロプレートリーダーで行うか、外部インキュベーターで行うかを選択できます。プレートをプレートリーダーでインキュベートする場合は、インキュベーターを37℃に設定します(装置のフロントパネルまたはSoftMax Proのインキュベーター(温度計)ボタンを使用)。チューブ(または、装置でインキュベートしない場合はマイクロプレート)を使用する場合は、37 ℃インキュベーターが使用可能であることを確認してください。
試薬とサンプルの準備
ステップ1 以下のストック溶液を用意:
6 N硫酸(16.7 mLの濃硫酸を100 mLに希釈)
2.5%モリブデン酸アンモニウム(室温で保存)
10%アスコルビン酸(0~5℃で7週間保存可能)
ステップ 2 5.0 µg Pi/mL (0.161 mM)に相当する標準物質を調製する。22.2 mg のリン酸ナトリウム(無水一塩基)(MW 120)を正確に量り、100 mL の全量フラスコに入れる。0.05N塩酸で定容。
Dilute 10 mL of the stock standard to 100 mL with 0.05 N HCl (final concentration: 5.0 µg Pi/mL.
ストック標準液 10 mL を 0.05 N 塩酸で 100 mL に希釈する(最終濃度: 5.0 µg Pi/mL.)
ステップ3 試料は水性で、タンパク質を含まず、0.1~5 µg Pi/mLを含みます。酸処理(脱タンパクまたは灰化)されている場合は、酸濃度が1N以下になるように希釈または中和(参考文献2参照)
ステップ 4 標準物質を脱イオン水で 1~2 倍に連続希釈して標準曲線を作成し、以下の濃度の Pi を得ます: 5.0、2.5、1.25、0.625、0.3125、0.156、0.078 µg/mL。0 "標準液には脱イオン水を使用。
ステップ 5 6N硫酸1容量、10%モリブデン酸アンモニウム1容量、10%アスコルビン酸1容量、脱イオン水2容量を混合し、作業試薬を調製します。作業試薬は24時間以上保存しないことです。
ステップ6 試験管/キュベット法: 各試料と標準物質の 1.0 mL の分注を 12 x 75 mm 試験管にピペットで注入。0 "標準液には脱イオン水を使用する。1.0 mL の試薬を加え、短時間ボルテックスして混合。各試験管をパラフィルムなどで覆い、37℃のインキュベーターで少なくとも1時間静置。
マイクロプレート法: 各試料、標準品、ブランクの 150 µL ずつをマイクロプレートの所定のウェルに分注。各ウェルに150 µLの試薬を加えます。マイクロプレートに蓋をし、プレートをリーダーの引き出しに入れ、約5秒間混和。プレートを37℃で約1時間インキュベートします。
ステップ 7 インキュベーション後、SpectraMax PLUSのキュベットポートで各チューブを 820 nm で読み取ります。リファレンスの読み取りには、「0」標準液を使用します。または、各標準物質とサンプルを清潔なガラス製または石英製のキュベットに移し、820 nmを読み取ります。マイクロプレートを使用する場合は、SpectraMax PLUSで読み取ってください。
Chenなどの結果
発色は徐々に進み、約90分で最大となります(図6)。反応はそれぞれ30分、45分、60分で約85%、91%、96%完了します。プレートは早ければ30分で読み取れますが、最大感度が得られるのは元の手順で指定されているように90分培養後です。

図6:Chenなどの方法に従って作成し、15~90分インキュベート後にマイクロプレートで読み取ったリン標準曲線の発色
図 7 は、マイクロプレートで調製して読み取った標準曲線と、チューブで読み取った標準曲線、または標準 1 cm キュベットに移した標準曲線を比較したものです。すべての曲線は 0.078 µg/mL から 5 µg/mL まで優れた直線性を示します。標準品は、12 x 75 チューブで読み取ると、キュベットで読み取るよりもわずかに吸光度が高く、チューブの直径が 1 cm より少し大きいことを示しています。マイクロプレート内で生成される標準曲線は、マイクロプレート内のサンプルを通過する経路長が短いことを反映して、低くなります。チューブ、キュベット、マイクロプレートのいずれで分析を行っても、最終的には同じ結果が得られます。
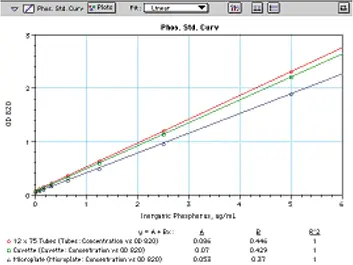
図7:Chenなどの方法を用いて試験管、キュベット、マイクロプレートで作成したリン標準曲線
概要
モレキュラーデバイスのSpectraMax PLUS マイクロプレートリーダーを用いた無機リンの測定手順について詳述します。最初の方法は市販のキットを利用するもので、血清や尿などかなり高濃度の無機リンを含むサンプルに適しています。2番目の方法は、より感度が高く、0.1 µg Pi/mL程度の無機リンを含むサンプルに有効です。どちらの方法でも、モレキュラーデバイスのSpectraMax PLUS マイクロプレートリーダーは、マイクロプレート形式、標準的な1 cmキュベット、または12 x 75 mm試験管での吸光度測定が可能です。
参考文献
- Fiske, C.H. And Y. Subbarow. The colorimetric determination of phosphorus. J. Biol. Chem. 66:375 (1925).
- Chen, P.S., T.Y. Toribara and H. Warner. Microdetermination of Phosphorus. Analytical Chemistry, 28:1756-8 (1956)
PDF版(英語)