Application Note ImageXpress Micro ハイコンテントイメージングシステム
を用いたミトコンドリアの形態と分布の測定
PDF版(英語)
はじめに
ミトコンドリアの応答評価は、化合物がセルヘルスに与える特定の影響を判断するためによく使用されます。これらの応答には、MitoTracker™ 染料などの蛍光指示薬の強度で示されるように、ミトコンドリアが安定した膜電位を維持する能力が含まれます。その他の測定可能な応答には、細胞内でのオルガネラの形態や分布の変化があります。
ハイコンテントイメージングアッセイでは、マイクロプレートで培養・処理された細胞を洗浄ステップなしでライブイメージングでき、細胞を最も自然な状態でリアルタイムに観察できます。エンドポイントアッセイを希望する場合、一部の染料は固定後も残ります。高倍率、共焦点光学系、zプレーンの取得を組み合わせることで、3Dボリュームとして解析可能な3D画像を生成し、各細胞から得られる情報量を大幅に増加させます。
これらのアッセイは、ImageXpress® Micro Confocal ハイコンテントイメージングシステムと MetaXpress® ハイコンテント画像取得・解析ソフトウェアを用いた自動スクリーニング環境で実施できます。
材料
- MitoTracker Orange CMTMRos(Life Technologies)
- WI-38ヒト肺線維芽細胞(P12)
- ロテノン
- クロロキン
- 384ウェル黒色透明底マイクロプレート(BD Falcon)
- ヘキスト33342核染色
- ImageXpress Micro Confocalハイコンテントイメージングシステム
アッセイ方法
WI-38 細胞を 384 ウェル組織培養処理済みマイクロプレートに、1ウェルあたり 7,500 細胞、50 μL で播種しました。37°C、5% CO₂ インキュベーターで 30 分間付着させた後、ロテノンまたはクロロキンを 3 濃度で 30 分間処理しました。最後に、各ウェルに MitoTracker Orange + Hoechst の 6 倍濃度溶液 10 μL を添加し、最終濃度をミトコンドリア染料 100 nM、Hoechst 5 μM としました。90 分間インキュベート後、ImageXpress Micro Confocal システムで DAPI および TRITC フィルターセットを使用し、40X または 60X Plan Apo 対物レンズでイメージングしました(図1)。
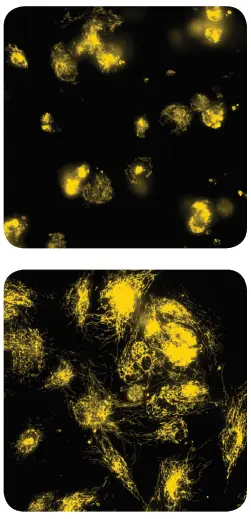
図1. 60X 対物レンズで取得した生データの 2D 投影画像
ロテノン(50 μM)処理細胞(上)とクロロキン処理細胞(下)のミトコンドリア
データ解析
ImageXpress Micro Confocal システムでイメージングした細胞は、MetaXpress ソフトウェアの 3D 解析モジュールで可視化・解析しました。段階的なユーザー入力により、モジュールは核を正確にセグメント化し、ミトコンドリア全体の測定値を出力するだけでなく、凝縮型または伸長型に分類し、個別のミトコンドリア形態に関する測定値を提供します。zシリーズからの 3D レンダリングにより、セグメンテーションマスクが生画像内のオブジェクトを正確に識別していることを確認でき、解析対象となる形態学的および空間的パラメータを強調します。

図2. 染色されたミトコンドリア(赤)と核(白)のアイソサーフェスオーバーレイの 3D レンダリング
(左)ロテノン(50 μM)処理細胞は凝縮と核への近接を示します。(右)クロロキン処理細胞は細胞全体に広がる伸長型ミトコンドリアを示します。
結果
このアッセイでは、クロロキン処理細胞はミトコンドリア体積が増加し、コントロール細胞で見られる凝縮型と伸長型の比率を維持していました。一方、ロテノン処理細胞はミトコンドリアの凝縮を示し、総体積の減少と、コントロールと比較した凝縮型ミトコンドリアの比率増加が確認されました。
ImageXpress Micro Confocal ハイコンテントイメージングシステムと、3D解析モジュールを備えた MetaXpress ハイコンテント画像取得・解析ソフトウェアの組み合わせにより、複数の細胞内ミトコンドリア応答を迅速かつ堅牢に画像ベースで定量化できます。
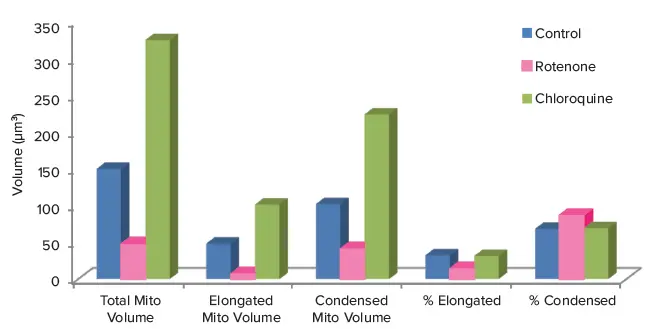
図3. 50 μM 化合物処理細胞と未処理コントロールを比較した測定パラメータ
これらのモレキュラーデバイス システムと互換性があります。

ImageXpressハイコンテントイメージングシステム
PDF版(英語)