Application Note SpectraMax Gemini XSマイクロプレートリーダーで
緑色蛍光タンパク質(GFP)を測定
PDF版(英語)
はじめに
Simon Lydford(モレキュラーデバイス)、Thomas Giller(Axovan Ltd.)
GFP(Green Fluorescent Protein:緑色蛍光タンパク質)は、クラゲ Aequorea victoria *1に由来する238アミノ酸からなる非常に安定したタンパク質で、可視光スペクトルの緑色領域で蛍光を発します。近年、GFPは分子生物学および細胞生物学において最も広く使用されているツールのひとつとなっています。これは、GFP遺伝子が非相同種でも発現可能であるためです。さらに、GFPは追加の基質を必要とせずに強い蛍光を発することができるため、遺伝子発現のマーカー、細胞系譜のトレーサー、あるいは生体内で共有結合的に標識する蛍光ラベルとして、より侵襲的で扱いにくい従来の蛍光染色技術の代替として有用です。GFPは非侵襲的にモニタリング可能で、生細胞内で定量的マーカーとして使用することもできます。また、GFPをタグとして用いることで、細胞内におけるタンパク質-GFPキメラの局在や動態をリアルタイムで解析することも可能です *2。
しかし、GFPの使用にはいくつかの技術的課題も存在します。主な懸念点のひとつは、タンパク質の励起および発光スペクトルです。野生型GFPには2つの励起ピークがあり、主ピークは395 nm(長波長紫外領域)、副ピークは475 nm(青色)で、発光ピークは509 nm(緑色)です。野生型GFPでは、395 nmで励起すると蛍光が急速に消失することが知られています。最近では、スペクトル特性が改良されたGFP遺伝子の変異体が開発されており、主励起ピークが490 nmに赤方偏移し、発光ピークは509 nmのまま維持されています。さらに重要な点として、これらの改変により蛍光強度が一般的に向上しています *3。
GFPシグナルは弱く、特に低レベルで発現している場合には検出が困難なことがあります。そのため、蛍光細胞の観察には通常、レーザー走査型共焦点顕微鏡などの装置が使用されます。シグナルが弱いと、スループット向上が可能なマイクロプレート型の蛍光測定装置での使用が制限されてしまいます。SpectraMax Gemini XSマイクロプレートリーダーは、デュアルモノクロメーター方式を採用したマイクロプレート蛍光測定システムであり、高感度な光学系を搭載しているため、低レベルの検出限界での実験が可能です *4。本アプリケーションノートでは、SpectraMax Gemini XSマイクロプレートリーダーを用いて、96ウェルマイクロプレート内でGFPを発現する細胞を比較的少数でも検出可能とする実験プロトコールについてご紹介します。
材料と方法
ヒト胎児腎由来細胞株 HEK-293 は、野生型GFP発現プラスミド(pS65T、Clontech社、販売終了製品;GFPの発現はサイトメガロウイルス即時早期プロモーターによって制御)を用いて一過性にトランスフェクションされました。トランスフェクションには、Gibco/Invitrogen社のLipofectamine(Cat. No. 18324-012)を製造元のプロトコールに従って使用しました。細胞は標準的な細胞培養条件下で162 cm²フラスコ内にてコンフルエントになるまで培養されました。蛍光顕微鏡による観察の結果、GFPの発現率は75%以上であることが確認されました。
GFPを発現した細胞はトリプシン処理により回収され、培地(MEM Alpha、Gibco-RBL社、Cat. No. 22571-020)で洗浄されました。適切な数の細胞を96ウェルマイクロプレート(Costar社、黒色壁・透明底、Cat. No. 3603)の偶数列に播種し、モックトランスフェクション細胞で希釈することで、各ウェルあたりの細胞数を20万個に一定化しました。これにより、各ウェルにおけるGFP発現細胞数は、列12では6,250個、列2では20万個となり、最終的な容量は100 µLとなりました。GFP発現細胞は列2、4、6、8、10、12に播種され、対照として列1、3、5、7、9、11にはモックトランスフェクション細胞を各ウェルに20万個播種しました。その後、プレートはインキュベーターに戻され、48時間培養されました
最初に、励起波長および蛍光波長/カットオフフィルターの組み合わせを最適化するために、励起および発光スキャンを実施し、最大のシグナル/バックグラウンド比が得られる条件を選定しました *5。以降のすべての実験では以下のパラメーターを使用しました:GFP;励起波長(λEX)– 472 nm、蛍光波長(λEM)– 512 nm、495 nmの発光カットオフフィルター。
結果
蛍光強度と細胞数の間には線形の関係が認められました(図1)。最も高い細胞濃度において、最大蛍光強度は177 ± 3 RFUで観測されました(表1)。SpectraMax Gemini XSマイクロプレートリーダーは、すべての細胞数において特異的なGFPシグナルを検出することができました。これは一元配置分散分析(One Way ANOVA)によって確認されました(表1)。この解析により、48時間のインキュベーション後、初期播種密度が1ウェルあたり6,250個のGFP発現細胞であっても、GFPトランスフェクション細胞とモックトランスフェクション細胞の間に有意な差(P < 0.01)があることが示されました(表1)。実際には約75%の細胞がGFPを発現しているため、これは検出限界が約4,690個のGFP発現細胞/ウェルに相当します。
| ウェルあたりのGFP発現細胞の初期数 | ||||||
|---|---|---|---|---|---|---|
| 200,000 | 100,000 | 50,000 | 25,000 | 12,500 | 6,250 | |
| GFP発現細胞からのシグナル 発現細胞からのシグナル (RFU) |
177 ± 9 | 106 ± 10 | 71 ± 5 | 51 ± 3 | 44 ± 2 | 39 ± 4 |
| 200,000 | 200,000 | 200,000 | 200,000 | 200,000 | 200,000 | |
| シグナル 模擬トランスフェクトからのシグナル 細胞からのシグナル(RFU) |
30 ± 1 | 29 ± 2 | 31 ± 1 | 32 ± 2 | 34 ± 2 | 32 ± 2 |
| ANOVA P値 | < 0.01 | < 0.01 | < 0.01 | < 0.01 | < 0.01 | < 0.01 |
表1:トランスフェクション細胞内におけるGFP検出の特異性と感度。本データは、GFP発現細胞およびモックトランスフェクション細胞から検出された相対蛍光強度(RFU)を示しています。データは平均RFU ± 標準偏差として記載されており、n=8です。
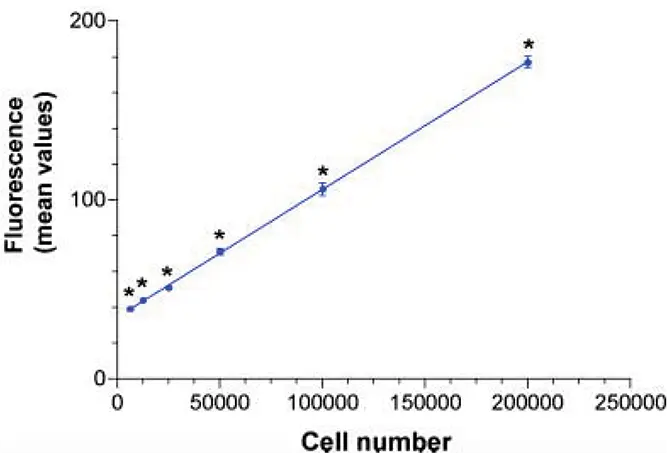
図1:トランスフェクション細胞内におけるGFP検出の線形性と感度。細胞は「材料と方法」で記載された通りに段階希釈されました。アスタリスク(*)は、モックトランスフェクション細胞とGFP発現細胞(●)との間に有意差があることを示しています。データは平均RFU ± 標準偏差として示されており、n=8です。
GFP発現細胞の懸濁液と1 µMフルオレセイン溶液の検出性能を比較するために、2種類のマイクロプレートを用いた一連の実験が設計されました(表2)。興味深いことに、フルオレセインのシグナルは、Greinerプレートでは11,190 RFUであったのに対し、ABgene Thermo-Fast® 96スカート付き黒色PCRプレート(Cat. No. AB-0800、注文時に黒色を指定)では32,787 RFUに増加しました。さらに重要な点として、GFP発現細胞から検出されたシグナルは、黒色ABgene PCRプレートを使用することで約3倍に増加しました(表2)。このように黒色PCRプレートでより高いシグナルが検出された理由として考えられるのは、PCRプレートの各ウェルの底部が高く、ウェルの直径が標準的なマイクロプレートよりも狭いためです。この構造により、サンプルが光学系により近づき、一定の容量であっても実質的に光路長が増加することが、シグナル増加の要因と考えられます。
| フルオレセイン(150 µl) | 細胞懸濁液(100 µl) | バッファー(100 µl) | |
|---|---|---|---|
| グライナー フロロスター | 11190 ± 36 | 17.1 ± 0.5 | 0.25 ± 0.03 |
| AB遺伝子サーモファスト | 32787 ± 179 | 46.4 ± 1.9 | 0.80 ± 0.07 |
| シグナルが1倍増加 | 2.9 | 2.7 | 3.2 |
表2:2種類のマイクロプレートで得られた蛍光シグナルの比較。GreinerプレートとABgeneプレートにおいて、フルオレセイン溶液およびGFP発現細胞懸濁液から得られたシグナルを比較しました。代表的なデータは平均RFU ± 標準偏差(S.D.)、n=8として示されています。
ディスカッション
GFPおよびその変異体は、生細胞内での遺伝子発現やタンパク質局在の蛍光検出において非常に便利なマーカーです。これは、色素や抗体などの二次試薬とのインキュベーションが不要であるためです。さらに、これらの蛍光タンパク質をコードするベクターは、簡便なトランスフェクションマーカーとしても広く使用されています。GFPの蛍光は安定しており、種に依存せず、基質や補因子を必要としません。ライフサイエンスや創薬研究におけるGFPの利用が急速に拡大する中で、アッセイのスループット向上への要求も高まっています。従来の検出技術であるフローサイトメトリー(FACS)や蛍光顕微鏡では、これらの要求に十分に応えることが困難になってきています。アッセイを96ウェルマイクロプレート技術に移行することで、スループットは大幅に向上します。
本報告では、SpectraMax Gemini XSマイクロプレートリーダーが、デュアルスキャンモノクロメーターと特許取得済みの高感度光学系を備えており、比較的少数のGFP発現細胞を検出可能であることを示しました。レンズの代わりに楕円ミラーを用いた独自の光学設計により、感度とデータの再現性が向上しています。初期播種密度が1ウェルあたり6,250個のGFP発現細胞であっても、Gemini XSはモックトランスフェクション細胞に対して1.2倍のシグナル増加を安定して検出することができました。さらに、SpectraMax Gemini XSは1回の実験で最大4種類の波長をモニタリングできるため、Clontech社のLiving Colors™蛍光タンパク質シリーズなどを用いた多色ラベリング実験にも対応可能です。
実用的な応用例としては、蛍光の減少を指標とした細胞アポトーシスやネクローシスの識別(アポトーシスによる蛍光低下)*6、細菌の生存率の測定 *7、細胞の生存性やゲノム安定性に関与する相同組換えDNA修復の測定 *8 などが挙げられます。
謝辞
本研究にあたり、スイス・バーゼルのPaul Bucher CompanyのGeorg Kienzle博士およびモレキュラーデバイスのAnne T. Ferguson博士に、貴重なご助言とご意見をいただきましたことに深く感謝申し上げます。
特許に関する注意事項
Aequorea victoria 由来の変異型緑色蛍光タンパク質(GFP)またはそのタンパク質をコードするDNA配列を含む製品の使用には、Aurora Biosciences Corporationからのライセンスが必要です。該当する米国特許には、特許番号 5,625,048、5,777,079、5,804,387 が含まれ、その他の米国および外国での特許出願も対象となります。営利目的の研究機関または団体が、商業目的または非商業目的で本製品を使用する場合には、Aurora Biosciences Corporationからライセンスを取得する必要があります。
- Morise, H., Shimomura, O., Johnson, F.H. & Winant, J. (1974). Intermolecular energy transfer in the bioluminescent system of Aequorea. Biochemistry, 13(12): 2656–2662.
- Milligan, G. (1999). Exploring the dynamics of regulation of G proteincoupled receptors using green fluorescent protein. Br. J. Pharmacol., 128: 501– 510.
- Cubitt, A.B., Heim, R., Adams, S.R., Boyd, A.E., Gross, L.A. & Tsien RY. (1995). Understanding, improving and using green fluorescent proteins. Trends Biochem. Sci., 20(11): 448–455.
- SPECTRAmax ® GEMINI XS product literature
- McGown, E.L. (1999). Selecting Excitation and Emission Wavelengths Using the SPECTRAmax ® GEMINI Microplate Spectrofluorometer — Basic Principles. MAXline Application Note 30.
- Strebel, A., Harr, T., Bachmann, F., Wernli, M. & Erb, P. (2001). Green fluorescent protein as a novel tool to measure apoptosis and necrosis. Cytometry, 43(2): 126–133.
- Dykes, G.A., Moorhead, S.M. & Roberts, S.L. (2001). Survival of Escherichia coli 157:H7 and Salmonella on chill-stored vacuum or carbon dioxide packaged primal beef cuts. Int. J. Food Microbiol., 64(3): 401–405.
- Slebos R.J. & Taylor, J.A. (2001). A novel host cell reactivation assay to assess homologous recombination capacity in human cancer cell lines. Biochem. Biophys. Res. Commun., 281(1): 212–219.
PDF版(英語)