Application Note 定量的発光アッセイで
ウイルス誘発性細胞変性効果を測定
- 試薬添加からわずか10分で結果が得られる簡単なミックス&リード方式です
- スクリーニングに適した安定性と高感度を備えた発光測定です
- SoftMax Proソフトウェアでデータ生成と結果解析を自動化できます
PDF版(英語)
はじめに
Joyce Itatani|アプリケーション・サイエンティスト|モレキュラーデバイス
Cathy Olsen, PhD|シニア・アプリケーション・サイエンティスト|モレキュラーデバイス
哺乳類細胞のウイルス感染は、しばしば細胞生存率を低下させ、細胞の形状やサイズの変化、隣接細胞との融合など、目に見える影響を引き起こします。これらの変化は**細胞変性効果(CPE)**と呼ばれ、光学顕微鏡やイメージングシステムで評価することができますが、より定量的な方法で測定することも可能です。
Promega社のViral ToxGloアッセイキットは、生細胞に存在するATPを測定し、発光検出による細胞生存率の定量化を容易にします。ウイルス誘発性CPEによるATPの減少は、発光シグナルの低下を引き起こし、宿主細胞におけるウイルス誘発性CPEの定量化を可能にします。シンプルなミックス&リードワークフローを使用することで、アッセイ結果はSpectraMax® iD5 マルチモードマイクロプレートリーダーで容易に検出され、SoftMax® Proソフトウェアで解析できます(図1)。
ここでは、Viral ToxGloアッセイを用いて、ウイルスに感染した哺乳類細胞におけるウイルス感染性および組織培養感染量(TCID₅₀)を測定する方法、さらに化合物の抗ウイルス効果を評価する方法を示します。本研究では、以前に報告された2つのウイルス感染モデルを使用しました:Madin-Darbyカニン腎臓(MDCK)細胞にインフルエンザA(H1N1)ウイルス¹を感染させ、MRC-5ヒト肺線維芽細胞にヒトコロナウイルス株229E(HCoV-229E) *2を感染させました。抗ウイルス効果が確認されている2つの化合物、リバビリン *3およびレムデシビル *4をウイルス曝露細胞に適用し、それぞれの抗ウイルス効果を測定しました。
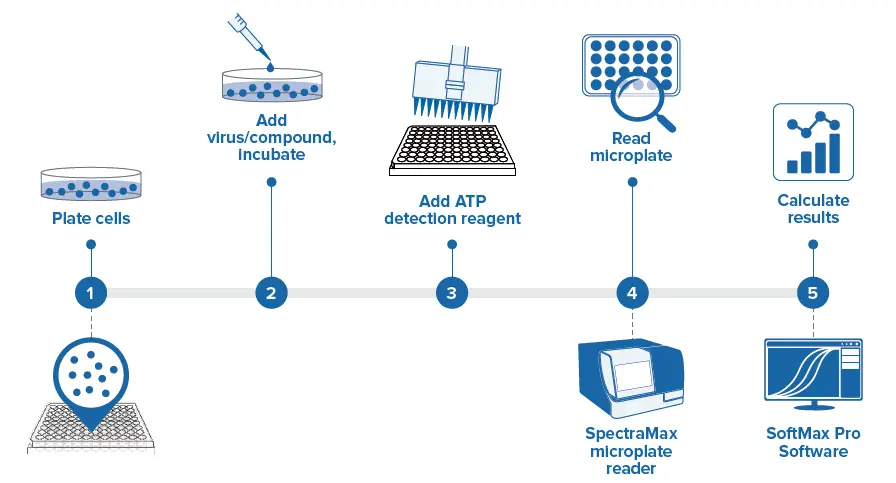
図1. Viral ToxGloアッセイのワークフロー。
材料
- Viral ToxGlo Assay Kit (プロメガ)
- MDCK(NBL-2)細胞株(ATCC)
- MRC-5細胞株(ATCC)
- 増殖培地(MDCKおよびMRC-5用): MEM(Corning)+10%ウシ胎児血清(FBS、Avantor® Seradigm)+ペニシリン/ストレプト
- マイシン(Thermo Fisher)
- インフルエンザAウイルス(H1N1)、(ATCC)
- ヒトコロナウイルス 229E (ATCC) 、蛍光偏光測定カートリッジ(モレキュラーデバイス cat. #0200-7009)
- リバビリン(Sigma)
- レムデシビル(MedChemExpress)
- 96ウェル白色組織培養処理クリアボトムマイクロプレート (Corning)
- Nunc白色シールテープ (ThermoFisher)
- SpectraMax iD5 マルチモードマイクロプレートリーダー(モレキュラーデバイス)
測定方法
TCID₅₀の測定
ウイルス感染性および組織培養感染量(TCID)は、ウイルスストックの段階希釈を調製し、これを標的細胞に一定時間曝露することで決定しました。曝露終了後、Viral ToxGloアッセイを用いてATPを測定し、細胞生存率の指標としました。TCID₅₀または50%細胞変性効果(CPE)は、測定された細胞生存率を50%低下させるウイルス希釈です。この値は、抗ウイルス剤の効果に関する後続の研究に使用しました。
細胞は、透明底付き96ウェル白色マイクロプレートに1ウェルあたり10,000細胞で播種しました。細胞は37°C、5% CO₂で一晩接着・増殖させました。ウイルスストックの初期希釈は、H1N1では1:1000、HCoV-229Eでは1:5で培養培地中に調製しました。段階希釈(半対数、3.16倍)は、カラム1のウェルに初期ウイルス希釈液46 μLを添加(初期容量100 μL/well)し、カラム1からカラム2へ46 μLを移し、カラム10まで繰り返しました。カラム10から46 μLを除去し、すべての実験ウェルの容量を100 μL/wellに維持しました。ウイルスなしおよび細胞なしのコントロールウェルを含めました。細胞は、MDCK/H1N1では3日間、MRC-5/HCoV-229Eでは6日間、37°C、5% CO₂でウイルスとインキュベートしました。
細胞変性効果はViral ToxGloキットを用いて決定しました。3日または6日のウイルス処理終了後、ATP検出試薬をアッセイウェルに添加し、細胞溶解のため室温で10分間インキュベートしました。発光シグナルを最大化するため、読み取り前に各透明底マイクロプレートの底にNunc白色シーリングテープを貼付しました。プレートはSpectraMax iD5プレートリーダーで、表1に示す設定を使用して読み取りました。
| Parameter | Setting |
|---|---|
| Read mode |
Luminescence |
| Read type | Endpoint |
| Wavelengths | All wavelengths |
| Plate type | 96 Well Costar |
| PMT and optics |
Integration time: 1000 ms Read height: 1.12 mm/p> |
| More settings | Show pre-read optimization options |
表1. Viral ToxGloアッセイにおけるSpectraMax iD5プレートリーダーの設定 設定はSoftMax Proソフトウェアのプレートセクションで指定します。読み取り高さは、「Show Pre-Read Optimization Options」チェックボックスをオンにし、読み取り開始後に表示される指示に従って最適化します。
結果はSoftMax Proソフトウェアで4パラメータカーブフィットを用いて、RLU対ウイルス希釈係数としてプロットし、各ウイルスのTCID₅₀値をそれぞれの細胞株で算出しました(図2)。H1N1ウイルスストックの999,000倍希釈はMDCKの生存率を50%低下させ、HCoV-229Eウイルスストックの43倍希釈でMRC-5細胞の生存率が同様に低下しました。
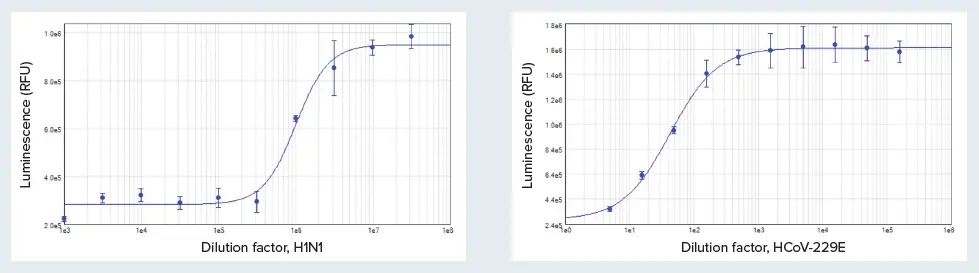
図2. MDCK細胞におけるH1N1ウイルス(A)およびMRC-5細胞におけるHCoV-229E(B)の濃度応答曲線。TCID₅₀は、H1N1では1:999,000、HCoV-229Eでは1:43の希釈で確認されました。
化合物の抗ウイルス効果の測定
ウイルス処理細胞における細胞変性効果を低減するリバビリンおよびレムデシビルの有効性を評価するため、MDCKまたはMRC-5細胞を透明底付き96ウェル白色マイクロプレートに、培地50 μLで1ウェルあたり10,000細胞播種しました。培養培地のみを含む細胞なしコントロールウェルも含めました。細胞は37°C、5% CO₂インキュベーターで一晩接着・増殖させました。
MDCK細胞には、リバビリンの1:3段階希釈(1000 μM~0.02 μM)25 μLを添加しました。MRC-5細胞には、レムデシビルの1:3段階希釈(17 μM~0.003 μM)25 μLを添加しました。TCID₅₀を超える最適な細胞変性効果を示すウイルス希釈液(H1N1では1:1000、HCoV-229Eでは1:5)を、それぞれMDCKまたはMRC-5細胞に1ウェルあたり25 μL添加しました。化合物のオフターゲット細胞毒性を確認するため、ウイルスを含まない細胞に対しても同じ化合物希釈系列を添加しました。処理した細胞プレートは、MDCKでは3日間、MRC-5では6日間、37°C、5% CO₂でインキュベートしました。
ウイルスおよび化合物とのインキュベーション後、Viral ToxGlo ATP検出試薬をアッセイウェルに添加し、細胞溶解のため室温で10分間インキュベートしました。発光シグナルを最大化するため、読み取り前に透明底マイクロプレートの底にNunc白色シーリングテープを貼付しました。プレートはSpectraMax iD5リーダーで読み取りました(設定は表1参照)。
結果はSoftMax Proソフトウェアで4パラメータカーブフィットを用いて、RLU対化合物濃度としてプロットし、各化合物のEC₅₀値を算出しました。リバビリンはH1N1ウイルスに曝露されたMDCK細胞の生存率を部分的に回復させ、EC₅₀は89 μMでした(図3A)。ただし、ウイルスを含まないリバビリン単独処理細胞では、100 μMを超える濃度で毒性が観察されました。HCoV-229Eに曝露されたMRC-5細胞のレムデシビル処理では、生存率がほぼ完全に回復し、EC₅₀値は215 nMでした(図3B)。レムデシビルのオフターゲット効果は最小限であり、16 μMを超える濃度でのみ確認されました。
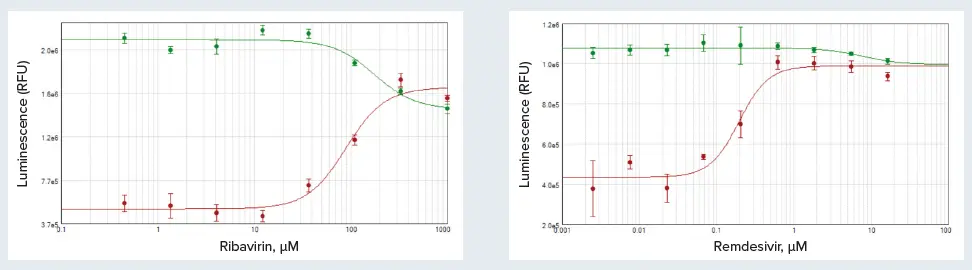
図3. リバビリンのMDCK細胞単独(緑)およびH1N1ウイルス処理(赤)に対する効果(A)、レムデシビルのMRC-5細胞単独(緑)およびHCoV-229Eウイルス処理(赤)に対する効果(B)。リバビリンEC₅₀=89 μM、レムデシビルEC₅₀=215 nM。
結論
ウイルス感染による細胞生存率への影響を顕微鏡で評価する従来の時間を要する方法とは異なり、Viral ToxGloアッセイはシンプルなミックス&リードフォーマットを提供します。処理細胞への試薬添加からわずか10分後に結果の検出と解析が可能です。SpectraMax iD5プレートリーダーはこのアッセイの高感度検出を提供し、SoftMax ProソフトウェアはTCID₅₀の容易な算出に加え、抗ウイルス化合物のオンターゲットおよびオフターゲット効果の評価を可能にします。
参考文献
- Niles, A et al. Determine Viral-Induced Cytopathic Effect Using a Luminescent Assay: https://www.promega.com/ resources/pubhub/determine-viral-induced-cytopathic-effectusing- a-luminescent-assay/
- Funk, CJ et al. Infection of human alveolar macrophages by human coronavirus strain 229E. J. Gen. Virol. (2012), 93, 494–503
- Khalili, JS et al. Novel coronavirus treatment with ribavirin: Groundwork for an evaluation concerning COVID-19. J. Med. Virol. 2020; 1–7.
- Parang, K et al. Comparative antiviral activity of remdesivir and anti-HIV nucleoside analogs against human coronavirus 229E (HCoV-229E). Molecules 2020, 25, 2343.
PDF版(英語)