Application Note FlexStation 3による
カルシウム放出活性化Ca²⁺(CRAC)チャネル活性測定
- 洗浄不要のアッセイフォーマットで時間を節約できます
- 特許取得済みのマスキング染料技術で、バックグラウンド蛍光を低減し、シグナルとバックグラウンドの比率を改善します
- FlexStationの二波長互換性により、絶対的なCa²⁺濃度の算出が容易になります
PDF版(英語)
はじめに
小胞体(ER)からのCa²⁺枯渇は、さまざまな細胞タイプにおいて細胞膜を介したCa²⁺流入を活性化します。このプロセスはストア作動性カルシウム流入(SOCE)と呼ばれ、細胞へのCa²⁺の調節された流入の最も一般的な様式です。最もよく特徴づけられているSOCE電流は、肥満細胞で最初に記載され、その後Jurkat細胞やRBL細胞などの他のタイプでも記録されているCa²⁺放出活性化Ca²⁺電流(I_CRAC)です。枯渇したストアがSOCEを活性化するメカニズムには、小胞体Ca²⁺センサーであるSTIM1の複雑な細胞内移動が関与しており、STIM1は細胞膜近傍のプンクタに再分布し、ORAI1、ORAI2、ORAI3サブユニットからなる細胞膜チャネルを活性化します。これらのサブユニットはCRACチャネルのポア形成サブユニットとして機能します。
CRACチャネルの重要性は、SOCEを消失させるORAI1およびSTIM1遺伝子の機能喪失や変異を有するヒト患者において明らかです。これらの患者はCRACチャネルオパチーと呼ばれる特異な疾患を呈し、重度の免疫不全、自己免疫、先天性筋低緊張、およびエクリン汗腺の機能喪失を特徴とします。CRAC機能の異常は、急性膵炎、異常な細胞増殖、乳がん転移にも関与しています。簡便で信頼性が高く、感度の高いCRACチャネルアッセイの開発は、これらのヒト疾患の治療を目的とした新規治療薬の検出に寄与する可能性があります。
本研究では、FlexStation® 3 マルチモードマイクロプレートリーダーを用いて、RBL細胞における内因性CRACチャネルアッセイで、最近導入されたFLIPR® Calcium 6アッセイキットを含むさまざまな蛍光カルシウム感受性染料を比較しました。FlexStation 3は、化合物プレートからアッセイプレートへの試薬のカスタムかつ直接的な移送を可能にする内部8または16チャンネルピペッターを備えた5モードリーダーです。最も信頼性が高く、一貫性があり、堅牢なアッセイを提供するために最適な染料の選択がいかに重要であるかを示します。このアッセイはハイスループット環境で使用できます。
材料と方法:細胞培養
細胞培養
RBL細胞はEuropean Collection of Authenticated Cell Cultures(ECACC)から取得し、EMEMに2 mMグルタミン、1 mMピルビン酸ナトリウム、1%非必須アミノ酸、10%ウシ胎児血清を加えて培養しました。細胞は37°C、5% CO₂に設定した加湿インキュベーターで維持しました。細胞プレートは、Corning CellBIND黒壁・透明底384ウェルマイクロプレート(品番#3683)に成長培地50 μLを用いて1ウェルあたり10,000細胞を分注し、37°C、5% CO₂の加湿インキュベーターで一晩接着させました。
染料の調製
カルシウムフリーローディングバッファ:40 mM NaCl、100 mM KCl、17 mM NaHCO₃、0.1 mM EGTA、12 mMグルコース、1 mM MgCl₂、5 mM HEPESバッファ、pH 7.4。
FLIPR Calcium 6 Assay Kit
冷凍庫からCalcium 6アッセイ試薬(コンポーネントA)を1バイアル取り出し、室温に平衡化します。コンポーネントAの内容物をカルシウムフリーローディングバッファ10 mLを加えて溶解します。ボルテックスで1~2分間混合し、完全に溶解させます。完全に溶解することは、実験間の再現性を確保するために重要です。再構成したコンポーネントA/バッファ10 mLをバッファ10 mLに加え、総量20 mLとします。
Fluo-4 NW Calcium Assay Kit
カルシウムフリーローディングバッファ10 mLをコンポーネントAのボトルに加えます。この1X染料ローディング溶液は1枚のマイクロプレートに十分です。染料が完全に溶解するように、1~2分間強く振るかボルテックスします。
Fura-2 QBT™ Calcium Kit
冷凍庫からCalcium 6アッセイ試薬(コンポーネントA)を1バイアル取り出し、室温に平衡化します。コンポーネントAの内容物をカルシウムフリーローディングバッファ10 mLを加えて溶解します。ボルテックスで1~2分間混合し、完全に溶解させます。完全に溶解することは、実験間の再現性を確保するために重要です。再構成したコンポーネントA/バッファ10 mLをバッファ10 mLに加え、総量20 mLとします。
染料のローディング
細胞プレートをインキュベーターから取り出し、成長培地を除去し、2.5 mMプロベネシドを含む1X染料ローディング溶液30 μLに置換しました。プレートは37°Cで2時間(Calcium 6)または1時間(Fura-2 QBTおよびFluo-4 NW)インキュベートし、その後室温で15分間静置しました。
アッセイ
化合物プレートは、タプシガルギンを含むカルシウムフリーバッファで100% DMSOストック(阻害剤の用量反応曲線およびコントロール)を希釈して調製しました。タプシガルギンの最終アッセイ濃度は1 μMでした。試験化合物またはコントロール(+タプシガルギン)を10 μL添加し、その後プレートを暗所で室温で15分間インキュベートしました。試験化合物は、チャネルの既知の阻害剤3種:YM-58483、La³⁺、および2-Aminoethoxydiphenylborinate(2-APB)でした。
Ca²⁺シグナルを誘導するために、FlexStation 3リーダー(SoftMax® Pro 7データ取得・解析ソフトウェアを搭載)を用いて、塩化カルシウム(CaCl₂、最終アッセイ濃度1 mM)10 μLを添加し、結果のシグナルを2分間測定しました。Calcium 6およびFluo-4 NWでは励起波長485 nm、蛍光波長525 nm、カットオフ515 nmを使用しました。Fura-2 QBTでは励起波長340/380 nm、蛍光波長510 nmで、カットオフは不要でした。
結果
初期実験では、後続の阻害試験に使用するCaCl₂のIC₈₀濃度を確認しました。選択されたCaCl₂濃度は1 mMでした(図1)。
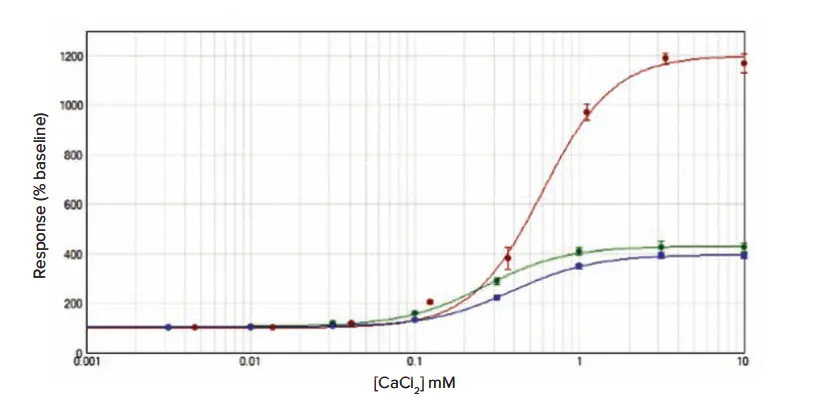
図1. RBL細胞におけるCaCl₂の濃度-効果曲線 Calcium 6でロードした細胞(赤ドット、EC₅₀ = 0.6 ± 0.03 mM)、Fluo-4 NW(緑ドット、EC₅₀ = 0.3 ± 0.02 mM)、またはFura-2 QBT(青ドット、EC₅₀ = 0.4 ± 0.01 mM)におけるCaCl₂の濃度-効果曲線です。データは平均値 ± 標準誤差(n = 12)で、ベースラインに対する%増加として正規化しています。
後続の阻害曲線試験のデータは図2、図3、図4に示し、平均IC₅₀推定値(± 標準誤差)は、平均アッセイZ’因子とともに表1に表示しています。
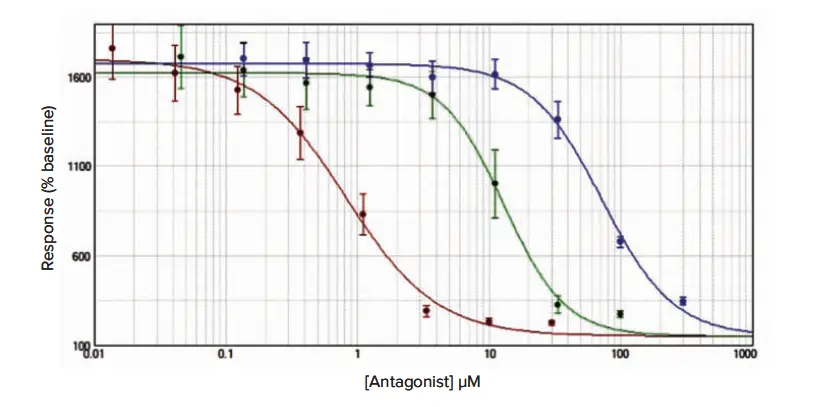
図2.(Calcium 6):接着性RBL細胞におけるCRACチャネル阻害アッセイ Calcium 6は方法セクションで示したプロトコールに従ってロードし、YM-58483(赤ドット)、2-APB(緑ドット)、La³⁺(青ドット)で得られた阻害曲線を示します。データは平均値 ± 標準誤差(n = 12)で、ベースラインに対する%増加として正規化しています。
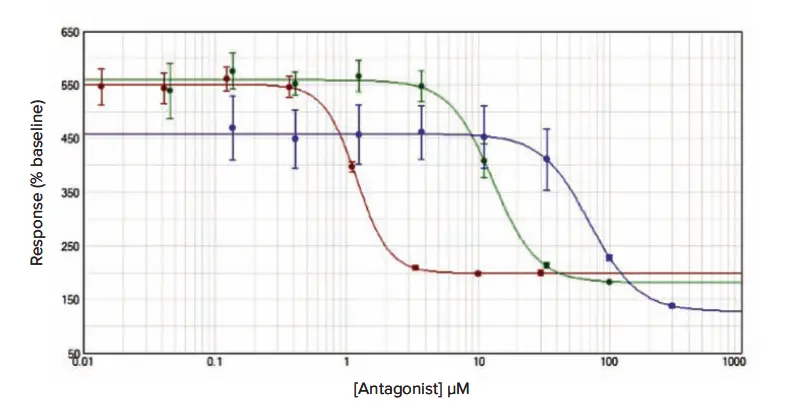
図3.(Fluo-4 NW):接着性RBL細胞におけるCRACチャネル阻害アッセイ Fluo-4 NWは方法セクションで示したプロトコールに従ってロードし、YM-58483(赤ドット)、2-APB(緑ドット)、La³⁺(青ドット)で得られた阻害曲線を示します。データは平均値 ± 標準誤差(n = 12)で、ベースラインに対する%増加として正規化しています。
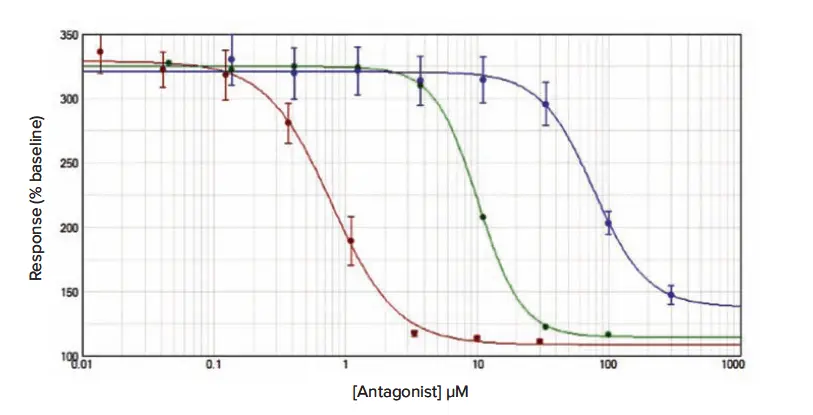
図4.(Fura-2 QBT):接着性RBL細胞におけるCRACチャネル阻害アッセイ Fura-2 QBTは方法セクションで示したプロトコールに従ってロードし、YM-58483(赤ドット)、2-APB(緑ドット)、La³⁺(青ドット)で得られた阻害曲線を示します。データは平均値 ± 標準誤差(n = 12)で、ベースラインに対する%増加として正規化しています。
| YM 58483 | 2-APB | La³⁺ | ||
|---|---|---|---|---|
| Calcium 6 |
IC₅₀ |
0.82 ± 0.09 | 12.93 ± 1.76 | 72.27 ± 3.90 |
| Calcium 6 | Z' factor | 0.60 | 0.53 | 0.46 |
| Fluo 4 NW | IC₅₀ | 1.19 ± 0.03 | 13.00 ± 1.04 | 70.33 ± 3.97 |
| Fluo 4 NW | Z' factor | 0.13 | 0.25 | 0.09 |
| Fura-2 QBT | IC₅₀ | 0.79 ± 0.06 | 11.17 ± 0.19 | 76.51 ± 5.91 |
| Fura-2 QBT | Z’ factor | 0.25 | 0.40 | 0.31 |
表1. RBL細胞において異なるカルシウム感受性染料でロードした場合のYM-58483、2-APBおよびLa³⁺による平均IC₅₀推定値 結果は平均値 ± 標準誤差(n ≥ 8)です。
結論
本研究では、FlexStation 3プレートリーダーを用いて、RBL細胞株におけるカルシウム放出活性化カルシウム(CRAC)チャネルアッセイで3種類の「非洗浄型」カルシウム指示薬を比較しました。Fura-2 QBTおよびCalcium 6アッセイキットは、特許取得済みのマスキング染料技術に基づき、バックグラウンド蛍光を低減し、シグナルとバックグラウンドの比率を改善するために設計された均一な蛍光ベースの製剤であり、GPCRおよびイオンチャネルターゲットのアッセイ開発とスクリーニングを迅速化します。Fluo-4 NW(非洗浄型)カルシウムアッセイキットは、細胞内カルシウムを検出する代替手段を提供しますが、マスキング染料は含まれていません。
CaCl₂の最適なEC₅₀濃度を決定する初期実験では、FLIPR Calcium 6アッセイキットが他の2つのアッセイキットよりも大きく、より堅牢な蛍光シグナルを示す利点が確認されました。CaCl₂のEC₅₀値は使用した染料間で一貫していました。
FlexStation 3プレートリーダーで生成された拮抗薬データを比較した場合も同様の傾向が見られました。薬理学的プロファイルは3つの処理群間で一貫していました(表1)。しかし、Z’因子の計算によって決定されるアッセイの堅牢性は大きく異なりました。Fluo-4 NWキットで生成されたデータは堅牢性が低く、アッセイの信頼性も低下しました。Fura-2 QBT Calcium Kitは独自のマスキング技術を採用し、比率型カルシウム指示薬である利点がありますが、最も高いシグナルと関連するZ’因子はFLIPR Calcium 6 Assay Kitで得られました。
PDF版(英語)