Application Note ライブセルの断続的タイムラプス解析による
細胞移動の定量評価
- 再現性の高い自動細胞移動実験の実施
- 主要なタイムポイントのみを取得することで時間と保存容量を節約
- プレート全体のタイムラプス応答を一括で可視化
- ハイコンテント解析により信頼性の高い統計結果を確保
PDF版(英語)
はじめに
Jayne Hesley|イメージングアプリケーションサイエンティスト|モレキュラーデバイス
細胞移動は、胚発生、創傷治癒、がんの転移、免疫応答など、多くの生物学的イベントに不可欠なプロセスです。多くの場合、免疫細胞はサイトカインシグナルやケモカイン勾配に応答して自然免疫系が活性化される際、炎症部位へと移動し、損傷組織の除去や再生を行います *1 *2。しかし、免疫細胞の移動と蓄積は、関節リウマチなどの自己免疫疾患の発症にもつながる可能性があります *3。さらに、がん患者の腫瘍微小環境における細胞運動性の亢進は、がんの進行を悪化させる要因となります *4。したがって、特定の疾患の病態を研究し、新たな治療法や創薬を開発するためには、細胞運動性の測定が極めて重要です。
細胞運動性は、細胞移動アッセイを用いて制御された環境下で測定されることが一般的です。このアッセイでは、手動で作成された“スクラッチ”を利用し、細胞が損傷領域へ移動する様子を観察します。しかし、スクラッチの手動作成は手間がかかり、時間も要するため、ハイスループットスクリーニング研究にはあまり適していません。
本ページでは、96ウェルまたは384ウェルマイクロプレートを用いて、細胞移動のイメージングとリアルタイム解析をスケールアップして実施する方法をご紹介します(図1)。この改良型細胞移動アッセイは、Platypus Technologiesによって開発されたもので、細胞の移動能力に影響を与える複数の化合物を、適切な反復数を確保した1つの制御された実験でスクリーニングすることを可能にします。細胞はまず、溶解可能で生体適合性のあるゲルを含むマイクロプレートに播種され、このゲルによって細胞の存在しない排除ゾーンが形成されます。播種から数時間後、ImageXpress™ Pico自動細胞イメージングシステムを用いて、細胞が排除ゾーンへ移動する様子を測定するためのイメージングが開始されます。CellReporterXpress™画像取得・解析ソフトウェアに搭載された断続的タイムラプス機能により、異なるタイムポイントで取得されたウェルの画像を1つのファイルに保存し、タイムラプス実験としてシームレスに解析・プロットすることが可能です。この手法を用いて、HT 1080(線維肉腫)細胞に対する抗がん剤Cytochalasin D、Colchicine、Nocodazole処理後の創傷治癒の違いを明確に示すことができました。
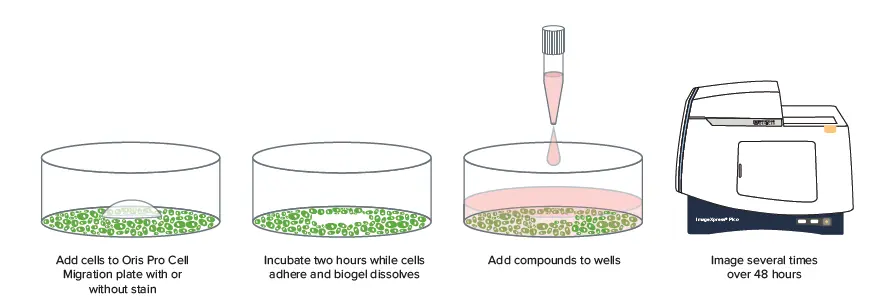
図1. ImageXpress Picoシステムを用いた細胞移動実験 化合物が細胞移動に与える影響を測定するため、プレートは2〜45時間の異なるタイムポイントで撮影されました。
材料
- HT 1080線維肉腫細胞株(ATCC)
- SiR-アクチンキット(Cytoskeleton)
- シトシンß-D-アラビノフラノシド塩酸塩(Ara C)(Sigma Aldrich)
- Oris ™ Pro セル遊走アッセイ(Platypus Technologies)
- ImageXpress Pico自動細胞イメージングシステム(モレキュラーデバイス)
- CellReporterXpress 画像取得・解析ソフトウェア(モレキュラーデバイス)
方法
HT 1080細胞は、最終濃度20 µMのCytosine ß-D-arabinofuranoside hydrochloride(Ara C)および0.1 µMのSiR-Actinで処理されました。Ara Cは細胞分裂を阻害することで、排除ゾーン内に存在する細胞が分裂ではなく細胞移動によるものであることを保証します。一方、SiR-Actinは生細胞のアクチンを染色する無害な蛍光色素です。処理後、細胞は384ウェルのOris Pro Cell Migrationプレートに、1ウェルあたり1万個、最終容量30 µLで播種され、インキュベーターに戻されました。
細胞が接着し、ゲルが2時間で溶解した後、各ウェルに既に存在する30 µLの細胞懸濁液に対して、30 µLの抗がん剤を添加しました。ImageXpress Picoシステムを用いて、ライブセルの断続的タイムラプスシリーズによるイメージングを実施し、45時間の期間中に8つのタイムポイントでプレートを撮影しました。この方法により、マルチユーザー環境でも他の研究者の実験を妨げることなく、ライブセルプレートのイメージングが可能となります。
この機能により、タイムラプス解析をシームレスに行うために画像が1つの実験に統合され、細胞が排除領域へ完全に移動するまでに数日かかる可能性があるため、不要なデータの生成が抑制されます(図2)。4倍の倍率で、透過光(露光時間 < 5 ms)およびCy5蛍光(露光時間 500~1000 ms)の両方を用いて、ウェル全体の単一画像が取得されました。数値結果は、透過光解析(Transmitted Light, Large Cell)および蛍光解析(Cell Scoring – Cy5核および細胞質)に最適化されたプロトコールを使用して、画像取得と同時に生成されました(図3)。
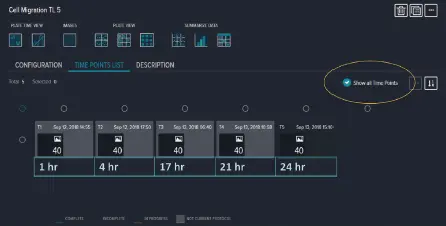
図2. 各画像取得時点の間隔を変えて実施された、不連続タイムラプス実験の例
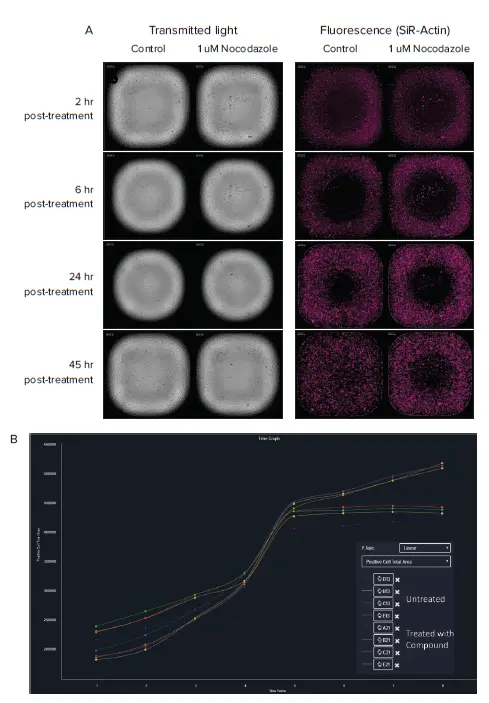
図3. A. HT 1080コントロール細胞(左)と、1 μMノコダゾール処理細胞(右)の透過光および蛍光(SiR-Actin)画像の例。4つの代表的なタイムポイントで比較しています ノコダゾール処理により、排除領域への細胞移動が遅延しました。 B. CellReporterXpressソフトウェアによる、排除領域へ移動する細胞の可視化 未処理のコントロール細胞は、化合物処理細胞と比較して速く移動しました。
コルヒチン、シトカルラシンD、ノコダゾールによる細胞処理は、予想どおりコントロール細胞と比較して細胞移動を有意に抑制しました(図4)。中でも、シトカルラシンDが最も強く細胞移動を阻害しました。細胞をSiR-Actinで染色して取得した蛍光画像でも、細胞移動の減少が確認されました(図5)。この結果は、SiR-Actin色素を保持する細胞株においては、蛍光標識の有無にかかわらず細胞移動アッセイを実施できる可能性を示しています。
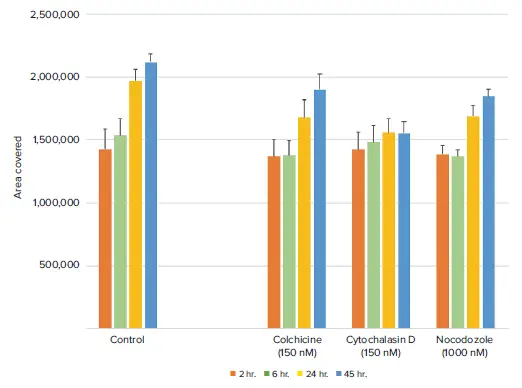
図4. 時間経過に伴う透過光解析により、化合物処理されたウェルでは細胞移動が減少していることが示されました シトカルラシンDは、移動抑制効果が最も長く持続しました。
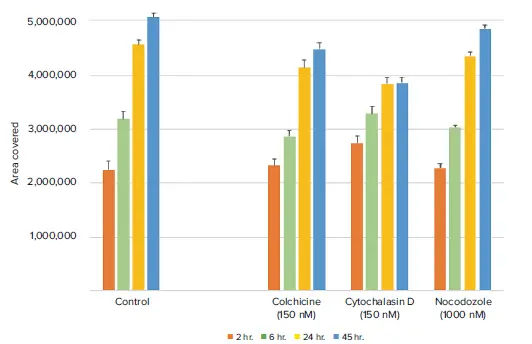
図5. 蛍光標識された細胞の時間経過に伴う解析により、化合物処理されたウェルでは細胞移動が減少していることが示されました 得られたデータは、透過光を用いた解析結果と一致しています。
結論
ImageXpress PicoシステムとCellReporterXpressソフトウェアを使用して、HT 1080細胞を384ウェルのOris Proマイクロプレートに播種し、45時間にわたって細胞移動のイメージングおよび解析を行いました。予想どおり、抗がん剤であるコルヒチン、シトカルラシンD、ノコダゾールによる処理は、コントロールと比較して細胞移動速度を有意に低下させました。透過光および蛍光を用いて得られたデータは一致しており、SiR-Actinのような蛍光色素を保持できる細胞株であれば、蛍光標識の有無にかかわらず細胞移動を観察できることを示しています。
ImageXpress Picoシステムは、細胞がセルフリー領域へ移動する様子を時間経過とともに定量化することを可能にします。タイムラプス画像は、一定間隔で自動取得することも、たとえば装置にライブセル維持のための環境制御オプションが搭載されていない場合や、長時間のタイムラプス実験中に他の研究者が同じ装置で画像取得を行う必要がある場合には、プレートを装置に出し入れして手動で取得することも可能です。このシステムは、低倍率対物レンズ(4Xまたは10X)を用いて、96ウェルまたは384ウェルのOris Proマイクロプレートでのアッセイに対応しています。複数の視野が必要な場合には、ソフトウェアが自動的に画像を結合します。統合されたCellReporterXpressソフトウェアでは、透過光画像または蛍光画像を用いてウェル内の細胞単層が覆っている面積を解析するプロトコールを簡単に設定でき、プレートの画像取得中に結果を確認することが可能です。
参考文献
- Barrett CS, Millena AC, Khan SA. (2017) TGF-ß Effects on Prostate Cancer Cell Migration and Invasion Require FosB. Prostate 77(1):72-81
- Julier Z, Park AJ, Briguez PS, Martino MM. (2017) Promoting tissue regeneration by modulating the immune system. Acta Biomater 53:13-28
- Nevius E, Gomes AC, Pereira JP. (2016) Inflammatory Cell Migration in Rheumatoid Arthritis: A Comprehensive Review. Clin Rev Allergy Immunol 51(1):59-78
- Shiraishi M, Shintani Y, Ishida H, Saba R, Yamaguchi A, Adachi H, Yashiro L, Suzuki K. (2016) Alternatively activated macrophages determine repair of the infarcted adult murine heart. J Clin Invest 126(6):2151-66
PDF版(英語)