Application Note ImageXpress Microを用いた
ライブセルキネティクスアッセイ
- 数時間から数日にわたるタイムコース実験をモニター
- 毎回まったく同じ視野(FOV)に戻ります
- わずか2クリックで動画を作成
PDF版(英語)
はじめに
モレキュラーデバイスのImageXpress® Micro Confocal / XLS Widefield ハイコンテントイメージングシステムには、オプションのフルイディクスモジュールと環境制御モジュールが搭載可能であり、急速なキネティクス実験や長時間のタイムラプス実験中に化合物添加や培地交換を行うための単一チャンネルピペッティングを実現します。フルイディクスオプションはMetaXpress® ハイコンテント画像取得・解析ソフトウェアによって制御され、各ピペッティングイベントを精密に管理できます。各システムは96ウェルおよび384ウェルフォーマットのピペットチップを使用し、3~200 µLの範囲で正確な分注が可能です。化合物プレートまたは培地リザーバーを2枚まで搭載でき、加温もオプションで対応します。環境制御とフルイディクスモジュールを備えたImageXpress Microシステムにより、研究者は化合物を添加し、その後数分から数日にわたる生細胞応答をモニターできます。
Transfluor® Cell-Based GPCRアッセイキットは、ハイコンテントスクリーニング(HCS)において、GFP標識ß-arrestinを用いた自動画像解析によりGPCRの脱感作とリサイクリングを定量化し、Gタンパク質共役受容体(GPCR)の活性化を追跡するための有用なツールです。Transfluorアッセイは、90種類以上のGPCRで検証され、創薬プログラムにおいて一次および二次スクリーニング法として広く利用されています。このアッセイは、下流のGタンパク質シグナルに依存しない「ユニバーサル」なGPCR脱感作およびリサイクリング経路をモニターするため、ほぼすべてのGPCRの研究に使用できます。対象GPCRの遺伝子を過剰発現させた細胞株に、GFPタグ付きß-arrestin遺伝子を発現させる必要があります。
各Transfluorアッセイでは、画像解析を用いて、GPCR活性化後にß-arrestin-GFPが受容体と共に内在化する様子を定量します。未刺激細胞では、ß-arrestin-GFP蛍光は細胞質に拡散しています。GPCRが活性化されると、ß-arrestinは受容体を内在化へと誘導し、小さな蛍光性クラスリン被覆ピットが出現します。受容体がß-arrestinに高親和性を示す場合、細胞はさらに大きく明るい蛍光性エンドサイト小胞を形成します(図1および図2)。
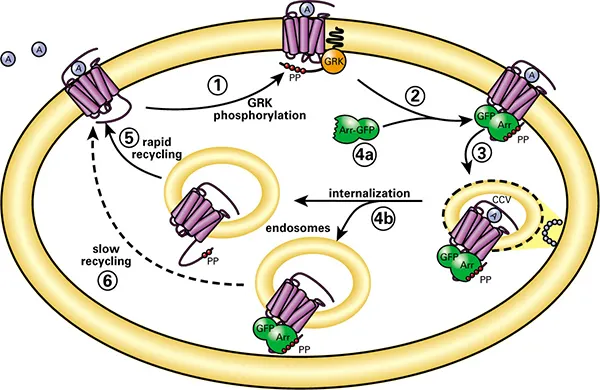
図1. Transfluorアッセイ技術。GPCR脱感作および再感作モデルにおけるアレスチンの役割。(1) アゴニスト活性化GPCRはGRK(Gタンパク質共役受容体キナーゼ)によりカルボキシ末端でリン酸化。(2) アレスチン(Arr)はアゴニスト結合しGRKリン酸化された受容体に膜上で結合。(3) アレスチンは脱感作受容体をクラスリン被覆ピットへ誘導。(4a) 一部受容体は低親和性で結合し膜付近で解離。(5) これらはアレスチンなしで内在化し迅速にリサイクル。(4b) 他の受容体は高親和性で結合し、受容体-アレスチン複合体として内在化。(6) これらはゆっくりリサイクル。
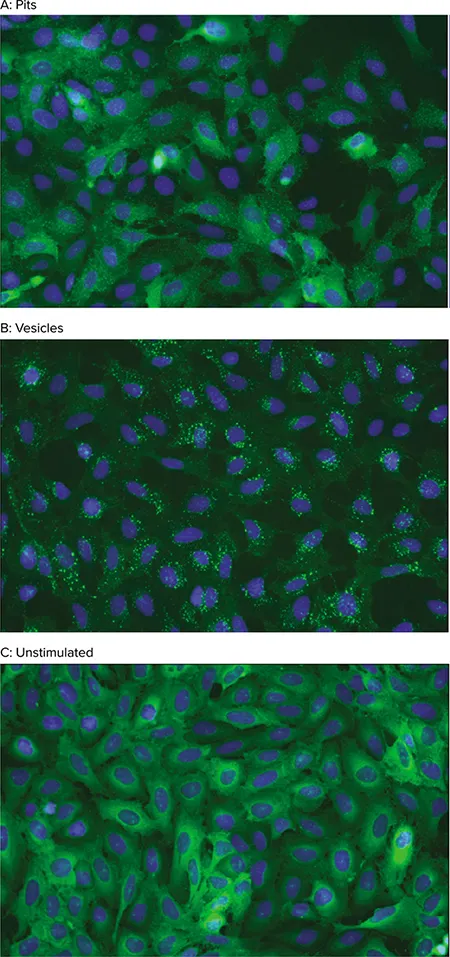
図2. Transfluorアッセイ細胞表現型 GPCR活性化により、ß-arrestin-GFPを含むピット(A)または小胞(B)が形成。未刺激細胞ではß-arrestin-GFPは細胞質に拡散(C)。画像はImageXpress Microシステムで20倍倍率で取得。核(青)はHoechst 33342で染色。
Transfluorアッセイは従来エンドポイントアッセイであり、アゴニストモードではアゴニスト誘導60分後に定量します。アンタゴニストモードでは、アンタゴニスト誘導45分後にアゴニスト誘導60分を行い測定します。化合物存在下では、誘導は数分スケールで進行し、ピット形成は最終的に定常状態に達します。これにより、便利で堅牢なエンドポイント「固定・染色」法が可能です。
本実験は、アゴニストおよびアンタゴニストに対するTransfluorアッセイ応答のキネティクスを示し、エンドポイントアッセイで画像取得に最適な60分時点を確認するために設計されました。実験はImageXpress Microシステムの環境制御チャンバーとスケジュールされたフルイディクス添加を用いて実施しました。
ImageXpress Microシステムにフルイディクスモジュールを追加することで、Transfluorアッセイにおけるピットおよび小胞の形成と消失をキネティクス実験で解析できます。MetaXpressソフトウェアは画像取得と解析を完全自動化します。Transfluorアプリケーションモジュールは、Transfluorアッセイ画像解析専用に設計・最適化されています。現在、カスタムジャーナルを用いてキネティックTransfluorアッセイデータを解析しています。
材料
Transfluor アッセイの実施には、モレキュラーデバイスからのライセンスが必要です。Transfluor アッセイ試薬は、Transfluor アッセイのライセンスがモレキュラーデバイスから入手できます。詳細はモレキュラーデバイスにお問い合わせください。
注意:すべての溶液は、各実験の直前に新しく調製してください。
- ß-arrestin-GFP および ß-2 アドレナリン受容体(ß2AR)発現 U2OS 細胞(モレキュラーデバイス)
- 96ウェルマイクロプレート、ポリ-D-リジンコート、クリアボトム、黒色ポリスチレン (Corning) 細胞アッセイプレートに使用。
- 96ウェルクリアマイクロプレート、丸底ポリプロピレン、滅菌済み (Corning)。ソース/化合物プレートに使用。
- U2OS培地: MEM(Gibco)に10%熱不活性化FBS(Gibco)、10 µg/mLゲンタマイシン(Gibco)、10 mM HEPES(Gibco)、0.4 mg/mL Zeocin(Gibco)、および0.4 mg/mL G418(Gibco)を加えたもの。
- 飢餓培地: 血清、フェノールレッド、抗生物質を含まないMEM(Gibco) with 10 mM HEPES
- アスコルビン酸培地: 1mg/mLのアスコルビン酸(L-アスコルビン酸ナトリウム、Sigma)
- イソプロテレノール原液 細胞培養グレードのDMSO(Sigma)中の(-)-イソプロテレノール(+)-酒石酸塩(Sigma)の5 mMストック溶液
- プロパノール原液: (s)-(-)-プロパノール塩酸塩(Sigma)の細胞培養グレードDMSO(Sigma)中5mMストック溶液
- 塩化カルシウムおよび塩化マグネシウムを含まないDPBS(Sigma)
- 4%メタノールフリーホルムアルデヒド:16%メタノールフリーホルムアルデヒド(Polysciences)塩化カルシウムと塩化マグネシウムを含むDPBSで希釈(Gibco)
- Hoechst 33342、10mg/mL(Invitrogen)
測定方法
アッセイプロトコール
ステップ1. U2OS培地100 µLに35,000 cells/wellでポリ-D-リジンコート96ウェルマイクロプレートに播種。37℃、5%CO₂で一晩培養。

ステップ2. ImageXpress Microシステムを起動し、オプションコントロールボックスで化合物およびサンプルプレート位置の温度を37℃に設定。CO₂供給を確認。システムを1時間以上平衡化。
ステップ3. 培地を除去し、Hoechst 33342を1:300,000希釈で含む75 µLの飢餓培地に置換。遮光し37℃、5%CO₂で20分インキュベート。この間に装置パラメータを設定(「ImageXpress Microアッセイセットアップ」参照)。
ステップ4. Hoechst染色を除去し、新しい飢餓培地75 µLに置換。
ステップ5. 環境制御ガスケットを装着したImageXpress Microシステムにプレートをロード。
ステップ6. t=1分から62分間、1分間隔で各ウェルをイメージングします。
ステップ7. ImageXpress Microシステムを用いて、新しいイベントを追加し、t=2で化合物またはコントロールを75 µL添加(撮像後)。化合物プレート1から追加し、1回混合、混合後にチップ交換。
a) ウェルA01-A03:コントロール、飢餓培地のみ(FBSなし)
b) ウェルB01-B03:2Xイソプロテレノール(最終濃度100 nM)アスコルビン酸培地
c) ウェルC01-C03:同上
ステップ8. t=32で新しいイベントを追加し、化合物プレート2からアンタゴニストまたは飢餓培地でウェルを洗浄(3回交換、50%交換、交換ごとに新しいチップ)。
a) ウェルA01-A03:コントロール、10%FBS添加飢餓培地
b) ウェルB01-B03:100 nMプロプラノロール飢餓培地
c) ウェルC01-C03:10%FBS添加飢餓培地
ImageXpress Microシステム アッセイセットアップ
血清飢餓と核染色の20分間のインキュベーション中に、装置パラメータを設定します。ImageXpress Microシステムには環境制御およびフルイディクスオプションが搭載されている必要があります。
ステップ 1. Devices / Environmental Control を選択し、環境制御チャンバーの現在の状態を確認します。
- 化合物プレートおよびサンプルプレートの温度は37℃であること
- CO₂圧力が適切なレベルの場合、「OK」と表示
- 湿度チャンバーに十分な液体がある場合、「Liquid Level」が「OK」と表示
ステップ2. Plate Acquisition Setup/ Fluidicsタブで、Configure Stations→System Propertiesを選択して以下のパラメーターを定義します。
- Draw and Dispense speed:5 µL/sec
- Post draw air gap:2 µL
- Pre draw air gap:10 µL
- Wet dispense:ON
- Smart dispense:OFF
- Draw overfill:0 µL
- Pump settle time:100 ms
Configure Stationsダイアログで選択:
- Track volume:ON
- Track liquid surface:ON
- Initial volume for tracking for compound plates:150 µL
- Plate Acquisition Setup/ FluidicsタブのScheduled Events 設定:
- Image 2後:化合物追加、75 µL、Compound Plate 1、全選択ウェル、混合1回、交換ごとに新しいチップ
- Image 32後:洗浄、75 µL、Compound Plate 2、全選択ウェル、チップ交換あり、3回交換
ステップ3. 化合物プレート1および2の準備(MetaXpressソフトウェアはマイクロプレートウェルの1対1マッピングを実行します)
- 化合物プレート1:Costar 3904マイクロプレートのウェルB01~C03に、2X 200 nMイソプロテレノール(最終濃度100 nM)を含むアスコルビン酸培地150 µLを分注します。ウェルA01~A03には飢餓培地150 µLを分注します。
- 化合物プレート2:Costar 3904マイクロプレートのウェルB01~B03に、1Xプロプラノロールを含む飢餓培地275 µLを分注します。ウェルA01~A03およびC01~C03には10%FBS添加飢餓培地を分注します。
画像取得
MetaXpressソフトウェアを使用し、DAPIおよびFITCフィルターセットでカメラゲインを1に設定し、20X Plan Fluor ELWD(NA = 0.45)対物レンズで2×2ビニング画像を取得しました。ここで示す結果は、ウェルごとに単一サイトで取得したものです。
画像のレビュー
MetaXpressソフトウェアで、[Screening] メニューの [Review Plate Data] ダイアログから実験をロードし、[Select Plate] を選択して対象プレートに移動します。実験がロードされると、選択されたウェルがモンタージュに表示されます(図3A)。ウェルをクリックすると、フル解像度画像が表示されます(図3B)。画像は単一波長またはカラー合成で表示可能です。
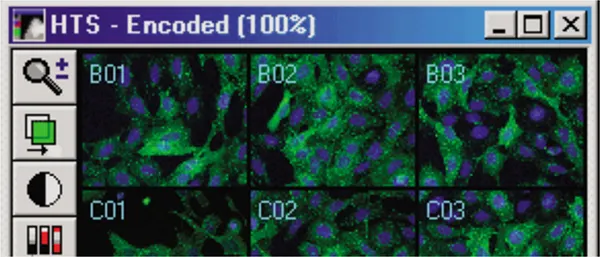
図3A. Transfluorアッセイ実験画像モンタージュ。
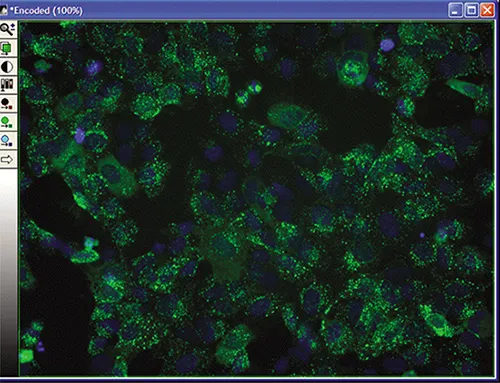
図3B. 選択ウェルデータ。
個別画像を表示するには、[Review Plate Data] ダイアログでタイムポイントを変更するか、ビューを「Time vs. Well」に変更します(キネティクス実験に推奨)。ウェルを右クリックして選択し、[Load Images] をクリックすると、すべてのタイムポイントがスタックとしてロードされ、ムービーとして表示・エクスポートできます(図3C)。
図3C. タイムポイントデータのスタック。
画像解析
キネティックデータはKinetic Transfluor Analysisジャーナルで解析できます。モレキュラーデバイスのWebサイトのKnowledge Baseセクションで詳細手順を確認し、ジャーナルをダウンロード、インストール、実行してください。
アッセイ条件が変更された場合、ジャーナル内の解析パラメータを再最適化する必要があります。Knowledge BaseサイトのArticle 19736の手順を参照し、正しいTransfluorアッセイ設定を確認してください。
結果
ß-arrestin-GFPを発現するU2OS細胞と、WT ß2AR(ピット形成)または改良型ß2AR(小胞形成)を発現する細胞を、アッセイ培地のみ、またはイソプロテレノール(アゴニスト)±プロプラノロール(アンタゴニスト)で処理しました。改良型ß2ARはC末端を修飾しており、ß-arrestinへの親和性が高く、蛍光小胞形成を可能にします。
画像は環境制御およびフルイディクスオプションを搭載したImageXpress Microシステムで取得し、カスタムKinetic Transfluor Analysisジャーナルで解析しました。
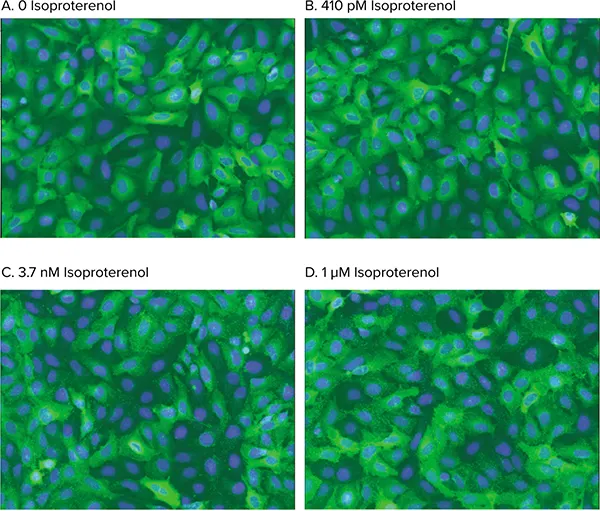
図4. アゴニスト刺激によるピット形成。WT ß2AR活性化時のß-arrestin-GFPトランスロケーションの用量依存解析画像。細胞は0(A)、410 pM(B)、3.7 nM(C)、1 µM(D)のイソプロテレノールで処理。Transfluorアッセイアプリケーションモジュールはアゴニスト刺激によるピット形成を正確に識別。
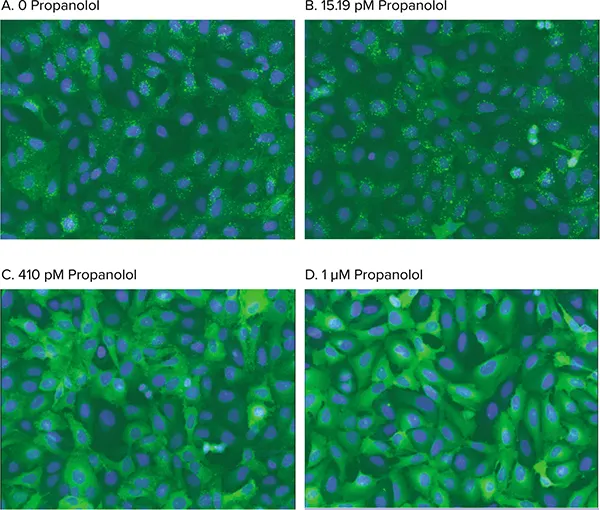
図5. アゴニスト刺激による小胞形成 改良型ß2AR刺激によるß-arrestin-GFPトランスロケーション阻害の用量依存解析画像。細胞は0(A)、15.19 pM(B)、410 pM(C)、1 µM(D)のプロプラノロールで処理し、50 nMイソプロテレノールで刺激。Transfluorアッセイアプリケーションモジュールはアンタゴニスト阻害による小胞形成阻止を正確に識別。
用量反応および阻害解析
ピット形成細胞株と小胞形成細胞株の両方で、アゴニスト(イソプロテレノール)およびアンタゴニスト(プロプラノロール)の時間依存応答を、MetaXpressソフトウェアのTransfluorアッセイアプリケーションモジュールに基づくカスタムジャーナルで測定しました。各用量は4回の反復実験で単一ウェルにて実施。
AcuityXpress™ソフトウェアを使用し、Hill曲線フィッティングにより、ピットまたは小胞面積/細胞に基づいてEC₅₀およびIC₅₀値を算出し、タイムコースの各タイムポイントでプロットしました。
表示データは単一タイムコース実験のものです。ß2AR改良型細胞は3条件(基底、アゴニスト+アンタゴニスト、アゴニストのみ)で処理。ß2AR野生型細胞は2条件(基底、アゴニストのみ)で処理。
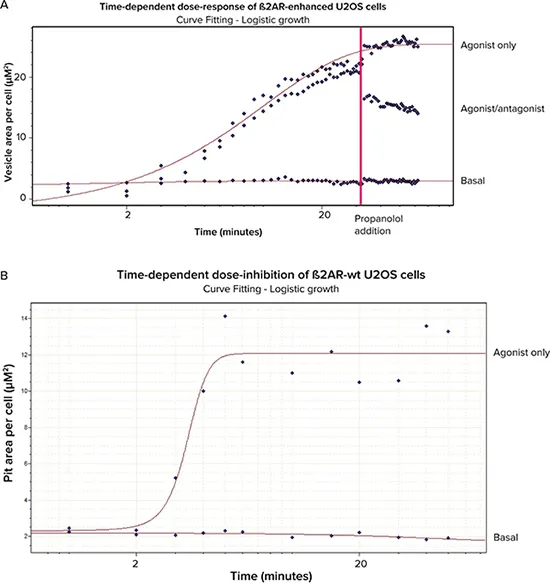
図6. 用量反応および阻害曲線 A:ß2AR改良型細胞(基底、アゴニスト+アンタゴニスト、アゴニストのみ)。B:ß2AR野生型細胞(基底、アゴニストのみ)。
結論
環境制御およびフルイディクスモジュールを搭載したImageXpress Microシステムは、キネティックTransfluorアッセイを成功裏に実行しました。MetaXpressソフトウェアのキネティック解析ジャーナルは、TransfluorアッセイにおけるGPCR活性化に伴うß-arrestin-GFPトランスロケーションによるピットおよび小胞形成を明確に識別・測定しました。AcuityXpressソフトウェアで解析したグラフは、60分のエンドポイントリードを取得すれば応答が安定し、明確に分離されることを示しています。これらの結果は、環境制御およびフルイディクスモジュールを備えたImageXpress MicroシステムとTransfluorアッセイの組み合わせが、GPCRモジュレーターのスクリーニングにおけるキネティクス実験において堅牢なツールであることを示しています。小胞形成応答のタイムラプス動画は当社Webサイトをご覧ください。
参考文献
- Oakley, R.H., Hudson, C.C., Cruickshank, R.D., Meyers, D.M., Payne, R.E. Jr., Rhem, S.M., Loomis, C.R. The cellular distribution of fluorescently labeled arrestins provides a robust, sensitive, and universal assay for screening G-protein-coupled receptors. Assay Drug Devel Tech 2003; 1:21-30.
- Oakley, R.H., Laporte, S.A., Holt, J.A., Barak, L.S., Caron, M.G. Association of beta-arrestin with G-protein-coupled receptors during clathrin-mediated endocytosis dictates the profile of receptor resensitization. J Biol Chem 1999; 274:32248-32257.
- Catalano, S.; de Bruin, S.; Bosworth, J.; Gliksman, N.; Best, K.; Rickert, P. HighContent screening of GPCR activation with MetaXpress, AcuityXpress and the Transfluor assay system. Molecular Devices Application Note.
PDF版(英語)