Application Note セルペイントアッセイの
スループットを自動化で向上
- セルペイントアッセイの作業時間を80%以上削減します
- 柔軟な自動化プロセスは、幅広いアプリケーションに容易に対応できます
- セルペイントアッセイでヒューマンエラーを減らし、スループットを向上させます
PDF版(英語)
要旨
Michael Hayes, PhD | Beckman Coulter Life Sciences
Angeline Lim, PhD | モレキュラーデバイス
セルペイントは、創薬分野で広く利用されるスクリーニング手法となっています。 この表現型スクリーニングプラットフォームは、ハイコンテントイメージング、ハイスループットスクリーニング、液体ハンドリング、計算技術の進歩を活用し、大量のデータを生成します。セルペイントアッセイは、遺伝子改変や薬剤様の低分子ライブラリーと組み合わせて使用されることが多く、目的の表現型を誘導できる新しい薬剤や薬剤標的の同定に役立ちます。 しかし、セルペイントのワークフローは時間と労力を要し、数日間にわたり多数のアッセイプレートをスクリーニングする必要があります。Biomek i7 Hybrid 自動化ワークステーションのような自動化液体ハンドラーを使用することで、これらのプロセスを効率化し、貴重な作業時間を節約し、アッセイのスループットを向上させることができます。 本研究では、セルペイントアッセイプレートを準備するための自動化ワークフローを開発しました。細胞を染色した後、モレキュラーデバイス ImageXpress® Confocal HT.ai ハイコンテントイメージングシステムを使用して、後続のデータ解析に適した高品質な画像を取得しました。Biomek i7 Hybrid 自動化ワークステーションを用いて、細胞をパラホルムアルデヒドで固定し、Triton X-100で透過処理を行い、6種類のスペクトル的に互換性のある蛍光染料で染色しました。さらに、ケーススタディとしてコルヒチンのタイムコース実験を実施し、低分子スクリーニングのセットアップをシミュレーションしました。 これらのデータは、Biomekによる液体ハンドリングとImageXpressによるイメージングを組み合わせた自動化ワークフローが、形態プロファイリングに活用できることを示しています。さらに、作業時間とヒューマンエラーを削減し、アッセイのスループットを向上させるという利点もあります。
はじめに
近年の細胞生物学の進歩により、ヒト疾患のより複雑なモデルが開発されるようになりました。これには、患者由来のiPS細胞などの新しい細胞モデル、3Dオルガノイドなどの新しい培養方法、CRISPR/Cas9などの精密な遺伝子編集技術が含まれます。これらの細胞モデルを用いる多くのワークフローでは、最終的な読み出しとして蛍光イメージングが使用されるため、より複雑で情報量の多い実験系が開発されています。 創薬分野で注目されているワークフローのひとつがセルペイントであり、これは市販の蛍光染料をマルチプレックスで使用する細胞形態プロファイリング手法です *1。この表現型スクリーニングプラットフォームは、ハイコンテントイメージング、ハイスループットスクリーニング、液体ハンドリングの進歩を活用し、大量のデータを生成します。セルペイントは、遺伝子スクリーニングや低分子スクリーニングなど、さまざまな細胞操作の解析に利用されています。遺伝子スクリーニングでは、各ウェルにsiRNAやCRISPR/Cas9を用いて標的遺伝子を操作する試薬が含まれます。低分子スクリーニングでは、数千から数百万の化合物をテストし、薬剤候補を特定します。
セルペイントスクリーニングの実施後、画像ベースのプロファイリングを用いて、作用機序に基づき遺伝子や化合物をクラスタリングできます *2。さらに、ハイコンテント画像に基づいて、生理学的に関連するモデル系で生物活性化合物を特定するために、AIや機械学習を活用する取り組みが増えています *3。従来のスクリーニングでは、各遺伝子や化合物の表現型への影響を単一の読み出しで評価しますが、セルペイントは各条件に対して細胞形態プロファイルを作成できるという利点があります。事後解析により、既知のコントロール条件と実験条件をセルペイントプロファイルに基づいてクラスタリングできます *4。(この分野は、画像ベースのデータセットが増えることで計算手法が洗練され、創薬分野での有用性がさらに高まると考えられます。)
典型的なセルペイントアッセイの一般的なワークフローは以下のとおりです(図1)。まず、細胞を光学底付きのマイクロタイタープレートに播種します。一般的に、接着性細胞が好まれます。これは、イメージング工程が容易になるためです。次に、遺伝子スクリーニングではトランスフェクション、低分子スクリーニングでは化合物添加により、目的の表現型が観察できるまで細胞を処理・培養します。その後、細胞を固定(パラホルムアルデヒド)、透過処理(Triton X-100)、染色(ライブ染色を使用する場合は固定前)します。プレートは、モレキュラーデバイス ImageXpress Confocal HT.ai ハイコンテントイメージングシステムなどの自動蛍光共焦点顕微鏡でイメージングします。画像は、IN Carta® Image Analysis SoftwareやオープンソースのCellProfilerなどの画像解析ソフトウェアで解析され、測定値はStratoMineR(Core Life Analytics)などのウェブベースのデータマイニングパイプラインに入力され、細胞形態プロファイルの解析に利用されます *5。
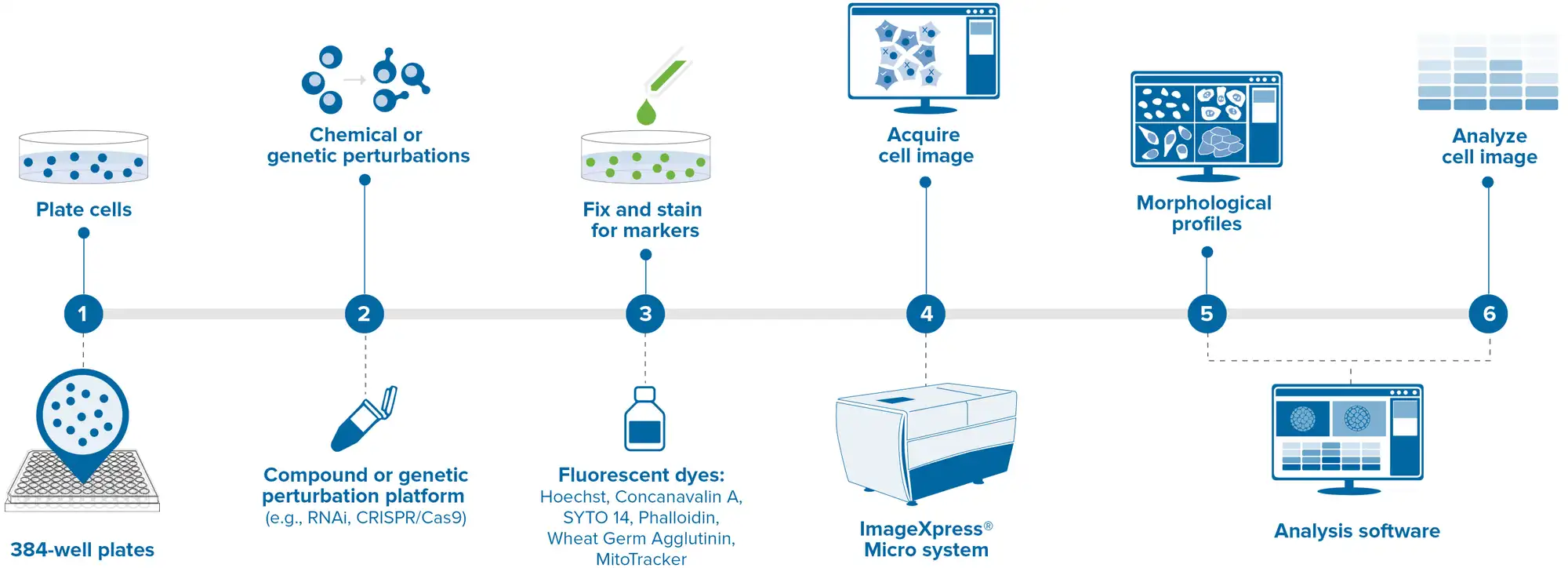
図1. セルペイントワークフロー 自動化されたセルペイントの液体ハンドリング、画像取得、データ解析の簡略化プロトコールです。細胞はBiomek i7 Hybrid 自動化ワークステーションを使用して播種、薬剤処理、固定、染色を行いました。画像はモレキュラーデバイス ImageXpress Confocal HT.aiで取得しました。
このワークフローは数日を要し、ユーザーによる複数の操作が必要です。少数の条件をテストする場合や96ウェルプレートで作業する場合は、手動ピペッティングでも可能ですが、より高密度(384ウェル以上)やスループットの増加が求められる場合、手作業での実施は現実的ではありません。 Biomek i7 Hybrid 自動化ワークステーションは、セルペイントワークフローにおける複雑な液体ハンドリング工程を効率的に実行できる自動化液体ハンドラーです(図2)。これにより、必要なユーザー操作の回数を最小限に抑え、ウォークアウェイタイムを増やし、オペレーターが他の作業に集中できるようになります。 マルチチャンネルポッドには96ウェルまたは384ウェルヘッドを搭載でき、それぞれ1~1200 μLおよび0.5~60 μLの正確なピペッティングが可能です。さらに、8チャンネルのSpan-8ポッドは0.5~1000 μL以上の範囲で正確に操作できます。このワークステーションは45のデッキポジションをサポートし、オービタルシェーカー、加熱/冷却ペルチェ、チップウォッシャーなどの装置を直接搭載してプレートやサンプル処理を行うことができます(図2)。

図2. Beckman Coulter Life Sciences Biomek i7 Hybrid 自動化ワークステーションとモレキュラーデバイス ImageXpress Confocal HT.ai ハイコンテントイメージングシステム
さらに、ユーザーのニーズに応じて、Biomek i7 Hybrid ワークステーションは、組織培養インキュベーター、バーコードリーダー、プレートウォッシャー、試薬ディスペンサー、マルチモードマイクロプレートリーダー、遠心機、自動蛍光顕微鏡など、他の自動化プレートハンドリング装置との統合をサポートします。もう一つの重要な機能は、オプションのHEPAフィルターであり、哺乳類細胞培養を扱う際に重要な、より無菌的な環境を提供します。 Biomekシステムを自動化セルインキュベーター(例:Liconic、Cytomat、Thermo Fisher)およびハイコンテントイメージングと統合することで、セルペイントワークフロー全体(細胞播種から画像取得まで)を、ユーザーによるデッキセットアップのみで実行できます。 ImageXpress Confocal HT.ai ハイコンテントイメージングシステムは、7レーザー光源を搭載したスケーラブルなハイスループット・ハイコンテントスクリーニングソリューションです。高強度レーザーの使用により、画像品質を損なうことなく露光時間を短縮でき、LED光源を搭載したシステムと比較して取得速度が大幅に向上します。さらに、ImageXpress Confocal HT.aiは最大8チャンネルのイメージングが可能であり、セルペイントのような高度にマルチプレックス化されたアッセイに最適です。
ここでは、HEK293細胞を用いた自動化ワークフローを紹介します。Biomek i7 Hybrid ワークステーションで細胞播種から固定・染色までを行い、その後ImageXpress Confocal HT.ai ハイコンテントイメージングシステムで画像取得を行いました。この自動化ワークフローにより、ユーザーの作業時間とサンプルハンドリングエラーの可能性を減らし、スループットを向上させることができます。
方法
細胞培養
Lenti-X 293T細胞(Takara)は、5% CO₂、37°Cで、DMEMに10% FBSと1% 100X抗生物質/抗真菌剤(Gibco)を添加した培養液で維持しました。細胞回収のため、培養液をDPBSで洗浄し、トリプシンで解離後、Allegra X-14R遠心機(Beckman Coulter Life Sciences)で300 × gでペレット化し、Opti-MEM Iと培養液を1:1で混合した液に再懸濁しました。細胞は血球計算盤でカウントし、最終的に100細胞/μLの濃度になるようOpti-MEM Iで希釈しました。96ウェルプレートでは、Biomek i7 Hybrid ワークステーション(HEPAフィルター搭載)を使用し、各ウェルに10,000細胞(総量100 μL)を播種しました。低分子薬剤処理をシミュレーションするため、コルヒチンをOpti-MEM Iで1 μMに希釈し、指定のタイムポイントで各ウェルに50 μL添加しました。Opti-MEM Iのみを添加したものをコントロールとしました。
自動化セルプレート調製
本実験は、既報のプロトコールに準じて実施しました *1。自動化液体ハンドリングでは、すべての吸引および洗浄工程を96ウェルマルチチャンネルポッド(1200 μLヘッド搭載)で行い、試薬添加工程はSpan-8ポッドで実施しました。自動化方法のデッキレイアウトは図3に示します。すべての自動化液体ハンドリング工程は、ウェル中央から70%以上離れた位置で5 μL/secの速度で吸引・分注するピペッティングテンプレートを使用しました。これにより、セルペイント手順中にウェル底の細胞単層が乱されないようにしました。パラホルムアルデヒド溶液は、アッセイ当日に16%ストック溶液を超純水で希釈し、6.8% PFAを調製しました。
まず、96ウェルプレートの各ウェルから110 μLを吸引し、最終的に40 μLを残しました。その後、各ウェルを110 μLのDPBSで2回洗浄しました。次に、各ウェルに60 μLのMitoTracker Deep Redを添加し、室温・暗所で20~30分間インキュベートし、再度DPBSで洗浄しました。次に、6.8% PFAを60 μL添加して細胞を固定し、最終濃度4% PFAとしました。プレートを室温・暗所で20分間インキュベート後、PFAを除去し、DPBSで2回洗浄し、各ウェルに150 μLのDPBSを残しました。プレートは封印し、暗所で4°Cに保存し、セルペイントアッセイ当日に染色とイメージングを行いました。
セルペイントアッセイ
Triton X-100透過処理液は、Triton X-100を0.1%に希釈し、0.1 mg/mL BSAを添加したDPBSで調製しました。Hoechst、コンカナバリンA、SYTO 14、WGA、ファロイジンの蛍光染料ストック溶液を調製し、Brayらの報告に従って単一の染色マスターミックスに混合しました(1)。細胞はDPBSで洗浄後、120 μLのTriton溶液を添加し、室温・暗所で10~20分間透過処理しました。Tritonを除去後、DPBSで2回洗浄しました。次に、40 μLの染色試薬を添加し、室温・暗所で30分間染色しました。最後に染色液を除去し、DPBSで3回洗浄し、ImageXpress Micro HT.ai ハイコンテントイメージングシステムでプレートをイメージングしました。
画像取得とデータ解析
画像は IN Carta Image Analysis Software を使用して解析しました。画像セグメンテーションプロトコールは以下のように設定しました:核を一次ターゲットとして、カスタムセグメンテーションの事前学習モデル「Nuclei.a.h5」を使用しました。エッジに接触するオブジェクトは除外しました。細胞はYFPチャンネル(SYTO14)を用いてRobustオプションでセグメント化しました。さらに、3つの細胞小器官クラスを指定オプションでセグメント化しました:ミトコンドリア(ネットワーク)、アクチン(フィラメント)、小胞体(ネットワーク)。各細胞コンパートメントから測定値を抽出しました。形状、サイズ、強度、テクスチャ、共局在、隣接オブジェクトとの空間関係などの測定値を解析出力として選択しました。合計で、細胞ごとに487の特徴量を抽出しました。
データ解析では、細胞レベルのデータをCSV形式でエクスポートし、化合物情報を含むメタデータのテキストファイルとともに HC StratoMineR(CoreLife Analytics) にアップロードしました。プレートマップはStratoMineRのインターフェース内で定義しました。Quality Controlタブを使用して、解析から外れ値のウェルを除外できます(50細胞未満のウェルは除外しました)。推奨に従ってデータ変換を行い、その後特徴量のスケーリングを実施しました。主成分分析(PCA)を用いてデータを縮約し、得られた7つの成分を用いて距離スコアを計算しました。このスコアは、ウェル内の細胞に対する処理の表現型効果を測定する指標です *6。
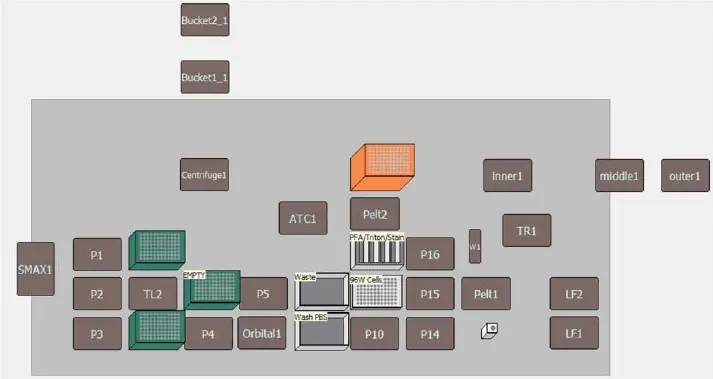
図3. 自動化セルペイントアッセイのデッキレイアウト: Biomek i7 Hybrid ワークステーションを用いた自動化手法では、以下の構成を使用しました:3つのチップローディングALP、5つの1×1 ALP、マルチチャンネルポッド、Span-8ポッド、230 μLピペットチップ2箱(+空箱1箱)、1070 μLピペットチップ1箱。
結果と考察
セルペイントは、さまざまな細胞操作後に情報量の多い結果を提供できるため、スクリーニング分野で人気が高まっています。セルペイントアッセイのプレート準備ワークフローには、労力を要する液体ハンドリング工程が含まれ、スクリーニングするプレート数が増えると手作業での実施は非現実的になります(1)。そこで、既報のベストプラクティス(1)に基づき、Biomek i7 Hybrid ワークステーションを用いたウォークアウェイプレート処理法を開発しました。プレートの染色前に、細胞は4% PFAで固定し、0.1% Triton X-100で透過処理しました。ここでは、新たに開発した自動化手法と手動で染色した細胞の液体ハンドリングを比較しました。
最初に評価したパラメータは、自動化ワークフローと手動ワークフローの時間短縮効果です。単一の96ウェルプレートを、12ウェルマルチチャンネルピペットを用いた手動法とBiomek i7 Hybrid ワークステーションで染色しました。1枚のプレートでは、両方のワークフローに約2時間かかりました(手動120分、Biomek 115分)、そのうち60分は室温・暗所でのインキュベーションです。Biomek法では、必要なハンズオンタイムは開始時のデッキセットアップのみで、5~10分でした。一方、手動法では60分間のアクティブなピペッティングが必要でした(表1)。さらに、自動化手法は384ウェルフォーマットにも容易に適応できました。384ウェル法では約120分かかりましたが、やはりハンズオンステップはデッキセットアップのみ(5~10分)でした。384ウェルワークフローは手作業では実施しませんでした。これは、このプレートフォーマットでは手動ピペッティングに3~4時間かかると判断されたためです。
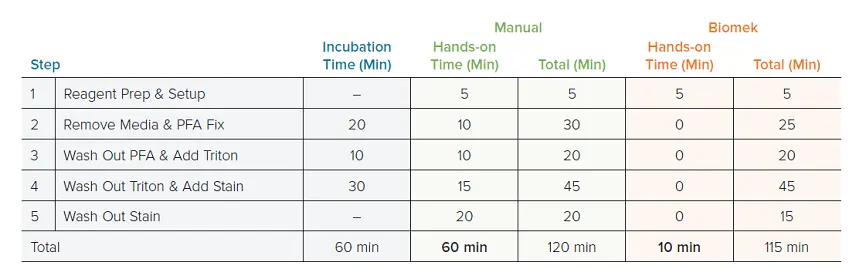
表1. 手動法と自動化セルペイントの所要時間
新たに開発した自動化手法を定性的に評価するため、HEK293細胞を複数の市販蛍光染料で染色しました(図4)。結果は概ね期待通りの染色パターンを示しました。小胞体、ゴルジ体、ミトコンドリア、核、RNA(核小体)は、既報のセルペイント結果と一致する染色パターンを示しました(図4)(1)。興味深いことに、ファロイジンによるF-アクチン染色では強い蛍光標識が得られましたが、以前のセルペイント結果のような明瞭なアクチンフィラメントは確認できませんでした。これは、使用したHEK細胞株とファロイジン染色濃度の組み合わせによる可能性があります。このことは、大規模スクリーニングを実施する前に、対象細胞株に最適な染色濃度を特定するための予備実験が必要であることを示しています。 さらに重要なのは、この実験結果が、自動化セルペイントおよび画像取得ワークフローが機能したことを示している点です。各ウェルの底に細胞が明確に存在しており、自動化液体ハンドリングが細胞をプレートに接着したまま固定できるほど穏やかであったことがわかります。また、通常は細胞に浸透しない複数の染料(ファロイジン、コンカナバリン)が細胞内コンパートメントを染色していることから、0.1% Tritonによる十分な透過処理が達成されたことが示されています。最後に、各チャンネルで観察された強い蛍光シグナルは、染色工程が成功したことを示しています。。
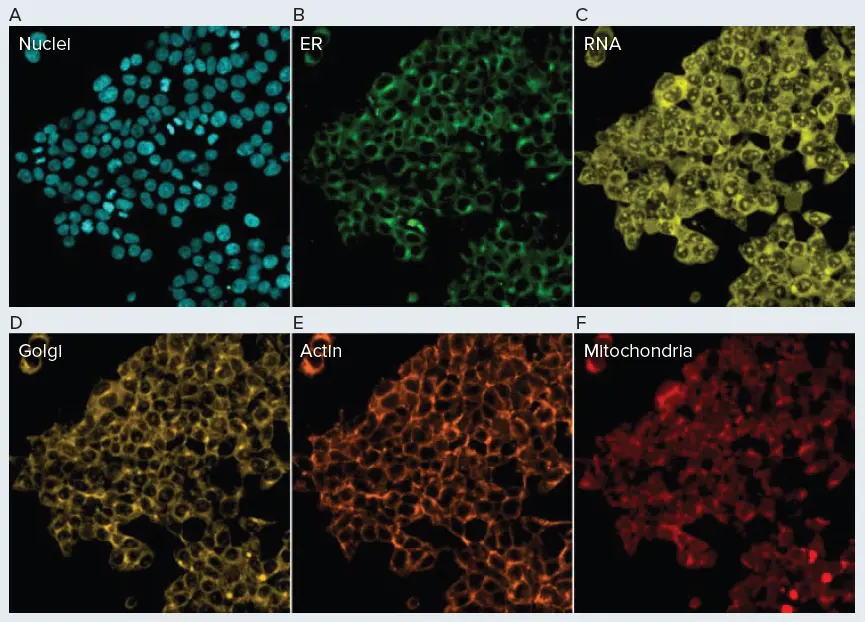
図4. 自動化セルペイントアッセイ。HEK293細胞をBiomek自動化手法で染色し、モレキュラーデバイス ImageXpress Confocal HT.ai ハイコンテントイメージングシステムでイメージングしました。小胞体はコンカナバリンAで染色(A)、ゴルジ体/細胞膜はウィートジャームアグルチニンで染色(B)、ミトコンドリアはMitoTrackerで染色(C)、核はHoechst 33342で染色(D)、アクチンはファロイジンで染色(E)、RNAはSYTO Greenで染色(F)。
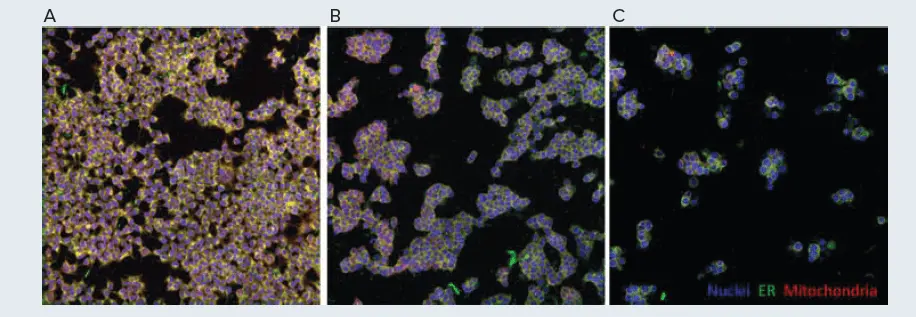
図5. セルペイントスクリーニングのシミュレーションコントロール。HEK293細胞をビークルコントロール(A)、または300 nMコルヒチンで4時間(B)、24時間(C)処理しました。画像はモレキュラーデバイス ImageXpress Confocal HT.ai ハイコンテントイメージングシステムで取得しました。
セルペイントはスクリーニング手法としてよく使用されるため、各ウェルには異なる細胞操作、例えば異なる薬剤様低分子が含まれることが多いです。このアッセイ設定をシミュレーションするため、コルヒチンをコントロール化合物として選択しました。コルヒチンはチューブリンに結合して阻害し、有糸分裂およびその後の正常な細胞分裂に必要なチューブリンの機能を阻害します。この作用機序により、この薬剤処理はHEK293細胞の形態に劇的な変化を引き起こすと予測されました。Biomekを使用して細胞を播種し、300 nMのコルヒチンで24時間または4時間処理し、未処理細胞をコントロールとしました。処理後、細胞はBiomek i7 Hybrid ワークステーションでセルペイントを行い、ImageXpress Confocal HT.ai ハイコンテントイメージングシステムでイメージングしました。コントロールとコルヒチン処理細胞間で観察された細胞表現型の違いは顕著でした(図5A、5C)。コルヒチン処理細胞は大きく丸みを帯びており、有糸分裂の中期で細胞周期が停止していることを示唆しています。さらに、薬剤処理後のウェルあたりの細胞数は減少しており、これは細胞が正常に分裂できなかったことが原因と考えられます。
セルペイントワークフローのもう一つの重要な部分は、後続の画像およびデータ解析です。画像はまず IN Carta Image Analysis Software を使用して解析しました。IN Cartaには、堅牢な特徴抽出を可能にするディープラーニングベースのセグメンテーションツール(SINAP)が搭載されています。解析では、SINAPの核モデルにより核検出が改善され、接触している核を正確に分離できました。SYTO14染色を用いて細胞質を定義し、小胞体、ミトコンドリア、アクチン構造も識別・解析しました。全体として、各細胞から強度、テクスチャ、形状、小器官間の空間関係、共局在数などを含む487種類の測定値が抽出されました。。
図5に示す各条件について、24ウェルの複製データを HC StratoMineR(Core Life Analytics) クラウドツールに入力しました。主成分分析を用いて487の測定値を7つの主成分に縮約しました。結果として、3つの明確なクラスターが観察され、それぞれが単一のコルヒチン処理条件を表していました(図6)。これは、Biomekによる自動化液体ハンドリングとImageXpressによる画像取得が、セルペイントワークフローにおいて有用であることを示しています。各複製が同一処理ウェルと正確にクラスタリングされたことは、品質管理化合物の有用性も示しています。コルヒチンは時間依存的な表現型の違いを誘導し、IN CartaおよびHC StratoMineRによる解析で明確に区別できました。
上記の結果は単一プレートの処理に関するものですが、多くのワークフローでは、より大規模なライブラリーをスクリーニングするために複数プレートの処理が必要です。ここでも、自動化液体ハンドラーの使用が優れた効果を発揮します。Biomekワークステーションは、自動インキュベーター(Cytomat)やハイスループット蛍光顕微鏡(モレキュラーデバイス)など、さまざまな統合機能を備えており、自動化された細胞処理とイメージングを実現できます。私たちの実験では、Biomekで可能な低速かつ穏やかなピペッティング技術を好みましたが、一部のユーザーはプレートウォッシャー(BioTek 405)や試薬ディスペンサー(MultiFlo/Multidrop)を用いて細胞洗浄工程を行うことを好む場合があります。幸い、Biomek iシリーズはこれらの装置とも統合可能であり、ここで示した方法よりも高度でハイスループットなワークフローを構築できます。さらに、セルペイントプレートの蛍光イメージングには時間がかかる場合があります(1プレートあたり1~2時間)、そのため複数プレートを同時に処理したくないユーザーもいるでしょう。Beckman Coulter Life Sciencesは SAMI EX スケジューリングソフトウェア も提供しており、このツールを使用することで、固定・透過・染色のタイムコースを均一に保ちながら、染色やプレート読み取りなどの工程を組み合わせた高度なタイミングとプレート処理をスケジューリングできます。これらのハードウェアとソフトウェアのオプションを組み合わせることで、ここで示した以上のハイスループットなウォークアウェイセルペイントワークフローを実現できます。
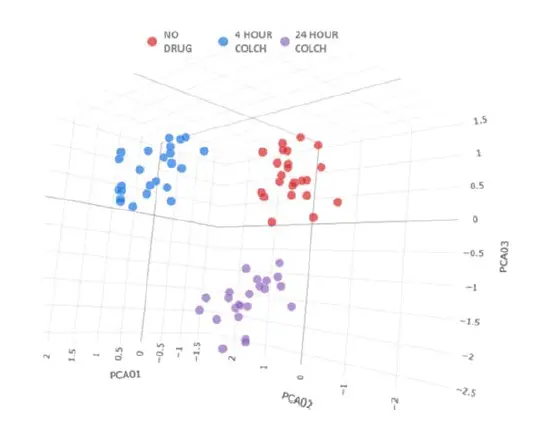
図6. データPCAプロット。各条件について、24ウェルの複製をHC StratoMineRで評価しました。ウェルは3つの明確なクラスターに分離され、それぞれが1つの処理条件を表しています。
まとめ(Summary)
創薬分野における疾患の高度な細胞モデルを構築する能力が進歩するにつれ、複雑なアッセイ読み出しを生成することへの関心も高まっています。その中で注目されている手法のひとつがセルペイントです。この手法では、数種類の市販細胞染色をマルチプレックス化し、複雑な表現型データを生成します(1)。この表現型手法を遺伝子(siRNA/CRISPR)や低分子スクリーニングと組み合わせることで、単一の実験から膨大なデータを得ることができます。セルペイントスクリーニングの実施後、画像ベースのプロファイリングを用いて、表現型に基づき遺伝子や化合物をクラスタリングし、推定作用機序を予測できます(2)。 しかし、セルペイントワークフローには2つのボトルネックがあります:アッセイプレートの準備と自動化された画像取得です。
アッセイプレートの手動準備は時間と労力を要し、薬剤処理やトランスフェクションのタイムコースによっては数日かかる場合があります。さらに、細胞の固定・透過・染色には96ウェルプレートあたり最大1時間のハンズオンタイムが必要です。これらの課題に対応するため、細胞播種と処理から蛍光染色、画像取得までを自動化したセルペイントワークフローを構築しました。本稿では、このワークフローの有用性と、Biomek i7 Hybrid ワークステーションおよびImageXpress Confocal HT.ai ハイコンテントイメージングシステムの機能を紹介しました。初期実験では、プレートが自動化手法で容易に培養、固定、染色、イメージングできることを確認しました。さらに、低分子(コルヒチン)スクリーニングワークフローも自動化でき、この方法で有意義なセルペイントデータを取得できることを示しました。Biomekによる自動化とImageXpressによるイメージングの組み合わせは、ハンズオンタイムを削減し、アッセイのスループットを向上させることで、セルペイントアプリケーションに価値を提供します。
参考文献
- Bray, M. A., Singh, S., Han, H., Davis, C. T., Borgeson, B., Hartland, C., Kost-Alimova, M., Gustafsdottir, S. M., Gibson, C. C., & Carpenter, A. E. (2016). Cell Painting, a high-content image-based assay for morphological profiling using multiplexed fluorescent dyes. Nature Protocols, 11(9), 1757–1774. https://doi.org/10.1038/nprot.2016.105.
- Chandrasekaran, S. N., Ceulemans, H., Boyd, J. D., & Carpenter, A. E. (2021). Image-based profiling for drug discovery: due for a machinelearning upgrade?. Nature Reviews Drug Discovery, 20(2), 145–159. https://doi.org/10.1038/s41573-020-00117-w.
- Simm, J., Klambauer, G., Arany, A., Steijaert, M., Wegner, J. K., Gustin, E., Chupakhin, V., Chong, Y. T., Vialard, J., Buijnsters, P., Velter, I., Vapirev, A., Singh, S., Carpenter, A. E., Wuyts, R., Hochreiter, S., Moreau, Y., & Ceulemans, H. (2018). Repurposing High-Throughput Image Assays Enables Biological Activity Prediction for Drug Discovery. Cell Chemical Biology, 25(5), 611–618.e3. https://doi.org/10.1016/j.chembiol.2018.01.015.
- Gustafsdottir, S. M., Ljosa, V., Sokolnicki, K. L., Anthony Wilson, J., Walpita, D., Kemp, M. M., Petri Seiler, K., Carrel, H. A., Golub, T. R., Schreiber, S. L., Clemons, P. A., Carpenter, A. E., & Shamji, A. F. (2013). Multiplex cytological profiling assay to measure diverse cellular states. PloS One, 8(12), e80999. https://doi.org/10.1371/journal.pone.0080999.
- Kamentsky, L., Jones, T. R., Fraser, A., Bray, M. A., Logan, D. J., Madden, K. L., Ljosa, V., Rueden, C., Eliceiri, K. W., & Carpenter, A. E. (2011). Improved structure, function and compatibility for CellProfiler: modular high-throughput image analysis software. Bioinformatics (Oxford, England), 27(8), 1179–1180. https://doi.org/10.1093/bioinformatics/btr095
- Omta WA, van Heesbeen RG, Pagliero RJ, van der Velden LM, Lelieveld D, Nellen M, Kramer M, Yeong M, Saeidi AM, Medema RH, Spruit M, Brinkkemper S, Klumperman J, Egan DA. HC StratoMineR: A Web-Based Tool for the Rapid Analysis of High-Content Datasets.Assay Drug Dev Techno l. 2016 Oct;14(8):439-452. doi: 10.1089/ adt.2016.726. Epub 2016 Sep 16. PMID: 27636821.
材料
| 機器 | メーカー |
|---|---|
| i7 ハイブリッド自動ワークステーション | Beckman Coulter Life Sciences |
| アレグラX-14R遠心機 | |
| ImageXpress Confocal HT.ai ハイコンテントイメージングシステム | モレキュラーデバイス |
表2.使用機器
| 試薬 | メーカー |
|---|---|
| DMEM、高グルコース、ピルバテン | ギブコ |
| 抗生物質/抗真菌剤、100X | ギブコ |
| ウシ胎児血清 | ギブコ |
| DPBS | ギブコ |
| トリプシン | ギブコ |
| Opti-MEM I | ギブコ |
| MitoTracker Deep Red | インビトロジェン |
| ヘキスト 33342 | インビトロジェン |
| Wheat Germ Agglutinin Alexa Fluor 555 Conjugate | インビトロジェン |
| コンカナバリンA Alexa Fluor 488 コンジュゲート | インビトロジェン |
| ファロイジン Alexa Fluor 568 コンジュゲート | インビトロジェン |
| SYTO Green 蛍光核酸染色 | インビトロジェン |
| 16% パラホルムアルデヒド | EM Sciences |
| コルヒチン | Alfa Aesar |
| Lenti-X 293T 細胞株 | Takara |
表3. 使用試薬
| 消耗品 | # | メーカー |
|---|---|---|
| iシリーズ、230μLピペットチップ、無菌 | 2 | Beckman Coulter Life Sciences |
| iシリーズ、1070μLピペットチップ、滅菌済み | 1 | Beckman Coulter Life Sciences |
| 96ウェルマイクロプレート | 1 | Beckman Coulter Life Sciences |
| 96ウェルハーフエリアハイコンテントイメージャーフィルムボトムマイクロプレート | 2 | Corning |
| 384ウェル組織培養プレーティングプレート | 1 | Nunc |
表4. 1回の実行で使用する消耗品
PDF版(英語)