Application Note 化合物スクリーニングと神経突起伸長解析
ImageXpress Pico システムによる高精度評価
- 化合物特異的な神経突起伸長への影響を評価します
- マルチプレックス測定により、神経ネットワークの広がりと複雑性を定量的に特徴付けます
- このアッセイを利用して、in vitroでの神経発生および神経変性を研究します
PDF版(英語)
はじめに
Oksana Sirenko|シニア・リサーチ・サイエンティスト|モレキュラーデバイス
神経突起伸長は、in vitroで神経発生および神経変性を研究するために一般的に使用されるアッセイです。神経突起の発達には、細胞外および細胞内シグナルの複雑な相互作用が必要です。神経突起の成長は、神経栄養因子によって促進または阻害されることがあります。重要なことに、神経の発達は神経毒性化学物質によって影響を受ける可能性があります。
私たちは、ImageXpress® Pico 自動細胞イメージングシステムを用いて、化合物が発達中の神経系に悪影響を及ぼす能力を測定するために神経突起伸長アッセイを評価しました。このアッセイは、神経系の発達における重要なプロセスとして、ニューロンが神経突起を伸ばして完全な神経ネットワークを形成することに関連しているため選択されました *1,*2。総神経突起伸長は、最も一般的に報告される指標ですが *3,*4、総分岐数や総プロセス数などの追加パラメータは、化合物が神経突起伸長を阻害する追加のメカニズムを示す可能性があります。
私たちは、マルチプレックス測定による神経ネットワークの広がりと複雑性の定量的特徴付けを含む、化合物特異的な神経突起伸長への影響を評価しました。神経突起伸長の表現型リードアウトは、複数の測定を用いて特徴付けられました。神経突起伸長は、伸長の広がり(総伸長長または細胞あたりの平均伸長)、神経突起プロセスの数(総プロセス数)、および分岐の程度(総分岐数および細胞あたりの平均分岐数)によって特徴付けられました。
材料
- iPSC 由来ニューロン(Human Neuronal Kit, NEURO KIT, XK-001-1V, エクセルサイエンス)
- ポリ-D-リジンプレコート384ウェルプレート(Corning Biocoat)
ラミニン(Sigma-Aldrich) - Hoechst (ThermoFisher Scientific)
- Hank's Balanced Salt Solution(Life Technologies)
- ImageXpress Pico 自動細胞イメージングシステム(モレキュラーデバイス)
- CellReporterXpress ® 画像取得および解析ソフトウェア(モレキュラーデバイス)
方法
iPSC由来ニューロンを、ポリ-D-リジンでコートされた384ウェルプレートに、3.3 mg/mLラミニン処理後に播種しました。1ウェルあたり10,000細胞を播種し、化合物処理の48時間前までiCell Neuron Maintenance Mediumで維持しました。これらの細胞における神経突起ネットワークは、播種後2時間で形成を開始し、培養10~12日まで複雑性が増加します。ニューロンはメーカー推奨に従い14日間培養し、その後384ウェルプレートで6段階の濃度範囲(0.3~100 μM)で72時間処理しました。神経突起伸長への影響は、総伸長、分岐、プロセス、およびウェルあたりの生細胞数を定量することで評価しました。濃度依存性はEC₅₀値を用いて評価しました。
細胞は37°C、5% CO₂で72時間化合物に曝露しました。次に、培地を除去し、4%ホルムアルデヒドで固定後、2回洗浄し、AF-488結合ファロイジンと1 μM Hoechst 33342を含む滅菌ハンクス平衡塩溶液の1:100混合液で2時間インキュベートしました。Calcein AMは神経突起伸長および細胞生存性のマーカーとして使用しました。インキュベーション後、染色液を0.1% FBSを含むリン酸緩衝生理食塩水(PBS)に置換し、イメージングを行いました。
各ウェルの画像は、ImageXpress Picoシステムで10X対物レンズを用いて取得しました。通常、384ウェルプレートの各ウェルにつき1枚の10X画像を撮影しました。10X対物レンズは、比較的大きな細胞数(200以上)における神経突起ネットワークと細胞内構造を識別するのに十分な解像度を提供し、これはウェル全体の約1/6の領域を表します。解析はCellReporterXpressソフトウェアを用いてオンザフライで実行され、神経突起トレース用の解析モジュールを含みます。図1は、DMSO処理ニューロンの代表的なズーム画像と神経突起トレースオーバーレイを示しています。
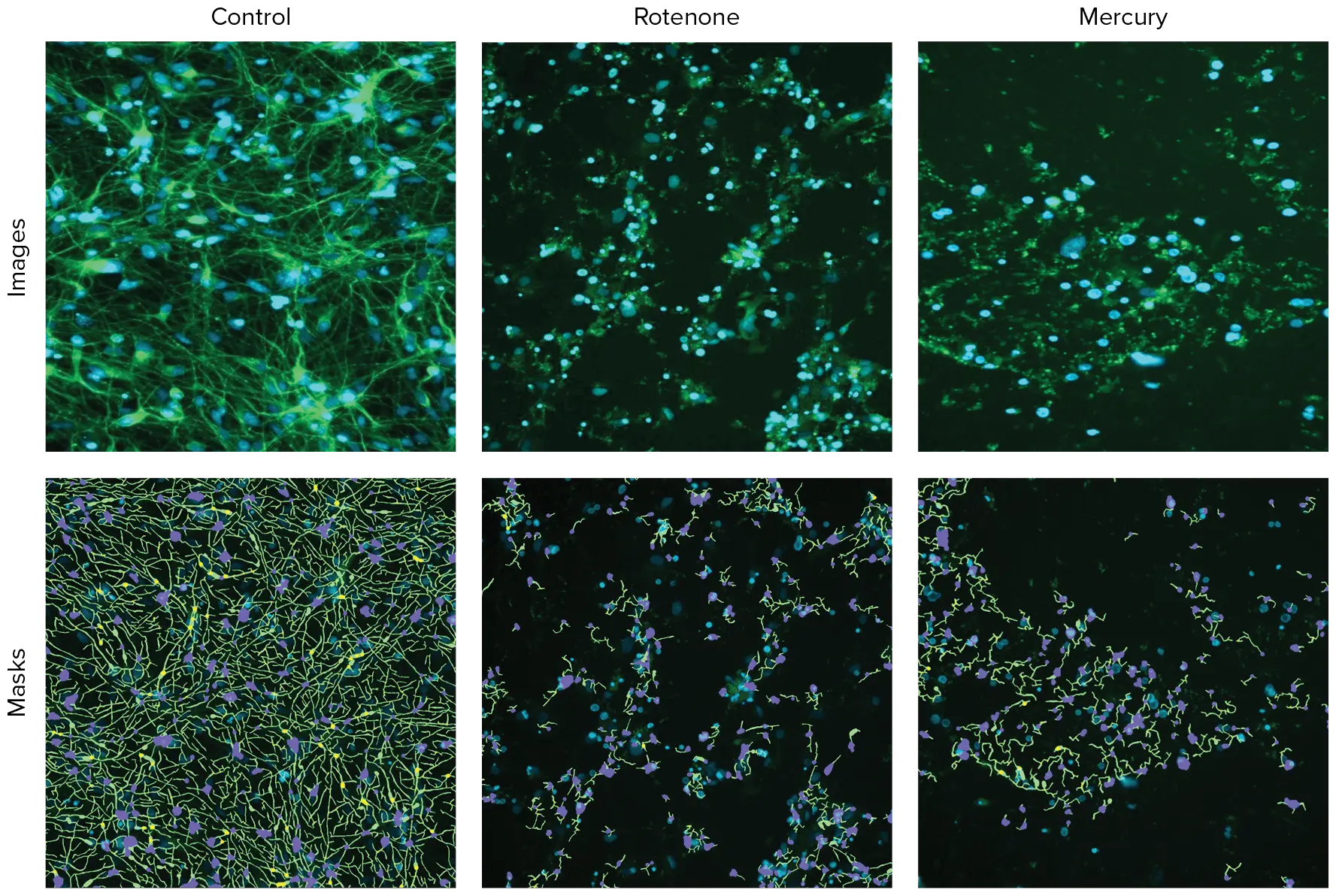
図1. ß-チューブリン(緑)で染色されたニューロンの代表的な画像と、CellReporterXpressソフトウェアによる解析トレースを示します。コントロールおよび化合物処理細胞の画像です XCellニューロンは化合物で3日間処理され、その後AF488結合抗ß-チューブリン(TUJ-1)抗体(1:100)で固定・染色しました。画像はImageXpress Picoシステムを用い、10X Plan Fluor対物レンズおよびFITCとDAPIチャンネルで撮影しました。画像はNeurite Tracing解析プロトコールを使用して処理しました。解析マスクは、神経突起(緑)、細胞体(青)、分岐点(ピンク)を示します。
結果
化合物処理により、神経突起ネットワーク形成の濃度依存的な阻害が観察されました(図2)。これらの実験で取得した画像の定量解析には、培養ニューロンの形態的特徴および神経ネットワークの広がりと複雑性を評価するための複数のパラメータが含まれました。画像内の総細胞体数も定量化し、化合物による細胞毒性の推定に使用しました。細胞播種および神経突起伸長は実験全体で非常に一貫して均一であったため、統計解析には画像あたりの総ニューロン数を使用しました。細胞あたりの伸長長やプロセス数、分岐数も測定しましたが、冗長性のため統計解析には使用しませんでした。化合物の毒性効果は、神経突起伸長、分岐数、プロセス数、または生細胞数に基づく4パラメータカーブフィットから導出されたEC₅₀値(神経突起伸長を50%阻害する化合物濃度)で比較できます。図2は、さまざまな化合物(1 μM濃度)における総神経突起ネットワーク長(総伸長)の濃度依存曲線を示し、神経毒性の可能性を評価し、さらなる毒性評価の優先順位付けに役立てます。図3および図4は、10 μM濃度で試験された神経毒性化合物を示します。
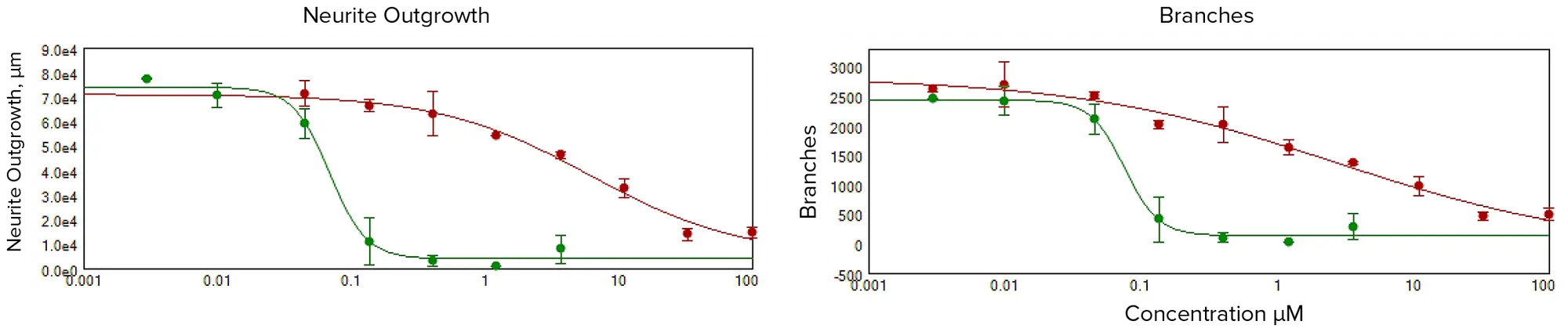
図2. 神経突起ネットワークの破壊は、指定された化合物を1 μMで処理したニューロンで測定しました EC₅₀値は総伸長の減少に基づき、ロテノンで6 μM、メチル水銀で0.07 μMでした。分岐点の減少に基づくEC₅₀値は、ロテノンで3 μM、メチル水銀で0.07 μMでした。
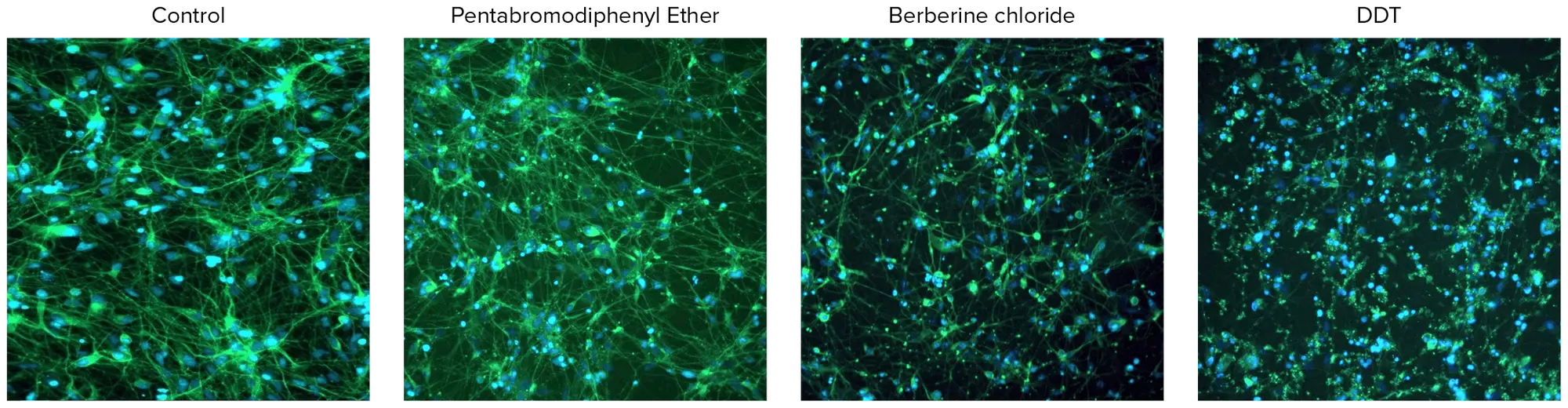
図3. 10 μM濃度で試験された神経毒性化合物の画像
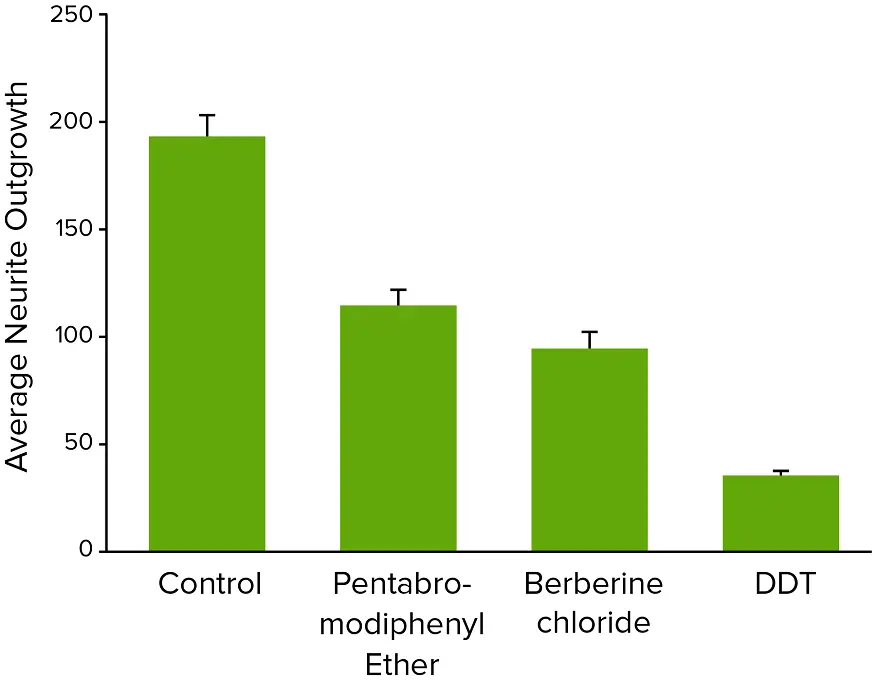
図4. 10 μM濃度で試験された神経毒性化合物の平均神経突起伸長
結論
このアッセイは、神経突起伸長のさまざまな調節因子やin vitroでの神経毒性効果の研究に有用です。
参考文献
- Harrill, J.A., Robinette, B.L., Freudenrich, T., Mundy, W.R., 2013. Use of high content image analyses to detect chemical-mediated effects on neurite sub-populations in primary rat cortical neurons. Neurotoxicology 34, 61–73.
- Sanes, D.H., Reh, T.A., Harris, W.A., 2006. Development of the Nervous System. Elsevier Academic Press, Burlington, MA.
- Radio, N.M., Breier, J.M., Reif, D.M., Judson, R.S., Martin, M., Houck, K.A., et al., 2015. Use of neural models of proliferation and neurite outgrowth to screen environmental chemicals in the ToxCast Phase 1 library. Appl. In Vitro Toxicol. 1 (2), 131–139.
- Stiegler, N.V., Krug, A.K., Matt, F., Leist, M., 2011. Assessment of chemical-induced impairment of human neurite outgrowth by multiparametric live cell imaging in high-density cultures. Toxicol. Sci. 121, 73–87
PDF版(英語)