Application Note HTRF IP-One Gq Assay(Gqシグナル測定)を
SpectraMaxマイクロプレートリーダーで実施
- 認証済みHTRF互換性による確かな装置性能
- 高感度かつ広いダイナミックレンジ
- HTSに適した機能的アッセイのための強力なプラットフォーム
PDF版(英語)
Caroline Cardonnel|シニアアプリケーションサイエンティスト|モレキュラーデバイス
はじめに
HTRF®は、Cisbio Bioassays社によって開発された多用途な技術であり、生体分子間相互作用の検出に使用されます *1。この技術は、蛍光共鳴エネルギー移動(FRET)と時間分解型(TR)蛍光測定を組み合わせることで、短寿命のバックグラウンド蛍光を除去することが可能です。このアッセイでは、ドナーとしてユーロピウムクリプテート(Eu³⁺)またはテルビウム(Lumi4™-Tb)クリプテートを使用し、アクセプター蛍光体としてXL665または低分子のd2を使用します。ドナーとアクセプターが十分に近接している場合、ドナーがエネルギー源(例:フラッシュランプ)によって励起されることで、アクセプターへエネルギーが移動し、特定の波長で蛍光を発します。
本資料では、SpectraMax® i3xおよびSpectraMax® iD5マルチモードプレートリーダーを用いて、HTRF技術によるGqカップリング受容体アッセイを実施する方法をご紹介します。Gタンパク質共役型受容体(GPCR)は、主にcAMPの調節とIP₃を介した細胞内カルシウム濃度の上昇という2つの経路を通じてシグナル伝達を行います。Cisbio社のIP-One Gqキットは、カルシウムフラックスアッセイに代わる手法として、IP₃の安定な下流代謝産物である**イノシトール一リン酸(IP₁)**の蓄積を検出することを可能にします(図1参照)。
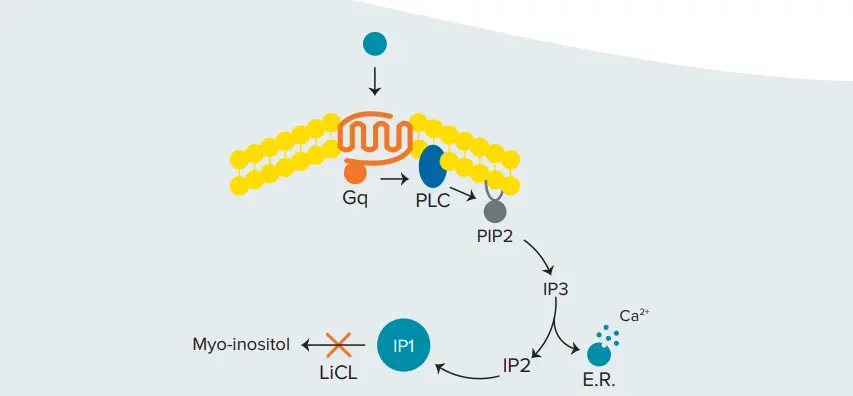
図1. Gq経路の活性化 IP₃の下流代謝産物であるIP₁は、塩化リチウム(LiCl)の存在下で分解が阻害され、シグナル伝達を行う細胞内に蓄積します(図1)。
HTRF IP-Oneアッセイの原理 IP-One HTRFアッセイでは、d2アクセプターで標識されたIP₁が、細胞によって産生された未標識のIP₁と競合しながら、クリプテートドナーで標識されたIP₁特異的モノクローナル抗体に結合します。細胞による未標識IP₁の産生量が増加すると、TR-FRETが阻害され、HTRFシグナルが減少します(図2) *2。このIP-Oneアッセイは、接着細胞および浮遊細胞のいずれにおいても、Gqカップリング受容体に作用する化合物の特性評価に使用することができます。
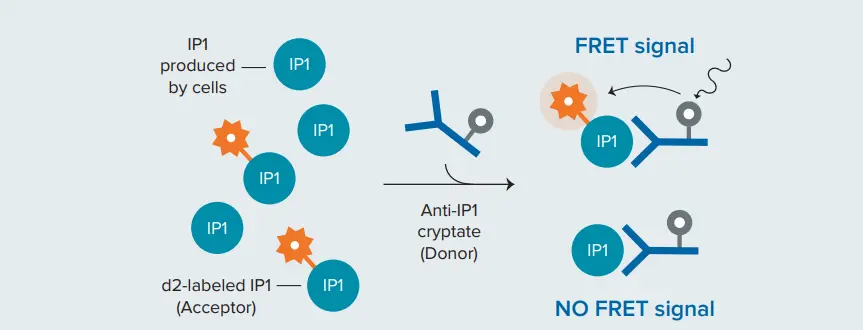
図2. HTRF IP-One競合結合アッセイの原理 d2アクセプターで標識されたIP₁は、細胞によって産生された未標識のIP₁と競合しながら、ドナーで標識されたIP₁特異的モノクローナル抗体に結合します。未標識IP₁の量が増加すると、TR-FRETが阻害され、HTRFシグナルが減少します。
材料
- IP-One Gqキット、1000テスト(Cisbio)
- iCell ® Neurons(Cellular Dynamics International)
- SpectraMax i3x マルチモードマイクロプレートリーダー(モレキュラーデバイス)
- HTRF検出カートリッジ(モレキュラーデバイス)
- SpectraMax iD5 マルチモードマイクロプレートリーダー(モレキュラーデバイス)
- HTRF Detection System(モレキュラーデバイス #6590-0144;Enhanced TRF module, Filter Slide 2ヶ、TRF Ex 340nm, TRF Em 520, 616 and 665nm)
方法
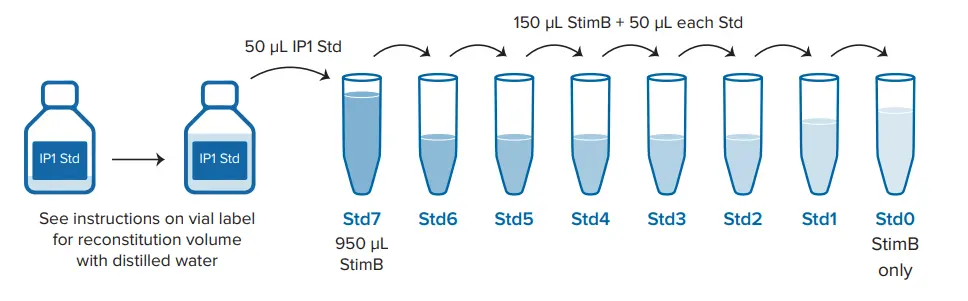
IP₁標準液は、アッセイ製品の添付文書に記載された手順に従い、最終濃度が1.9 nMから7700 nMとなるように調製しました *3。陽性対照(未標識IP₁を含まない、最大FRETシグナル)および陰性対照(IP₁および抗IP₁-d2抗体を含まない)も含めて実施しました。試薬は、図3に示すように各ウェルあたり最終容量20 μLとなるように分注しました。プレートは室温で1時間インキュベートした後、SpectraMax i3xおよびSpectraMax iD5プレートリーダーを用いて、表1に示す最適化された設定で測定を行いました。
| 標準 | 溶液 | IP1 作業溶液 nM | IP1 最終濃度 nM |
|---|---|---|---|
| Std7 | 50 µL IP1 Std 再構成 + 950 µL StimB | 11000 | 7700 |
| Std6 | 50 µL Std7 + 150 µL StimB | 2750 | 1925 |
| Std5 | 50 µL Std6 + 150 µL StimB | 688 | 481.6 |
| Std4 | 50 µL Std5 + 150 µL StimB | 172 | 120.4 |
| Std3 | 50 µL Std4 + 150 µL StimB | 43 | 30.1 |
| Std2 | 50 µL Std3 + 150 µL StimB | 11 | 7.7 |
| Std1 | 50 µL Std2 + 150 µL StimB | 2.7 | 1.9 |
| Std0 |
150 µL StimB |
0 | 0 |
*StimBの希釈方法 StimBは、5X濃度から1X濃度に希釈する必要があります(例:StimB 5Xを1体積、蒸留水を4体積加えます)。
図3. 384ウェル低容量プレートにおけるアッセイのセットアップ 「StimB」は、IP-One Gqキットに含まれる**刺激バッファー(Stimulation Buffer)**です。
| SpectraMax i3x | SpectraMax iD5 | |
|---|---|---|
| Tbドナー/レッドアクセプター | Tbドナー/レッドアクセプター | |
| 必要なコンポーネント | HTRF検出カートリッジ | HTRF検出システム |
| 励起 | 340 nm | 340/70 nm |
| 発光 |
ドナー: 620 nm アクセプター: 665nm |
ドナー:616/10 nm アクセプター: 665/10 nm |
| フラッシュ数 | 30 | 30 |
| 積分遅延 | 30 µs | 20 µs |
| 積分時間 | 400 µs | 200 µs |
| その他 | アッセイを初めて実行する場合、および新しいロットのプレートや異なるアッセイ容量を使用する場合は、その他のマイクロプレート最適化および読み取り高さの調整を実行します(SoftMax® ProソフトウェアのSettings > More Settings > Show Pre-Read Optimization Options(設定 > その他の設定 > 読み取り前最適化オプションの表示))。 | |
表1. SpectraMax i3xおよびiD5プレートリーダーの測定設定 これらの設定は、IP-One Gqアッセイに最適化されたものであり、他のHTRFアッセイで使用される設定とは若干異なる場合があります。
測定設定の最適化 設定を最適化するために、ディレイ時間、積分時間、およびパルス数を調整し、Delta F%(下記「データ解析」参照)が顕著に増加するまで検討を行いました。表1に示された最適化済みの設定は、同一モデルのプレートリーダーであれば転送可能です。つまり、SpectraMax® iD5プレートリーダー用に記載された設定は、他のSpectraMax® iD5でも使用できます。ただし、新しいプレートタイプ、プレートのロット、または試薬量を変更する場合には、マイクロプレートの最適化および読み取り高さの調整を必ず実施する必要があります。これにより、プレートリーダーの光学系がアッセイプレートに正しく合わせられ、誤差を最小限に抑えつつ、アッセイの感度とダイナミックレンジを最適化することができます。
データ解析
HTRFアッセイの解析には、Cisbio社が特許を取得している**比率的還元法(ratiometric reduction method)**が用いられます。この手法は、検出される2つの蛍光波長に基づいています。616 nmのドナー蛍光は内部参照として使用され、665 nmのアクセプター蛍光はアッセイ対象となる生物学的反応の指標として使用されます。この比率測定により、ウェル間のばらつきが軽減され、化合物による干渉も排除されます。以下のステップ4で計算されるDelta Fは、アッセイのシグナルとバックグラウンドの比率を反映しており、アッセイ間の比較に有用です。結果は、665 nm / 616 nmの比率から算出され、以下のようにDelta Fとして表されます:
\( \text{1. Ratio} = \frac{\text{Emission}_{665\ \text{nm}}}{\text{Emission}_{616\ \text{nm}}} \times 10^4 \)
\( \text{2. Mean Ratio} = \frac{\sum \text{ratios}}{2} \)
\( \text{3. CV} = \frac{\text{Std deviation}}{\text{Mean ratio}} \times 100 \)
\( \text{4. Delta F} = \frac{\text{Standard or sample ratio} - \text{Ratio}_{neg}}{\text{Ratio}_{neg}} \times 100 \)
(\( \text{Ratio}_{neg} = \text{Ratio of negative control} \))
データは、SoftMax® Pro ソフトウェアを用いて取得および解析されました。同ソフトウェアには、上記の手法による検出と解析を容易にするためのHTRF用事前設定済みプロトコールが含まれています。
結果
SpectraMax i3xおよびiD5プレートリーダーの標準曲線は、SoftMax Pro ソフトウェアを用いて作成され、4パラメータカーブフィットを適用して描画されました(図4)。その結果は表2にまとめられています。アッセイの適合性はEC₅₀値を用いて評価され、150 nM未満であることが求められます。両プレートリーダーにおいて、EC₅₀値は85 nM未満であり、許容範囲内に十分収まっていました。Cisbioでは、許容されるシグナル/ノイズ比を20以上と定義しており、両プレートリーダーはこの基準を満たしています。これらの結果に加え、すべての標準品においてCV値が6%未満であったことから、SpectraMax i3xおよびSpectraMax iD5プレートリーダーは、IP-Oneアッセイに対して高い感度と広いダイナミックレンジを示すことが確認されました。
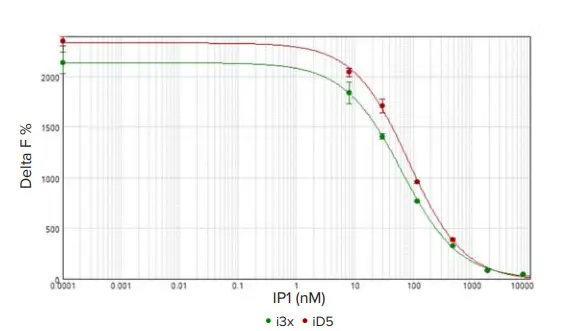
図4. HTRF IP 標準曲線。SpectraMax i3x(緑の円)およびSpectraMax iD5(赤の円)プレートリーダーで測定されたHTRF IP1標準曲線を示しています。SpectraMax iD5のアッセイウィンドウはやや広い傾向が見られましたが、両プレートリーダーともにアッセイの品質は非常に高く(CV < 6%)、優れた結果が得られました。
| パラメータ | 合格 | SpectraMaxi3x |
SpectraMaxiD5 |
|---|---|---|---|
| EC₅₀ | ≤ 150nM | 63.1 nM | 84.1 nM |
| SN比 | ≥ 20 | 22.4 | 24.5 |
表2. HTRF IP1標準曲線の結果サマリー。
結論
SpectraMax i3xおよびiD5プレートリーダーには、それぞれHTRF認証済みの検出用カートリッジまたはHTRF認証済みの検出システムを搭載することが可能です。両プレートリーダーは、Cisbioの受け入れ基準に従ってIP1濃度を検出できることが確認されました。SoftMax Pro ソフトウェアにはHTRF用の事前設定済みプロトコールが含まれており、データの取得と解析を簡便に行うことができます。
参考文献
- http://www.htrf.com/htrf-technology
- Garbison KE, Heinz BA, Lajiness ME. IP-3/IP-1 Assays. 2012 May 1. In: Sittampalam GS, Grossman A, Brimacombe K, et al., editors. Assay Guidance Manual.
- https://www.cisbio.eu/media/asset/c/i/cisbio\\_dd\\_pi\\_62ipapeb-62ipapec-62ipapej.pdf
PDF版(英語)