Application Note SpectraMax DuoLuc Reporterアッセイキットによる
高感度デュアルルシフェラーゼ検出
- 1ウェルあたり10細胞以下でのFireflyおよびRenillaルシフェラーゼ発現の検出
- レポーター発現をコントロールに対して正規化することで、測定結果の精度を高めます
- SoftMax Proの設定済みプロトコールにより、迅速なデータ解析が可能
PDF版(英語)
はじめに
ホタルルシフェラーゼは、遺伝子の制御と機能を研究するために広く使われているレポーターです。哺乳類の細胞や組織には内因性のルシフェラーゼ活性がないため、非常に感度の高いレポーターです。ホタルルシフェラーゼは62kDaのタンパク質であり、単量体として活性を持ち、活性のための後の処理は不要です。D-ルシフェリンのATP依存的酸化を触媒し、その結果発光します(図1A)。ウミシダ類Renilla由来のルシフェラーゼは、トランスフェクション効率を正規化し、遺伝子制御と機能を研究するための第二のレポーターとして、多重ルシフェラーゼアッセイでしばしば使用されます。Renillaルシフェラーゼは、酸素によるコエレテラジン酸化を触媒して光を生成します(図1B)。
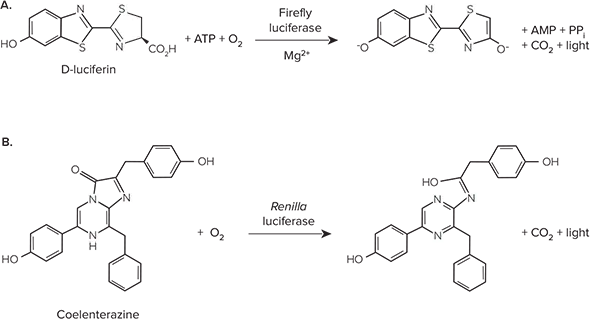
図1. (A)ホタルルシフェラーゼと(B)レニラルシフェラーゼが触媒する生物発光反応。
SpectraMax® DuoLuc™ リポーターアッセイキットは、哺乳動物細胞中のホタルおよびRenillaのルシフェラーゼを高感度に定量することができます。最適化された2種類の検出試薬を連続注入することにより、同じマイクロプレートウェル内でルシフェラーゼをアッセイすることができます。ホタルの作用液をインジェクションで自動添加すると、ホタルルシフェラーゼの発光反応が開始され、その後2回目のインジェクションでRenillaの作用液を添加すると、ホタルの発光が消光され、Aquaphile™ コエンテラジンが添加されてRenillaの反応が開始されます。その結果、2シグナルアッセイシステムとなり、コントロールに対する実験シグナルの標準化が可能となります。このアッセイはSpectraMax® i3x マルチモードマイクロプレートリーダー with Injector Cartridge and SmartInject™との使用に最適です。
材料
- SpectraMax DuoLuc Reporterアッセイキット(モレキュラーデバイス、カタログ番号R8361)
- HeLa細胞 (ATCC)
- pGL4.13[luc2/SV40] ホタルルシフェラーゼ発現ベクター (Promega)
- pGL4.75[hRluc/CMV]Renillaルシフェラーゼ発現ベクター (Promega)
- ViaFect™ Transfection Reagent (プロメガ社)
- Opti-MEM 還元血清培地(サーモフィッシャーサイエンティフィック)
- SpectraMax i3x マルチモードマイクロプレートリーダー
◦SmartInject付きSpectraMaxインジェクターカートリッジ
方法
細胞トランスフェクション
HeLa細胞を6ウェル組織培養処理プレートに1ウェルあたり2x105細胞で播種し、トランスフェクションの前に37℃/5% CO2で24時間インキュベートしました。pGL4.13[luc2/SV40]ホタルルシフェラーゼ発現ベクターをOptiMEM培地で1μg/μLに希釈し、pGL4.75[hRluc/CMV]Renillaルシフェラーゼ発現ベクターを100ng/μLに希釈しました。3本のチューブを以下のようにセットし、穏やかに混合しました: 400μLのOpti-MEM培地+2μL(2μg)のpGL4.13[luc2/SV40]ホタルルシフェラーゼ発現ベクター+2μL(2ng)のpGL4.75[hRluc/CMV]Renillaルシフェラーゼ発現ベクター。各チューブに6μLのViaFect試薬を加え、内容物を軽く叩いて混合しました。チューブを室温で10分間インキュベートし、複合体を形成させました。200µLのトランスフェクション複合体を6ウェルプレートの各ウェルに滴下し、軽く振り混ぜました。
細胞はトランスフェクション後48時間、37℃/5% CO2でインキュベートされ、その後アッセイのために採取されました。
細胞溶解物の調製
6ウェルプレートにトランスフェクトした細胞をトリプシン処理し、10個のアリコートに分け、1500rpmで5分間ペレット化し、PBSで1回洗浄しました。PBSを除去し、細胞ペレットをアッセイ時まで-80℃で保存しました。
アッセイ準備のため、Passive Lysis Bufferと細胞ペレットを室温に温め、各細胞ペレットを150μLのPassive Lysis Bufferで溶解しました。細胞溶解は室温で15分間行いました。その後、溶解液を Passive Lysis Buffer で 1:2 に連続希釈し、ウェルあたり 12~8700 個の細胞に相当する濃度の標準曲線を作成しました。各濃度の細胞溶解液20 µLを白色96ウェルプレートの3連ウェルにピペッティングしました。
ルシフェラーゼアッセイのセットアップ
キットの全成分を室温まで解凍しました。Firefly Substrateは、2.2mgの凍結乾燥基質を含むバイアルに220μLの水を加えて再構成しました。Aquaphile coelenterazineは、440 µgの凍結乾燥基質を含むバイアルに220 µLの水を加えて再構成しました。注:記載されている再構成量はExplorer Kitのものです。他のキットサイズについては、製品添付文書をご参照ください。
ホタル発光反応溶液は、ホタル基質をホタルアッセイ緩衝液で1:50に希釈して調製しました。レニラ作業溶液は、Aquaphile coelenterazineをRenillaアッセイ緩衝液で1:50に希釈して調製しました。96ウェルプレート1枚につき、220μLのそれぞれの基質を加えて11mLの作業溶液を作製しました。
SoftMax® Proソフトウェアであらかじめ設定されたSpectraMax DuoLucアッセイプロトコルを用いて、以下のパラメータでアッセイを実行し、結果を解析しました:
- インジェクター 1 を使用し、100 µL のホタルワーキング溶液をウェルに添加します。
- 2秒遅らせて反応を発現させます。
- 積分時間 5 秒でホタルの発光を測定します。
- インジェクター 2 を使用し、100 µL のRenilla作業溶液をウェルに添加します。
- 2秒間遅延させて反応を展開させます。
- 積算時間 5 秒でRenilla発光を測定します。
- 各アッセイウェルについて、1 回目の測定値(ホタルルシフェラーゼ)と 2 回目の測定値(Renillaルシフェラーゼ)の RLU 値を正規化します。
SpectraMax DuoLuc Reporterアッセイキットの性能を競合他社のデュアルルシフェラーゼレポーターアッセイと比較しました。
細胞溶解物の調製
6ウェルプレートにトランスフェクトした細胞をトリプシン処理し、10個のアリコートに分け、1500rpmで5分間ペレット化し、PBSで1回洗浄しました。PBSを除去し、細胞ペレットをアッセイ時まで-80℃で保存しました。
アッセイ準備のため、Passive Lysis Bufferと細胞ペレットを室温に温め、各細胞ペレットを150μLのPassive Lysis Bufferで溶解しました。細胞溶解は室温で15分間行いました。その後、溶解液を Passive Lysis Buffer で 1:2 に連続希釈し、ウェルあたり 12~8700 個の細胞に相当する濃度の標準曲線を作成しました。各濃度の細胞溶解液20 µLを白色96ウェルプレートの3連ウェルにピペッティングしました。
アッセイ性能
SpectraMax DuoLuc Reporterアッセイキットを用いた細胞サンプルの相対発光単位は、試験した全範囲においてサンプル濃度に直線的に比例し、得られた標準曲線のr2値は1.0でした(図2)。CV値はすべての反復測定で4%以下でした(n=3)。直線性の高いデータと低い%CV値の利点は、幅広い細胞反応におけるルシフェラーゼ発現の違いを正確に検出できることです。これにより、シグナル伝達、タンパク質間相互作用、その他多くの分野での科学的発見につながる、実験的細胞条件に対する小さな反応の同定が可能になります。
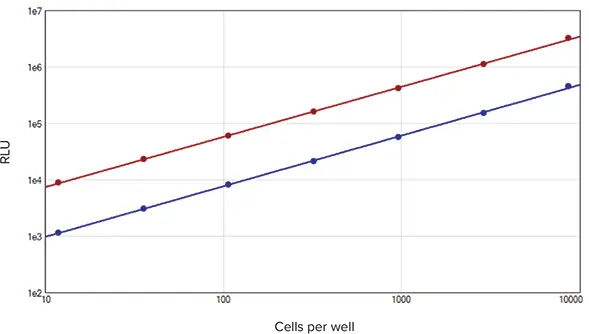
図2. セルベースアッセイstandard curve。
ホタル(red plot)とRenilla(blue plot)の標準曲線は、SoftMax Proソフトウェアのlog-log curve fit を用いてプロットしました(それぞれr2 = 1.0)。各細胞数でN=3反復。
SpectraMax DuoLuc Reporterアッセイキットを用いて得られたstandard curveは、競合他社のデュアルルシフェラーゼレポーターアッセイの標準曲線と同等です(図3)。低い%CV値、インジェクターチューブへの試薬の非吸収、Renilla基質添加時のホタルシグナルの適切な消光など、デュアルルシフェラーゼアッセイに使用される装置に要求される性能基準は、SpectraMax DuoLuc Reporterアッセイキットを使用したインジェクターカートリッジ付きSpectraMax i3xで実行されます(データは示されていません)。
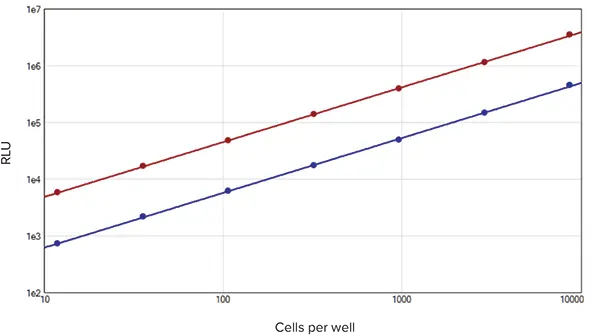
図3. 競合他社のデュアルルシフェラーゼレポーターアッセイのデータ。
RFU値および直線性は、SpectraMax DuoLucレポーターアッセイキットで示されたものと同等です。各細胞数でN=3反復。
SoftMax Proソフトウェアには、あらかじめ設定されたアッセイプロトコルが用意されており、各ウェルのホタル発光をレニラ発光で割ることにより、正規化されたルシフェラーゼ値を計算するという利点があります。結果はグループ表に表示され、結果の共有や発表のために簡単にグラフ化することができます。ここでテストした細胞溶解物の正規化値を図4に示す。これらは、今回アッセイした濃度範囲で一貫しており、ウェル内の細胞数が変動しても、アッセイ結果は一貫していることが実証されました。
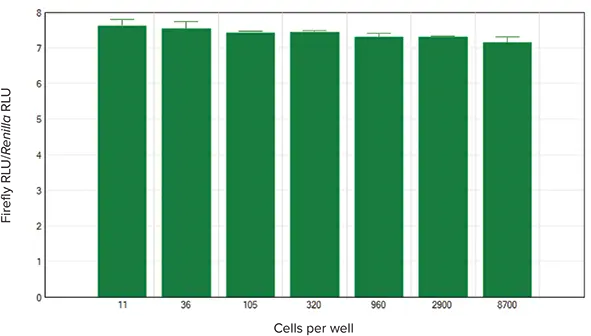
図4. 正規化ホタル発光単位対細胞濃度。
細胞濃度。SoftMax Proソフトウェアが自動的に計算し、ホタルルシフェラーゼの発光値をRenillaの値に対して正規化してグラフ化しました。各細胞数でN=3反復。
結論
SpectraMax DuoLuc Reporterアッセイは、インジェクターカートリッジ付きSpectraMax i3xリーダー上で性能が最適化されます。データ取得と解析を簡略化するための設定済みプロトコールと、SoftMax Proソフトウェアにより、高速、高感度、高信頼性のデュアルルシフェラーゼレポーターアッセイ結果を得るためのトータルソリューションが完成します。
参考文献
- Alam, J. and J.L. Cook. 1990. Anal. Biochem. 188:245-254.
- Bronstein, I., et al. 1994. Anal. Biochem. 219:169-181.
- Gould, S.J. and S. Subramani. 1988. Anal. Biochem. 175:5-13.
- Brasier, A.R., et al. 1989. BioTechniques. 7:1116- 1122
- Bhaumik, S., et. al. (2004) J Biomed Opt. 9, 578-86.
- Matijasevic, Z., et. al.(2001) Carcinogeneis. 22, 661-4.
- Nieuwenhuijsen BW., et.al. (2004) J Biomol Screen. 8, 676-84
- Matthews, J.C., Hori, K. and Cormier, M.J. (1977) Biochemistry 16, 85-91
PDF版(英語)