Application Note がん毒性評価のための高密度スキャフォールドフリースフェロイド
を用いた3D細胞培養のハイスループットスクリーニング
- 実験条件ごとのスフェロイド数を簡単に増加可能
- 多数のスフェロイドを同時に培養・染色・イメージング
- 複数のスフェロイドやオルガノイドを同時に3D解析できるハイコンテントイメージング
PDF版(英語)
Angeline Lim博士|アプリケーションサイエンティスト|モレキュラーデバイス
はじめに
がん研究における3Dスフェロイドモデルは、従来の2D培養モデルと比較して、in vivoの組織構造、遺伝子発現、代謝プロファイルをより忠実に再現できることから、注目を集めています *1*5*6。過去の研究では、3D培養がin vivo腫瘍の特徴である細胞間・細胞外マトリックス(ECM)との相互作用、薬剤の浸透性、用量反応性、薬剤耐性などを示すことが報告されています *7。スフェロイドは固形腫瘍と同様に、外側の細胞増殖ゾーン、中間層の静止細胞層、そして低酸素環境にさらされた内側の壊死コアから構成されており、これらの類似性から、3Dモデルを用いることで薬剤の安全性評価がより正確に行えるとともに、抗がん化合物の同定にもつながる可能性が示唆されています *4。
スフェロイド形成のために、さまざまな技術が開発されています。基本的に、これらの手法は細胞同士の接着を促進するために、細胞接着を抑制する表面や物理的な力を利用しています。たとえば、スピナーフラスコやNASAバイオリアクターシステムでは、容器表面への細胞の付着を防ぐために連続的な運動を加え、細胞間接着を促進します。磁気浮遊法では、酸化鉄ナノ粒子を含む細胞を磁場によって集め、スフェロイドを形成します。これらの方法は大量のスフェロイドを生成可能ですが、形状の均一性が低く、球状スフェロイドの割合も少ないことが課題とされています *2。ハンギングドロップ法では、培養皿の底から吊るした細胞懸濁液の液滴内でスフェロイドを形成し、その後、細胞培養プレートに移してアッセイを行います。しかし、自動化されていない場合、この手法は手間と時間がかかるため、小規模な研究に限られる傾向があります。
現在広く用いられている方法としては、低接着性材料でコーティングされた丸底(U-bottom)ウェルプレートを使用するスキャフォールドフリー法があります。この方法は比較的シンプルなワークフローで、ハイコンテントイメージングにも対応可能です。さらに、スフェロイドのサイズを容易に制御でき、均一性も高いという利点があります *2。過去の研究では、丸底プレートを用いたワークフローの最適化が進められており、アッセイ時間を短縮し、ばらつきを抑えるワンステップ染色プロトコールも開発されています *3。ただし、U-bottomプレートでは1ウェルにつき1つのスフェロイドしか形成できないため、データポイントを増やすには複数のウェルを使用する必要があり、試薬や化合物の使用量が増加し、スクリーニングコストが上昇するという課題もあります。
低接着性表面にパターン化されたマイクロウェルアレイは、均一なサイズのスフェロイドを多数形成するための有効な手法として注目されています。Corning® Elplasia®プレートは、標準的な培養プレート(6、24、96ウェル)内にマイクロキャビティを備えた設計となっており、各ウェルは超低接着性表面でコーティングされているため、スフェロイド形成が可能です。従来のU-bottomプレートでは1ウェルにつき1つのスフェロイドしか形成できませんが、Elplasiaプレートでは、96ウェルプレートの1ウェルあたり平均78個のスフェロイドを形成することができます。これにより、同一条件下で複数のスフェロイドを同時に培養・処理でき、データ出力を最大化することが可能です。さらに、この手法は腫瘍組織のクローン不均一性の研究や、遺伝子発現解析・メタボローム解析のための材料量の増加にも応用できます *5 *8。
本ページでは、Corning® Elplasia® 96ウェルプレートを用いた3D培養ワークフローをご紹介します。このワークフローには、スフェロイド形成、化合物処理、細胞毒性アッセイ、ImageXpress® Micro Confocal ハイコンテントイメージングシステムによる撮像、そしてMetaXpress® ハイコンテント画像取得・解析ソフトウェアによる3D画像解析が含まれます。複数のスフェロイドを容易に形成し、ハイコンテントイメージングとシームレスに統合できるこのワークフローは、創薬および化合物毒性評価において大きな可能性を秘めています。
方法
細胞培養
スフェロイド形成には、HCT116細胞株(ATCC)を使用しました。Elplasiaプレートは、メーカーのプロトコールに従って事前に湿潤処理を行い、適切に取り扱いました。細胞は、Elplasia 96ウェルプレートにMcCoy培地(10% FBS添加)100 µL中に5万個ずつ播種しました。スフェロイド形成のため、化合物処理前に37℃で24時間インキュベートしました。
スフェロイドの形成は、組織培養用顕微鏡で目視確認した後、以下の化合物を添加しました:シタラビン、ドキソルビシン(Dox)、エトポシド、スタウロスポリン、タキソール。各化合物は、コントロールを含む7段階の1:5希釈系列で、2ウェルずつ試験しました。スフェロイドは、化合物とともに合計6日間インキュベートし、3日目に新しい化合物を追加しました。
染色
ライブセル毒性アッセイには、以下の蛍光色素を最終濃度で混合した染色液を使用しました:Calcein AM(Life Technologies)3 µM、Ethidium Homodimer III(EthD-III)(モレキュラーデバイス)2 µM、Hoechst 33342(Life Technologies)33 µM。染色液は使用直前に調製し、各ウェルに10 µL添加しました。スフェロイドは37℃で2時間半インキュベートした後、撮像を行いました。
画像取得
画像は、ImageXpress® Micro Confocal ハイコンテントイメージングシステム(モレキュラーデバイス)を用いて10倍対物レンズで取得しました。共焦点ピンホールサイズは60 µmで、スフェロイドの体積の少なくとも半分をカバーするよう、5 µmステップで12枚の画像スタックを取得しました。
解析
3D画像解析は、MetaXpress®ソフトウェアのCustom Module Editorを使用して実施しました。解析では、Hoechst染色画像を用いて「Find Spherical Objects」アルゴリズムによりスフェロイドを認識しました。「Count Nuclei」モジュールにより、Hoechst染色に基づいて細胞数をカウントしました。 「Live/Dead」モジュールでは、死細胞(EthD陽性)と生細胞(Hoechst陽性かつEthD陰性)の数を定量しました。死細胞はHoechst染色が失われる可能性があるため、「Cell Scoring」モジュールを用いてすべてのEthD陽性細胞を認識しました。全てのプレーンにおける細胞、ライブ、デッドのオブジェクトマスクは、「Connect by Best Match」アルゴリズムにより3Dオブジェクトとして統合しました。用量反応解析は、SoftMax® Proソフトウェアを用いて4パラメータロジスティックカーブフィットで実施し、統計解析およびグラフ作成はMicrosoft Excelで行いました。
結果
従来のスキャフォールドフリー法では、超低接着性U-bottomプレートを用いて1ウェルにつき1つのスフェロイドを形成します。 データポイントを増やすには複数のウェルを使用する必要があり、手間がかかるうえにスクリーニングコストの増加につながります。Elplasia 96ウェルプレートでは、1ウェル内に最大78個のスフェロイドを形成することが可能です。各スフェロイドはマイクロウェル内に配置されており、サイズや形状の均一性が高く、再現性の向上につながります(図1)。さらに、これらのプレートはImageXpress®ハイコンテントイメージングシステムと互換性があり、使用するアッセイに応じてさまざまな生物学的リードアウトを取得することができます。
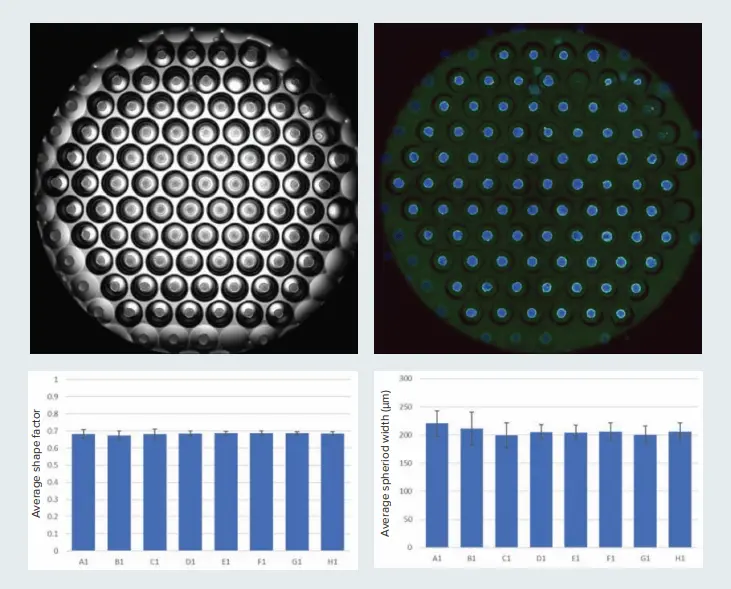
図1. Corning® Elplasia®プレートでは複数のスフェロイドを形成可能です。ここでは、Elplasia 96ウェルプレートの1ウェルの様子を示しています。画像は4倍対物レンズを使用し、4箇所を撮像後にステッチ処理を行いました。透過光画像と蛍光画像を表示しています。スフェロイドのサイズや形状のばらつきは、実験結果の再現性に影響を与えることがあります。そこで、スフェロイドの均一性を評価するために、直径と形状係数(円形度を示す指標で、1が完全な円を意味します)を測定しました。グラフには、8つのコントロールウェルから得られた平均形状係数および平均スフェロイド直径(標準誤差付き)を示しています。
スフェロイドは、異なる種類の抗がん化合物で6日間処理した後、細胞生存率を評価しました。染色には、Hoechst(核染色)、Calcein AM(生細胞)、EthD(死細胞)を使用しました(図2および図3)。スフェロイドへの影響を最小限に抑え、染色プロセスを簡略化するため、インキュベーション後も染色液はウェル内に残し、洗浄は行いませんでした。
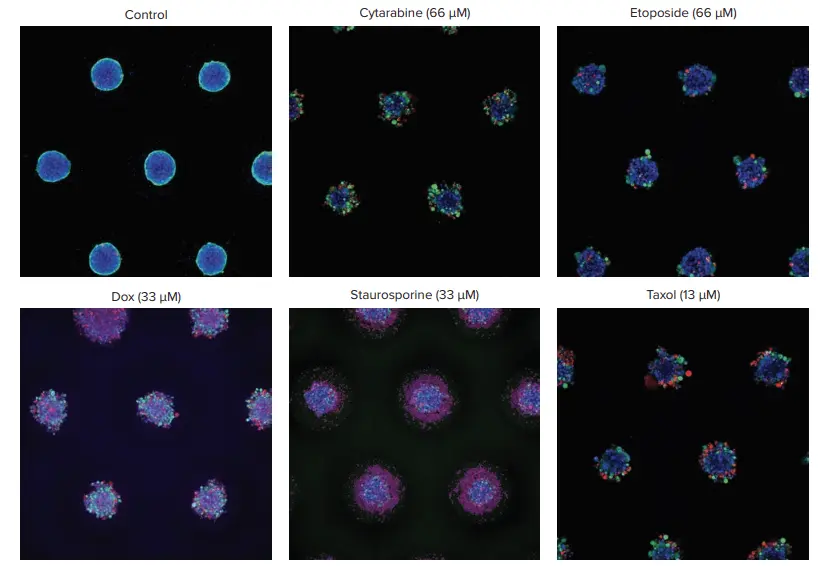
図2. コントロール群と処理群の代表的なスフェロイド画像 スフェロイドは、Hoechst(核:青)、Calcein AM(生細胞:緑)、EthD(死細胞:赤)で染色しました。画像は10倍対物レンズを使用し、Zスタック機能により取得した最大投影画像を示しています。処理群のスフェロイドでは、さまざまな表現型の変化が観察され、多くの場合、スフェロイドの緻密な構造が失われ、細胞が主スフェロイドから剥離する様子が確認されました。
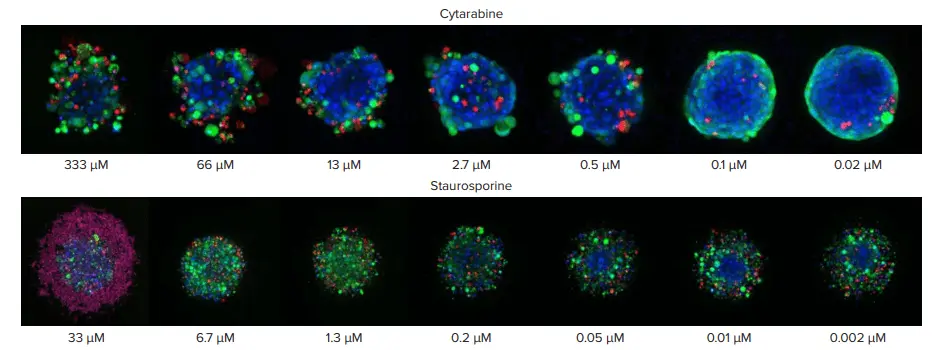
図3. シタラビンおよびスタウロスポリンによる濃度依存的なスフェロイド形態の変化 スフェロイドは、シタラビンおよびスタウロスポリンの異なる濃度で処理されました。両化合物に対するスフェロイド構造の反応には顕著な違いが見られます。シタラビン処理では、スフェロイドの構造が緩くなり、細胞がスフェロイドから剥離する様子が確認されました。一方、スタウロスポリン処理では、スフェロイドが分散し、扁平化した形態を示し、とくに高濃度では多数の死細胞が観察されました。
化合物処理による細胞生存率への影響を定量化するため、画像解析はMetaXpress®ソフトウェアのCustom Module Editor(CME)を用いた3D解析で実施しました。スフェロイドの直径、体積、死細胞および生細胞の数を測定しました。
化合物処理により、細胞毒性および細胞静止効果が観察されました。全体的に、すべての化合物で生細胞(EthD陰性)の数が減少し、特にスタウロスポリンおよびドキソルビシン処理では死細胞(EthD陽性)の数が増加し、細胞毒性効果が示されました。一方、タキソールおよびエトポシド処理では、総細胞数の減少が確認され、これらの化合物が今回の濃度条件下で主に細胞静止効果を示すことが明らかとなりました(図4Cおよび図4D)。
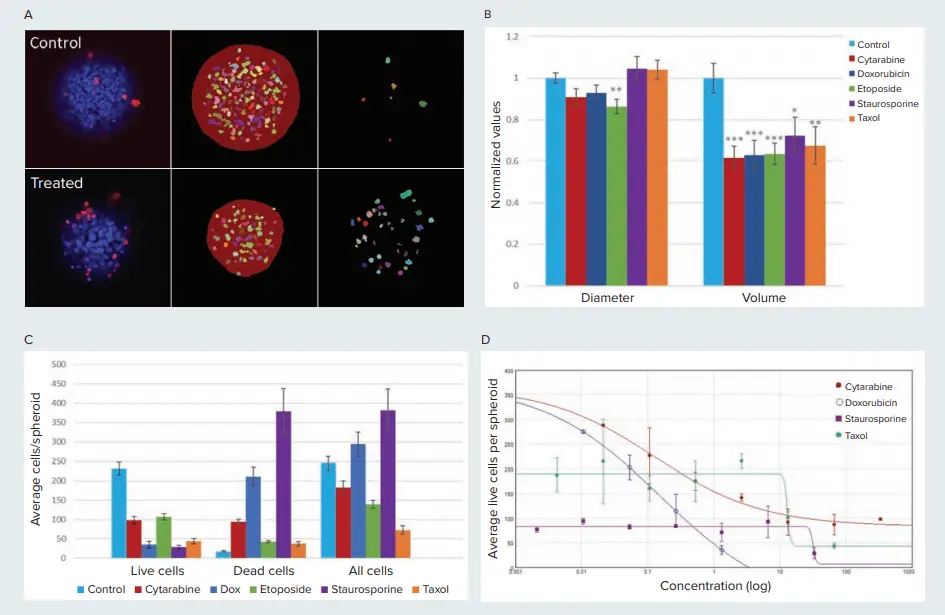
図4. コントロール群および化合物処理群におけるスフェロイドへの細胞毒性効果 A) コントロールおよびシタラビン処理(13.3 µM)スフェロイドの単一プレーンにおける画像解析マスクを示しています。中央の列はスフェロイドおよび生細胞(EthD陰性)のマスク、右列は死細胞(EthD陽性)のマスクです。 B) エトポシドを除き、処理群のスフェロイドは未処理群と比較して直径に有意な変化は見られませんでした。一方で、スフェロイドの体積は20~40%減少しました(*p<0.05、**p<0.01、***p<0.001)。使用化合物:シタラビン(333 µM)、ドキソルビシン(1.3 µM)、エトポシド(333 µM)、スタウロスポリン(33.3 µM)、タキソール(67 µM)。C) 化合物処理群では、平均してスフェロイドあたりの生細胞数が減少し、死細胞数が増加しました(p<0.001)。D) スフェロイドあたりの平均生細胞数を化合物濃度に対してプロットし、4パラメータロジスティックカーブフィットを適用しました。各化合物のEC値は以下の通りです:シタラビン = 0.128 µM、ドキソルビシン = 0.156 µM、スタウロスポリン = 31.78 µM、タキソール = 13 µM。スタウロスポリンおよびタキソールの高いEC値は、細胞毒性が現れる前に細胞静止効果が発現していることを示唆しています。
化合物処理による生細胞数の濃度依存的な減少がスフェロイドで確認されました。シタラビン、ドキソルビシン、スタウロスポリンによる処理では、生細胞数の濃度依存的な減少と、それに対応する死細胞数の増加が観察されました。タキソール処理では、スフェロイドサイズの縮小が見られたものの、生細胞数の減少は確認されず、細胞静止効果が示唆されました。高濃度(13.3 µM)では細胞毒性が現れ、生細胞数が3分の1に減少しました。
また、スフェロイドサイズへの影響を評価するため、直径と体積を測定しました(図4B)。興味深いことに、シタラビン、ドキソルビシン、スタウロスポリン、タキソール処理群では、コントロール群と比較して直径に有意な差は見られませんでしたが、体積は有意に減少しました。直径の変化がないにもかかわらず体積が減少していることは、スフェロイド構造が崩れ、3D形態が維持されなくなっていることを示唆しています。直径は2D解析で測定可能ですが、体積との違いは、化合物毒性の影響を評価する上で3D解析がより適していることを示しています。
スフェロイド内の生細胞数は、化合物による表現型変化の有効濃度を評価する指標として有用ですが、3D解析から得られるその他の情報(死細胞数、総細胞数、蛍光強度など)も、化合物の特異的な作用を理解する上で重要です。
結論
Corning® Elplasia® 96ウェルマイクロプレートを用いることで、複数のスフェロイドを容易に形成し、化合物処理・染色・撮像まで一連のワークフローを効率的に実施できます。ImageXpress® Micro Confocalシステムによる撮像と、MetaXpress®ソフトウェアを用いた3D画像解析により、化合物がスフェロイドに与える影響を定量的に評価することが可能です。このワークフローは、3D培養を用いた迅速な創薬スクリーニングのために最適化されており、再現性の高いデータ取得と多様な生物学的リードアウトに対応します。
参考文献
- Nath, S. & Devi, G. R. Three-dimensional culture systems in cancer research: Focus on tumor spheroid model. Pharmacol. Ther. 163, 94–108 (2016).
- Zanoni, M., Piccinini, F., Arienti, C. et al. 3D tumor spheroid models for in vitro therapeutic screening: a systematic approach to enhance the biological relevance of data obtained. Sci Rep 6, 19103 (2016).
- Sirenko O, Mitlo T, Hesley J, Luke S, Owens W, Cromwell EF. High-content assays for characterizing the viability and morphology of 3D cancer spheroid cultures. Assay Drug Dev Technol. 2015;13(7):402–414.
- Kimlin LC, Casagrande G, Virador VM. In vitro three-dimensional (3D) models in cancer research: an update. Mol Carcinog. 2013;52(3):167–182.
- Sakai Y, Yamagami S, Nakazawa K. Comparative analysis of gene expression in rat liver tissue and monolayer- and spheroid-cultured hepatocytes. Cells Tissues Organs. 2010;191(4):281–288.
- Santini MT, Rainaldi G, Romano R, et al. MG-63 human osteosarcoma cells grown in monolayer and as three-dimensional tumor spheroids present a different metabolic profile: a (1)H NMR study. FEBS Lett. 2004;557(1-3):148–154.
- Fischbach C, Chen R, Matsumoto T, et al. Engineering tumors with 3D scaffolds. Nat Methods. 2007;4(10):855–860.
- Greaves M, Maley CC. Clonal evolution in cancer. Nature. 2012;481(7381):306-313. Published 2012 Jan 18.
PDF版(英語)