Application Note ゼブラフィッシュを用いた
ハイスループットイメージング解析
- 数日間で数千種類の化合物を全身レベルで評価可能
- 多様な疾患モデルや毒性モデルをスクリーニング
- 1枚の画像で全身表現型を可視化・定量化
- 自動高速Zスタッキングにより頭部から尾部まで鮮明にイメージング
PDF版(英語)
なぜゼブラフィッシュのスクリーニングなのでしょうか?
近年、ゼブラフィッシュを用いたスクリーニングは、コスト効率、スループット、倫理的懸念の少なさから、哺乳類を用いたスクリーニングの代替手法として注目されています。ゼブラフィッシュはヒトとの生物学的類似性が高く、創薬研究において有用なモデルです。発生学や器官形成の研究により、主要な臓器系がヒトと非常に似ていることが示されており、ゼブラフィッシュとヒト(Homo sapiens)の遺伝子配列の相同性は70〜80%にも達します。
ゼブラフィッシュは、産卵数が多く、胚が透明で臓器構造の観察が容易であり、遺伝子操作も簡便であることから、スクリーニングアッセイに適しています。小型であるため、胚をマイクロタイタープレートに配置し、化合物処理を行うことが可能です。表現型はハイコンテントスクリーニングシステムで測定できます。
ImageXpress® ハイコンテントスクリーニングシステムは、広視野かつ高画質なイメージングに対応する柔軟性を備えています。MetaXpress® ハイコンテント画像取得・解析ソフトウェアは、シンプルなワークフローで幅広いアプリケーションに対応した画像解析を可能にし、AcuityXpress ハイコンテント情報解析ソフトウェアと組み合わせることで、ゼブラフィッシュを用いたin vivoスクリーニングのスループットを大幅に向上させるエンドツーエンドのソリューションを提供します。
ゼブラフィッシュを用いたin vivoハイコンテントスクリーニングアプリケーション
ゼブラフィッシュでは、以下のようなヒト疾患モデルが多数開発されています:
- 代謝症候群:肥満(内臓脂肪)、脂質異常症、脂肪肝、耐糖能異常
- ヒトがん細胞の異種移植:腫瘍血管新生、遠隔転移
- 循環器疾患:心不全、薬剤誘発性不整脈
- 中枢神経系疾患:難聴、視覚障害、嗅覚障害、てんかん、発達障害、睡眠覚醒障害、筋ジストロフィー(ALS)
これらの疾患の研究にハイコンテントイメージングアッセイがどのように利用できるか、いくつかの例をここに示します。

本アプリケーションノートに掲載されたデータは、三重大学大学院医学系研究科の田中利男教授より提供されたものです。
ヒトがん細胞の異種移植後の腫瘍転移モデル化 *1
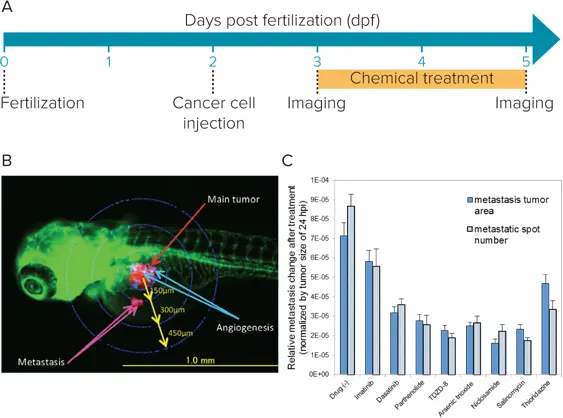
図1:(A)ゼブラフィッシュへのヒトがん細胞移植のワークフロー。(B)Kusabira-Orange(赤)で標識されたヒト白血病幹細胞をゼブラフィッシュ胚(緑)に移植した画像。(C)腫瘍サイズと転移の測定結果をグラフ化。化合物ごとの抑制レベルの違いが示されています
血管新生の抑制モニタリング
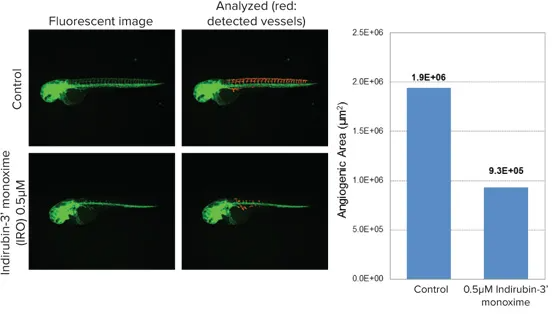
図2:血管内皮細胞にGFPを発現するゼブラフィッシュに化合物を12〜48時間曝露。主幹から伸びる細い背側・腹側血管(インターセグメンタル血管)を、MetaXpressソフトウェアの「Angiogenesis Tube Formation」モジュールで測定。化合物処理により血管新生の抑制が確認されました
心機能解析
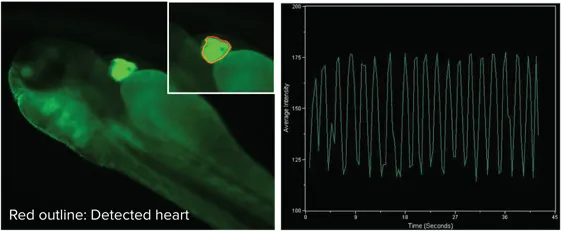
図3:心臓にGFPタグ付きタンパク質を発現するトランスジェニックゼブラフィッシュの心機能を解析。心臓を関心領域としてタイムラプスイメージングを行い、拍動に伴う面積や蛍光強度の変化を測定。MetaXpressにより時間経過に伴う強度変動が表示されます。
遺伝子ノックダウンの定量化 *2
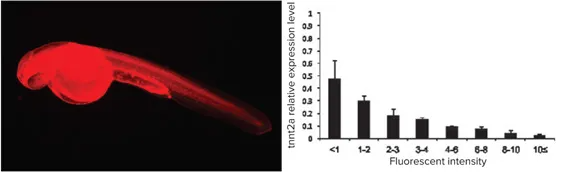
図4:Lissamine蛍光を用いて、モルフォリノアンチセンスオリゴヌクレオチド(MO)の注入量と遺伝子ノックダウンレベルの相関を解析
聴毒性の測定
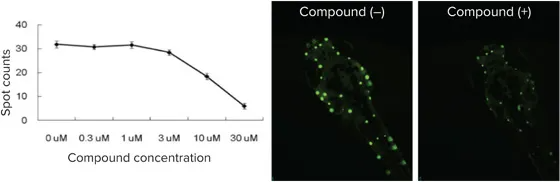
図5:ゼブラフィッシュの有毛細胞の破壊は聴毒性の指標として利用されます。聴毒性を示す既知の化合物で処理後、蛍光標識された有毛細胞をスポットカウントアルゴリズムで測定
神経毒性の評価
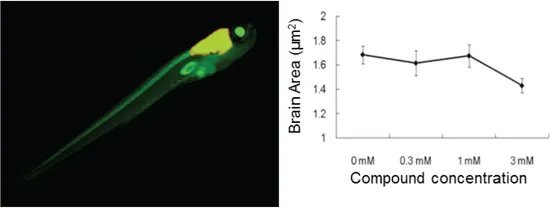
図6:蛍光標識されたニューロン(画像内の黄色)を持つゼブラフィッシュに神経毒性化合物を処理し、曝露によって影響を受けた脳領域を神経毒性の指標として測定。高濃度の化合物処理では、未処理の対照胚と比較して蛍光脳領域の面積が有意に小さくなりました。
ウェル内やゼブラフィッシュの特定領域のターゲットイメージング
ウェル内の対象物が毎回同じ位置にない場合、ターゲットイメージングを用いて低倍率で対象物を特定し、その座標に戻って高倍率でイメージングを行うことができます。
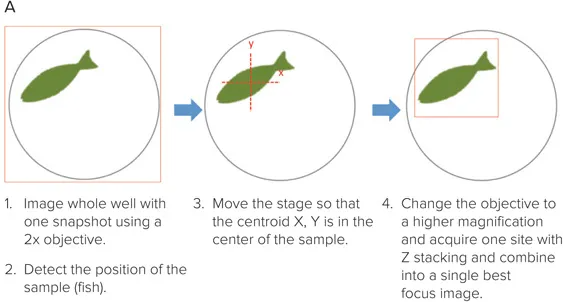

図7:1視野でゼブラフィッシュ全体をイメージング。(A)完全に焦点の合った画像を得るために、複数のZプレーンを取得し、ベストフォーカスアルゴリズムで合成。(B)関心領域(オレンジの枠)を高倍率で再取得。(C)Digital Confocal機能は、オンザフライでのデコンボリューション処理により、解像度を向上させ、細胞内構造のより正確なセグメンテーションを可能にします
概要
ゼブラフィッシュ胚は、トランスレーショナルリサーチにおける有用な脊椎動物モデルです。ImageXpress ハイコンテントスクリーニングシステムを用いて、広視野かつ高速Zスタッキングにより頭部から尾部まで焦点の合った画像を取得することで、疾患や毒性に関連する表現型を測定できます。ゼブラフィッシュのin vivoイメージングとMetaXpress ハイコンテント解析ソフトウェアを組み合わせることで、スループットを大幅に向上させ、数日間で数千種類の化合物をスクリーニングすることが可能になります。血管新生の抑制モニタリング、遺伝子ノックダウンの定量化、聴毒性や神経毒性の測定などを自動化されたイメージングスクリーニングで実施できる、エンドツーエンドのソリューションです。
参考文献
- Zhang, B., et al., Quantitative phenotyping-based in vivo chemical screening in a zebrafish model of leukemia stem cell xenotransplantation, PLoS One, 2014 Jan 15; 9(1).
- Umemoto, N., et al., Fluorescent-based methods for gene knockdown and functional cardiac imaging in zebrafish, Mol Biotechnol, 2013 Oct; 55(2): 131-42.
- Kanungo, J., et al., In vivo imaging and quantitative analysis of changes in axon length using transgenic zebrafish embryos. Neurotoxicol Teratol, 2011 Nov-Dec; 33(6): 618-23.
- Diekmann, H., et al., Characterization of optic nerve regeneration using transgenic zebrafish. Front Cell Neurosci, 2015 April 9; 9:118.
- Huan, H., et al., High-throughput screening for bioactive molecules using primary cell culture of transgenic zebrafish embryos. Cell Rep, 2012 Sep 27; 2(3):695-704.
PDF版(英語)