Application Note がん治療薬スクリーニングのための
スフェロイドに対するハイスループット共焦点イメージング
- 20倍の倍率で1つの視野内にスフェロイド全体をキャプチャ
- 96ウェルまたは384ウェルフォーマットで、生物学的に関連性の高い3Dスフェロイドをスクリーニング
- 共焦点イメージングを使用して、細胞応答を正確に検出
- Zプレーン画像の2D再構成のみを保存することで、ストレージ容量を節約
PDF版(英語)
自動化されたハイスループットハイコンテントイメージングによる3Dスフェロイドの迅速な取得と解析
in vivoの3D培養システムは、均一なサイズのヒトがん細胞スフェロイドを形成できる能力と、ハイスループットハイコンテントイメージングによってスフェロイドの薬剤応答をスクリーニングできる能力を備えており、化学療法薬候補のより関連性の高い試験を促進する上で重要なステップとなります。ImageXpress Micro ConfocalシステムとMetaXpressソフトウェアを使用することで、マイクロプレート内の3Dスフェロイドを迅速にイメージング・解析し、抗がん剤によるアポトーシス誘導やミトコンドリア毒性をモニタリングすることが可能です。
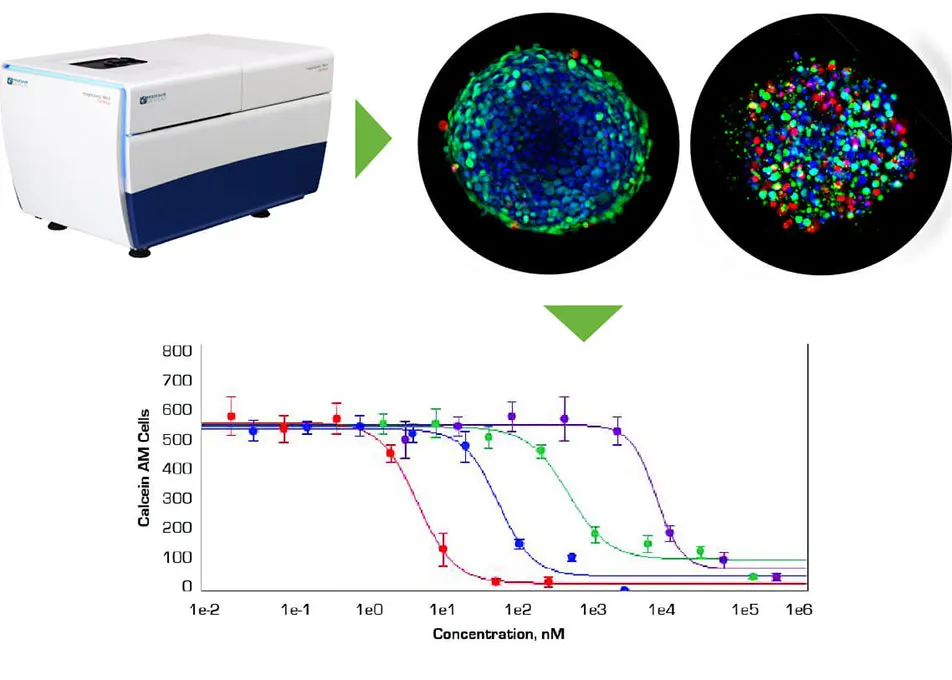
はじめに
近年、in vivoの組織環境をモデル化するための腫瘍細胞のin vitro凝集体の開発が大きく進展しています。低接着性の丸底マイクロプレートのウェルに播種すると、これらの凝集体は明確なスフェロイドを形成します。スフェロイドは、通常の2D細胞培養よりも腫瘍の挙動をより効果的に模倣すると考えられています。これは、腫瘍と同様に、表面に露出した細胞と深部に埋もれた細胞、増殖細胞と非増殖細胞、酸素が豊富な外層と低酸素状態の中心部を含んでいるためです。このような3Dスフェロイドモデルは、がん治療薬候補のスクリーニング環境で成功裏に使用されています。
- 各ウェル内のスフェロイドを正確に位置づけ、1つの視野でイメージングできるようにフォーカスすること
- 染色処理と化合物処理を最適化し、色素の浸透を確保しつつスフェロイドの位置を乱さないようにすること
- 3D構造全体にわたって代表的な画像を取得し、イメージングプレーンの上下からのピント外れやバックグラウンド信号を最小限に抑えること
- 画像を迅速に解析し、有意義な結果を得て結論を導き出すこと
スフェロイドの形成と処理
がん細胞株 HCT116、DU145、HepG2 を用いて、以下の方法でスフェロイドを形成しました。細胞は37°C、5% CO₂の条件下でフラスコ内で培養した後、剥離して96ウェルまたは384ウェルの黒色プレート(それぞれCorning 4520および3830)に播種しました。ウェルは透明な丸底で、適切な培地に胎牛血清(FBS)を添加し、1ウェルあたり1000~1500細胞の密度で播種しました。24時間以内に各ウェルの底部に単一のスフェロイドが形成され、37°C、5% CO₂の条件下で2~4日間培養後、実験に使用しました(図1)。スフェロイドはさらに長期間培養することも可能ですが、サイズの増加により染色の浸透や中心部の細胞のイメージングが困難になる可能性があります。本アプリケーションノートでは、抗がん剤エトポシド、パクリタキセル、マイトマイシンCの影響を評価するために使用したアッセイについて説明します。スフェロイド処理は、化合物を10倍濃度でウェルに添加し、研究対象のメカニズムに応じて1~4日間インキュベートすることで開始しました。アポトーシスの研究には短時間の処理を、細胞毒性の多パラメータ解析には長時間の処理を行いました。2日を超える薬剤処理では、化合物を1倍濃度で2日ごとに新しく追加しました。
スフェロイドの染色とイメージング
ここで紹介する例は、ウェル内のスフェロイド形態変化およびアポトーシス細胞の発生を評価するために開発されたHCT116スフェロイドアッセイに基づいています。化合物処理後、染色試薬を4~6倍濃度のカクテルとして混合し、ウェル内の培地に直接添加しました。スフェロイドを乱さないよう、洗浄不要の染色試薬を選択しました。
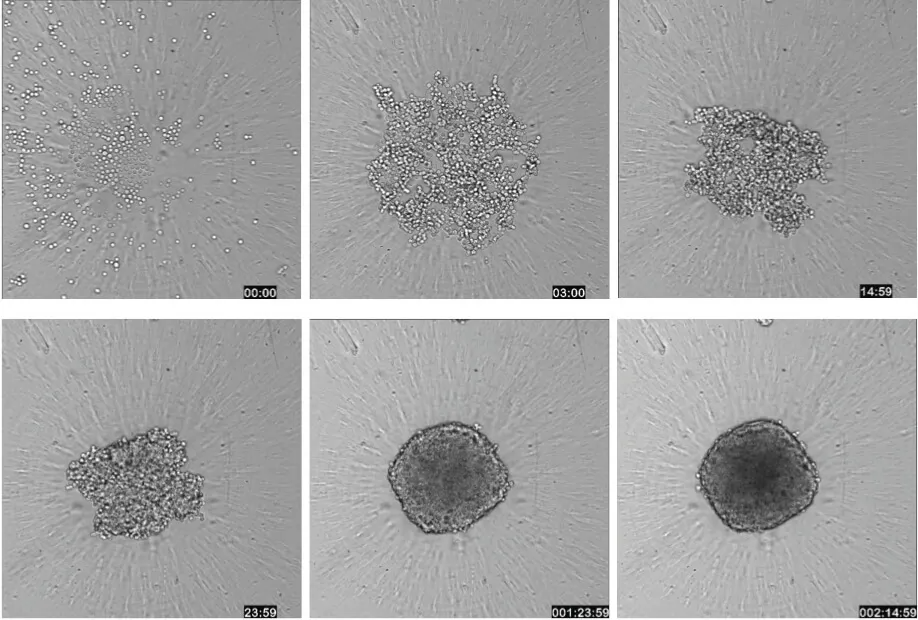
図1: ハイスループットスクリーニング環境におけるスフェロイド試験のワークフロー 96ウェルまたは384ウェルプレートで単一のスフェロイドを培養し、化合物処理後、洗浄不要の染色カクテルで染色してイメージングできます。必要に応じてスフェロイドを固定することも可能です。(右)ImageXpress Micro Confocalシステムのタイムラプス取得機能を用いて、HCT116細胞のスフェロイド形成過程を63時間にわたり撮影した透過光画像(10倍対物レンズ)。
スフェロイドは、ImageXpress® Micro Confocal ハイコンテントイメージングシステムを用いて10倍または20倍の倍率で観察しました。3D構造全体にわたる細胞応答を解析するため、スフェロイド内部の異なる深さから画像を取得し、「スタック画像」を作成しました。このスタック画像は、数学的アルゴリズムを用いて単一の2D投影画像に「コラプス(統合)」されました。この場合、MetaXpress® ハイコンテント画像取得・解析ソフトウェアの「最大投影」アルゴリズムを使用して、スタック内で最も明るいピクセルを保持し、投影画像を生成しました(図2)。

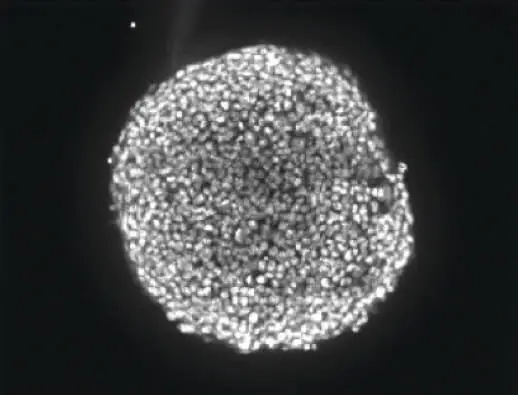
図2: 共焦点画像のスタックは、スフェロイドの深さの約半分にわたるZプレーンで取得されました(左)。任意のプレーンではスフェロイドの一部の細胞しか焦点が合っていないため、解析を容易にするために、焦点の合った領域を統合した2D画像にコラプスしました(右)。
ImageXpress Confocalシステムによる高精度なセグメンテーション
共焦点光学系は、広視野光学系よりも薄い光学断面をイメージングできるため、取得プレーンの上下にある蛍光発光物質によるバックグラウンドのかすみを大幅に低減できます。また、細胞間や細胞内の微細構造をより高解像度で観察でき、3D構造内で密集・積層した細胞の分離にも優れています。共焦点画像を用いることで、より正確なセグメンテーションが可能になります。スフェロイドを用いた繰り返し実験では、広視野画像による核のセグメンテーションでは、共焦点画像と比較して約20%少ない核数がカウントされました(図3)。
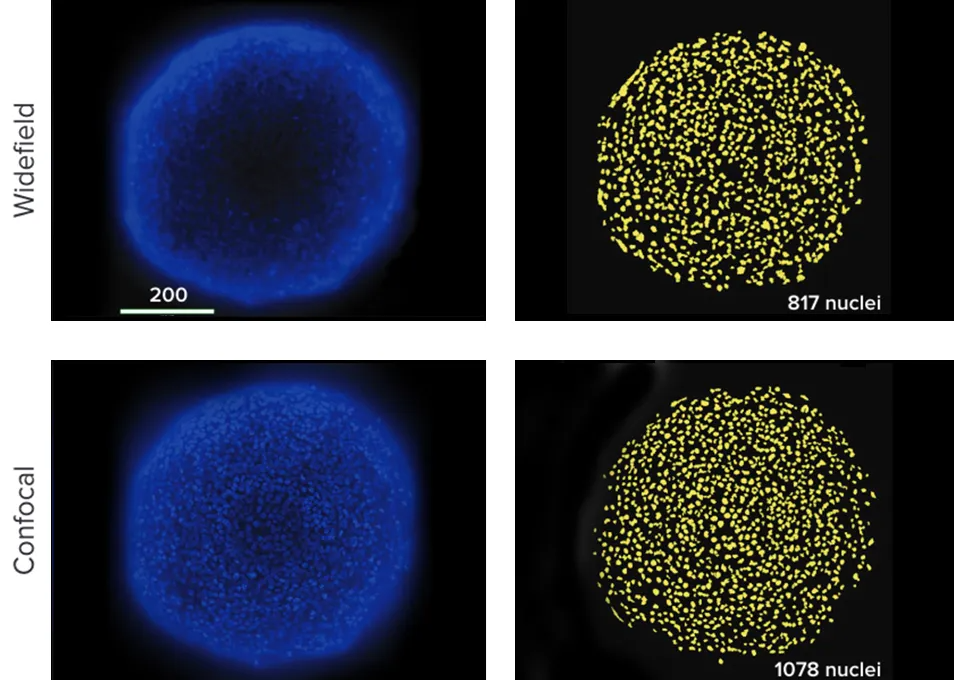
図3:(上)広視野光学系で取得したHCT116スフェロイドの15枚の画像から作成した最適焦点投影画像。ソフトウェアによるセグメンテーションでは817個の核がカウントされました。スフェロイドの縁にある焦点の合っていない蛍光や中心部の暗い細胞が検出されにくいため、核が見逃されました。 (下)共焦点光学系で取得した同様の画像では、より正確な1078個の核がカウントされました。
アポトーシスアッセイによる抗がん剤のスクリーニング
抗がん剤の一部は、アポトーシスの外因性経路を標的として細胞死を誘導します。アポトーシスアッセイの実証として、96ウェルプレートで3日間培養したHCT116スフェロイドに、4種類の抗がん剤を濃度系列で24~48時間処理しました。化合物処理後、Life Technologies社のCellEvent CaspaseおよびMitoTracker Orange試薬を用いてアポトーシスを検出しました。Hoechst核染色を含む染色試薬を4倍濃度のカクテルとしてウェル内の培地に添加しました。スフェロイドを乱さないよう、洗浄不要の染色試薬を選択しました(図4)。
| マルチパラメーター・アポトーシス測定用染色液 | 目的 | 最終濃度 |
|---|---|---|
| ヘキスト | 核マーカー | 16.2 µM (10 µg/mL) |
| セルイベント Caspase 3/7 | アポトーシスマーカー | 7.5 µM |
| ミトトラッカー オレンジ CMTMRos | ミトコンドリア電位マーカー | 200 nM |
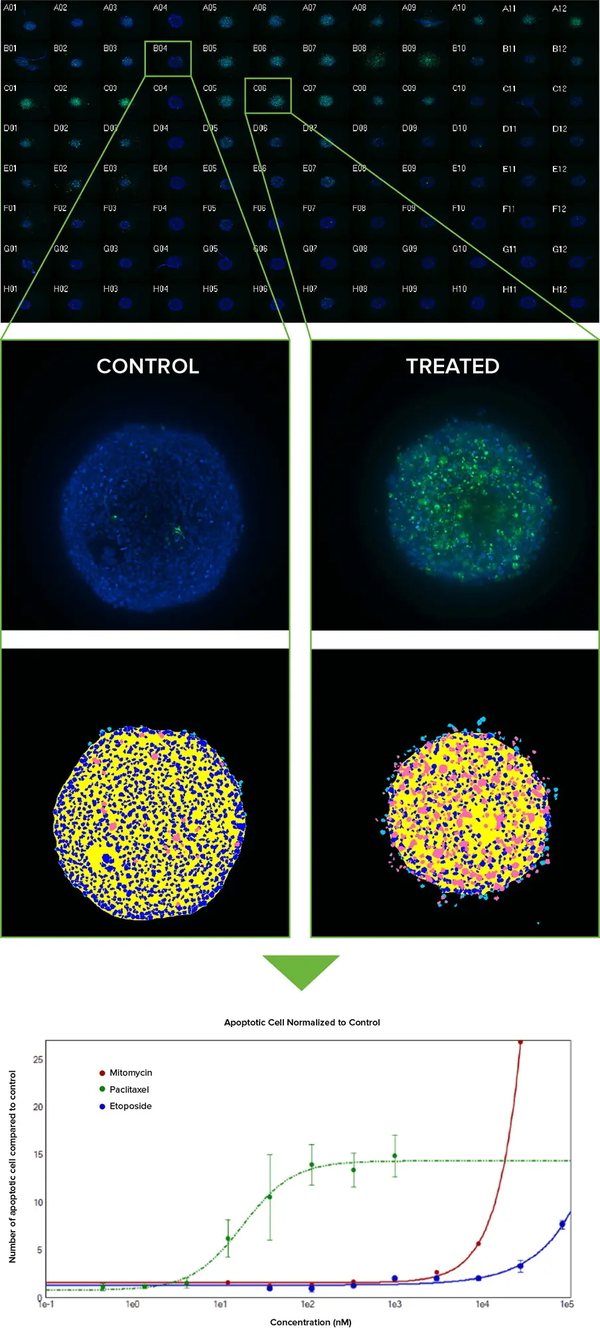
図4:(上)96ウェルプレート内のHCT116スフェロイドを化合物で処理し、10倍Plan Fluor対物レンズで撮影した画像サムネイルのモンタージュ。Hoechstで染色された核(青)に、CellEvent Caspase 3/7アポトーシスマーカー(緑)が重ねられています。未処理のコントロールは列4に配置されており、列5~7ではPaclitaxelを1 µMから1:3で段階希釈した処理(A列から横方向に3つのレプリケート)が行われ、Caspase 3/7の応答が明確に確認できます。(中央)11枚のZプレーン画像を2D最大投影画像に統合し、シンプルなカスタムモジュールで解析しました。アポトーシスの程度が低い画像と高い画像、それぞれに対応するセグメンテーションマスクが表示されています(ロイヤルブルー=核、ピンク=アポトーシス細胞)。(下)未処理スフェロイドと比較してアポトーシス量を正規化し、グラフにプロットすることで、Paclitaxel(緑の線)がMitomycin CやEtoposideよりもはるかに低濃度でアポトーシスを誘導することが示されています。
スクリーニングにおけるミトコンドリア膜電位アッセイのマルチプレックス化
上記のアポトーシススクリーニングでは、染色カクテルにMitoTracker Orangeを追加することで、ミトコンドリア膜電位も評価可能です。また、ミトコンドリア代謝に影響を与えることで腫瘍増殖を阻害する薬剤を個別に解析することもできます。以下は、ミトコンドリア膜電位を強力に破壊するAntimycin Aを用いたアッセイの例です。4時間の処理後、スフェロイド細胞内のMitoTracker Orangeの蛍光強度に基づいてミトコンドリアの健全性を評価しました。画像では、MitoTrackerが大きなスフェロイドの中心部まで完全に浸透していないか、中心部の細胞が健全なミトコンドリアを持たない可能性があり、ミトコンドリア波長で中心部が全体的に暗く見えることが確認されました(図5)。
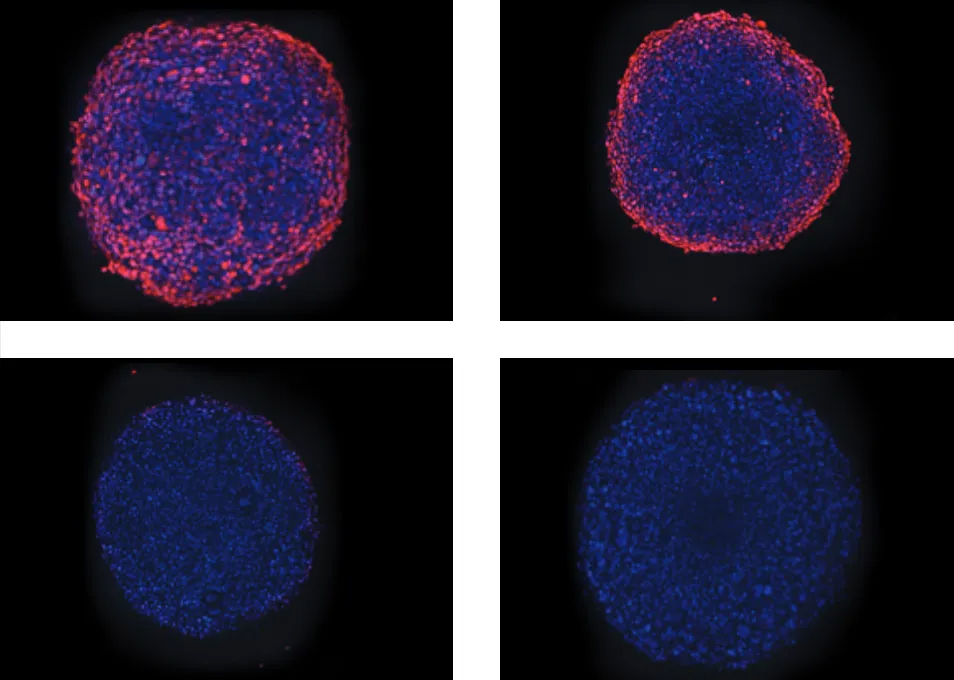
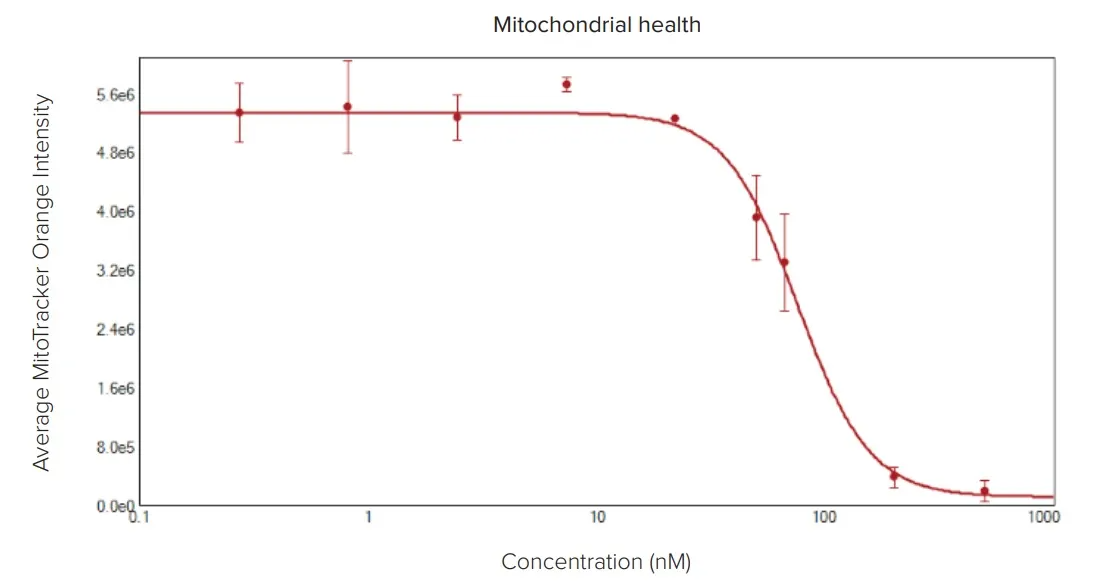
図5: Antimycin Aによるミトコンドリアへの毒性効果(上)Hoechst(青)とMitoTracker(オレンジ)を重ねた画像。Antimycin Aを1、22、67、200 nMの濃度で処理したスフェロイドを表示。(下)スフェロイド内で検出されたミトコンドリアの平均強度値をプロットし、薬剤の影響を示しています。
マイクロプレート内の3Dスフェロイドを迅速にスクリーニング
in vivoの3D培養システムは、均一なサイズのヒトがん細胞スフェロイドを形成できる能力と、ハイスループット・ハイコンテントイメージングによってスフェロイドの薬剤応答をスクリーニングできる能力を備えており、化学療法薬候補のより関連性の高い試験を促進する上で重要なステップとなります。ImageXpress Micro ConfocalシステムとMetaXpressソフトウェアを使用することで、マイクロプレート内の3Dスフェロイドを迅速にイメージング・解析し、抗がん剤によるアポトーシス誘導やミトコンドリア毒性をモニタリングすることが可能です。
これらのスフェロイドスクリーニングアッセイの取得パラメータの最適化に関する詳細は、以下の論文をご参照ください: Sirenko, O. et al., High-Content Assays for Characterizing the Viability and Morphology of 3D Cancer Spheroid Cultures. Assay and Drug Development Technologies, 2015 In Press.
PDF版(英語)