Application Note in vitro 血管新生モデルを用いた
ハイコンテントチューブ形成アッセイ
- 3D血管新生アッセイを自動化できます
- チューブ形成の定量にかかる作業と時間を最小限に抑えます
- 複数の表現型測定を同時に取得できます
- 高密度フォーマットで抗血管新生物質をスクリーニングできます
PDF版(英語)
Eurofins Panlabs Discovery Services Taiwan, Ltd.
腫瘍血管新生を標的とした自動化チューブ形成アッセイのスケールアップ
血管新生(既存の血管から新しい血管が形成される現象)は、内皮細胞のスプラウティング、増殖、移動、浸潤、分化など、さまざまな生物学的プロセスに関与する重要なステップです *1,*2。血管新生の異常は疾患の特徴であり、幅広い臨床的影響と関連しています *3-*5。その中でも、腫瘍血管新生を標的とする治療法は、腫瘍増殖を抑制する有望な代替アプローチです。
腫瘍に対する治療薬を開発するためには、生理病理学的環境を再現する堅牢なin vitro血管新生モデルが不可欠であり、阻害または刺激化合物に対する内皮細胞の応答を評価する必要があります *2。チューブ形成アッセイは、in vivo微小環境を代表するモデルの一つであり *1,*6,*7、細胞外マトリックス上で増殖した内皮細胞から形成される毛細血管様構造を定量することで、抗血管新生効果を迅速に評価できます(図1)。
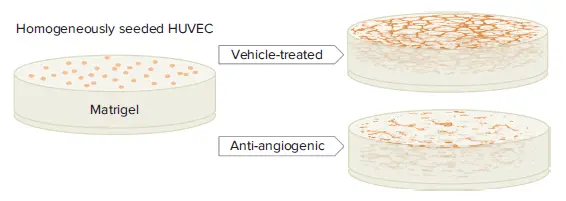
図1. チューブ形成アッセイの原理 HUVECは基底膜マトリックスと混合され、96ウェルマイクロプレートに播種されます。ビークル処理条件下では、毛細血管様のチューブ構造が自発的に形成されますが、血管新生阻害化合物が存在する場合、チューブは形成されず、代わりに細胞が凝集します。
本アプリケーションノートでは、画像取得と解析を効率化する自動化チューブ形成アッセイの開発について説明します。これは、同様のアッセイをスケールアップする際の主要なボトルネックです。蛍光染色とハイコンテントイメージングシステムを組み合わせることで、完全な3Dチューブ構造をより鮮明に可視化し、チューブ形態に対する抗血管新生効果を特徴づける複数の表現型測定を生成できます。
抗がん薬Suraminを使用し、アッセイのスループット、感度、一貫性を確保する本手法の堅牢性を実証しました。
材料
- ヒト臍帯静脈内皮細胞(HUVEC) (ATCC)
- 96ウェル細胞培養プレート
- マトリゲル(コーニング)
- クリスタルバイオレット (MilliporeSigma)
- カルセインAM (Thermo Fisher Scientific)
- Suramin(ミリポアシグマ)
- ImageXpress®Micro ConfocalハイコンテントイメージングシステムおよびMetaXpress ソフトウェア(モレキュラーデバイス)
方法
HUVECは、事前に固化したMatrigel上に96ウェルマイクロプレートでウェルあたり15,000細胞で播種しました。播種直後に、HUVECを0.4%ビークルまたは1.25 μM~80 μMの範囲のSuramin希釈液で処理しました。37°C、5% CO₂で18時間インキュベート後、細胞をCalcein AMまたはCrystal Violetで染色しました。プレートはImageXpress® Micro Confocalシステムで撮像し、Calcein AMにはFITCフィルターセット、Crystal VioletにはCy5フィルターセットを使用しました。チューブはMatrigel内で3Dネットワークを形成するため、z軸方向に1.3 mmの範囲で画像を取得しました。Best-Focusアルゴリズムにより、各zスタックからチューブ構造をリアルタイムで2D画像に投影し、得られた画像はMetaXpress®ソフトウェアのカスタムモジュールで解析しました。カスタムモジュールは、個々のチューブ状または結節状構造を抽出・識別し、総チューブ長、総チューブ面積、チューブ数、ノード数を出力しました(図2)。
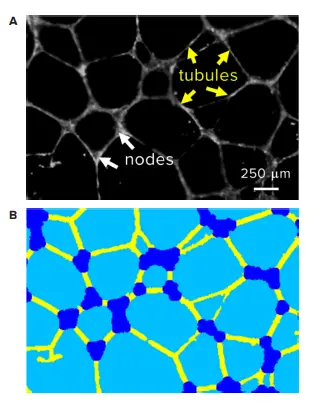
図2. チューブネットワークの自動定量化 (A) 蛍光染色で可視化されたチューブネットワークの代表画像と画像解析ステップの例。(B) MetaXpressソフトウェアで識別された個々のチューブ(黄色)とノード(青)のセグメンテーション。
Suraminの抗血管新生効果を評価するため、Suramin処理ウェルの結果をビークル処理ウェルおよび細胞なしウェルと比較しました。血管新生阻害効果は、総チューブ長をビークルコントロールに正規化して判定し、用量系列は4パラメータ非線形回帰でフィットしました。最小阻害濃度(MIC ≥ 30%)を有意な応答としてスコアし、半最大阻害濃度(IC₅₀)を算出しました。
蛍光生細胞染色によるチューブの可視化と定量の改善
Crystal Violetで細胞を染色し、光学顕微鏡で観察することは、チューブ形成を測定する最も一般的な方法です。しかし、内皮細胞は基底膜様基質で三次元ネットワークを形成する性質があり、明視野顕微鏡の制約により、不均一な照明下で全てのチューブ構造を正確に捉えることは困難です(図3A)。さらに、チューブ形成の手動測定は労力を要し、ヒューマンバイアスの影響を受けます。これらの問題はアッセイ性能を損ない、スケールアップの可能性を制限します。
これらの制約を克服するため、蛍光染色と低倍率対物レンズを使用し、ウェル全体のチューブ構造画像を取得しました。Crystal Violetの明視野画像と比較して、Calcein AMの蛍光やCrystal Violetの自家蛍光は画像コントラストを改善し、得られた画像はほぼビネットフリーです(図3B)。低倍率対物レンズの長い焦点深度と自動zスタッキングにより、3Dで成長したチューブをより多く捉えることができます。さらに、Calcein AMによる生細胞染色はサンプル固定を不要にし、チューブ破損やその他のアーティファクトの原因となる洗浄工程を減らします。
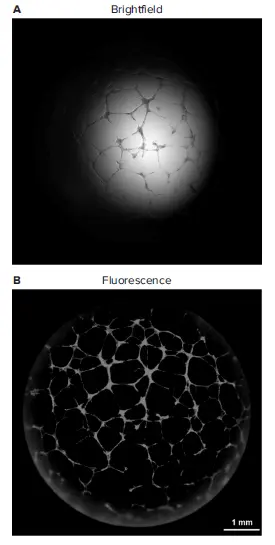
図3. 2X PA対物レンズを用いたチューブネットワークの明視野画像と蛍光全ウェル画像の比較 3Dスタッキング後の蛍光画像(A)は、視野の広さと照明の均一性において、明視野画像(B)よりも優れています。
この改良プロトコールの性能を示すため、線維芽細胞増殖因子および血管内皮増殖因子(VEGF)受容体シグナルを標的として血管新生を阻害することが知られている化合物Suraminをポジティブコントロールとして使用しました。3Dスタックから投影された蛍光画像の自動セグメンテーションにより、チューブ状および結節状構造を可視化し、定量できます(図4)。統計解析の結果、Suraminは総チューブ長で示されるように、濃度依存的にチューブ形成を有意に阻害し、Z’因子は0.75でした(図5)。これらの結果は、明視野イメージングと手動定量で得られた結果と同等ですが、アッセイ時間は96ウェルプレートで8時間から30分未満に大幅に短縮されました。
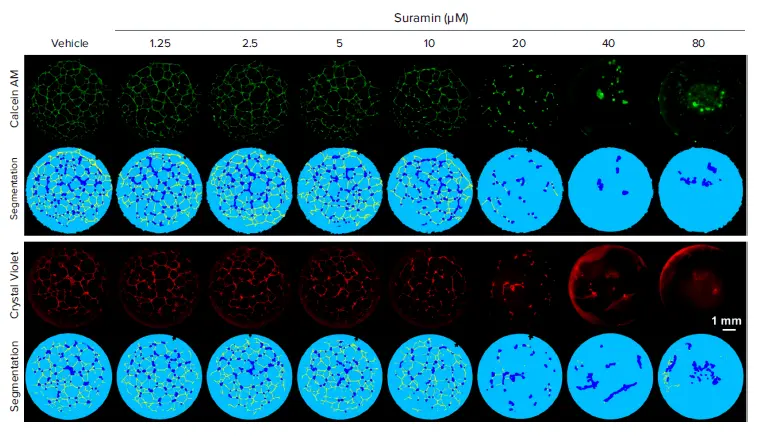
図4. Suraminの濃度依存的な抗血管新生効果 ビークル処理ウェルではHUVECがチューブネットワークを形成しますが、Suramin処理ウェルではチューブ形成が濃度依存的に減少します。Crystal Violet(下段)は明視野および自家蛍光イメージングの両方に適していますが、Calcein AM染色(上段)は画像コントラストがやや良好で、ウェル端付近のアーティファクトが少ないことに注目してください。
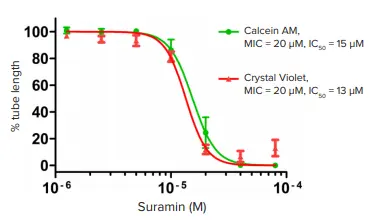
図5. Suramin処理によるチューブ長の割合の濃度応答曲線 Calcein AMで染色したHUVECチューブ(緑のドット)またはCrystal Violetで染色したチューブ(赤の三角形)は、MetaXpressソフトウェアのカスタムモジュールで測定しました。総チューブ長の割合とSuramin濃度を4パラメータ曲線フィットでプロットし、EC₅₀値はCalcein AMで15 μM、Crystal Violetで13 μMでした。MIC ≥ 30%は有意な応答としてスコアされます。プロットは3~4回の独立実験の複製から得られた平均±SEMを示します。
結論
ハイスループットスクリーニングで可能なチューブ形成アプリケーションは多数あります。
ハイスループットスクリーニングで可能なチューブ形成アプリケーションは多数あります。チューブ形成アッセイは、さまざまな内皮細胞ソースの選択、異なる細胞タイプの共培養、培地の代替サプリメント、支持マトリックスの種類の変更、または幹細胞への血管新生誘導などの実験に対応するin vitro 3D血管新生ツールとして調整できます *6, *8-*10 。
しかし、チューブ形成アッセイのスケールアップには、画像取得から処理・解析まで大きな課題があります。本稿では、抗血管新生化合物のスクリーニングに向けたHUVECのチューブ形成のハイスループット定量化を最適化した方法をまとめました。蛍光染色、zスタック取得、ウェル全体画像の2D投影生成、チューブとノードを定義する独自の画像処理アプローチを備えたカスタムモジュールを活用することで、チューブネットワークの信頼性の高い自動解析を提供しました。画像取得と解析を自動化することで、解析結果へのバイアスを回避し、手動または半自動定量に伴う時間的課題を完全に解決しました。ImageXpress Micro Confocalシステムを使用することで、手順が効率化され、チューブ形成アッセイは信頼性、再現性、ハイスループット性を備えたものとなります。
参考文献
- Adv Drug Deliv Rev. 97: 250-9. 2016
- Iran J Basic Med Sci.
- Angiogenesis. 18: 433-48. 2015
- Nat Med. 9: 653-60. 2003
- Annu Rev Cell Dev Biol. 27: 563-84. 2011
- Stem Cell Res Ther.
- Drug Discov Today.
- J Endod. 43: 588-595.
- Assay Drug Dev Technol. 15: 267-279. 2017
- Reprod Toxicol. 70: 116-125.
PDF版(英語)