Application Note GrowDex-Tハイドロゲルによる3D培養がん幹細胞の解析
- がん幹細胞研究のため、U-251 MG細胞株を用いたスケーラブルなハイコンテントアッセイを検討します
- HTSおよびHCSアプリケーションのイメージングに最適化されたGrowDex-T透明ハイドロゲルを用いて、高品質な画像を取得します
- ImageXpress Micro Confocalシステムを使用して、正確な3Dボリューム測定を行います
PDF版(英語)
はじめに
Yiming Meng | Research Scientist | University of Reading, UK
Jonathan Sheard, PhD | Applications Scientist | UPM Biomedicals
Andy Bashford, PhD | Applications Scientist | モレキュラーデバイス
3Dで細胞モデルを培養することは、よりin vivoに近い細胞環境を再現できるという利点があります。この生理学的関連性の向上に伴い、使いやすさ、再現性、操作時間、試薬コスト、アッセイの柔軟性、ハイスループットでの自動化の可能性など、生物学的および実験的な複雑性のバランスを取るためのさまざまな検討事項が生じます。どのモデルにおいても重要な要素は、細胞が3Dで成長・成熟できるようにするための材料の選択です。
GrowDex®ハイドロゲルは、ナノフィブリルセルロースで構成されており、温度安定性を備え、ゲル調製を必要とせずにすぐに使用できる、定義が明確で高い再現性を持つハイドロゲルです。この材料は細胞外マトリックス(ECM)を模倣し、細胞が3Dで相互作用できる支持体を提供しながら、栄養素などの低分子の拡散を可能にします *1,2。GrowDexハイドロゲルはシアーシニング特性を持ち、静置時には粘性のあるハイドロゲルですが、ピペッティングや注入時のせん断応力下では流動化します。多くの3Dスキャフォールド材料は可視光の散乱や吸収を引き起こし、イメージング用途には不向きです。GrowDex®-Tは透明なハイドロゲルであり、イメージング品質を向上させるため、ハイコンテントスクリーニングアッセイに適した魅力的な選択肢となります *3。
ここでは、ヒトグリオブラストーマ細胞株U-251 MGの幹細胞性を調べるための3Dアッセイについて説明します。がん幹細胞(CSC)理論は、自己複製能を持つ小さな細胞サブポピュレーションが腫瘍の維持と増殖を担うというモデルを提唱しています *4。U-251 MG細胞は、がん幹細胞様の特性を示すアクセスしやすい細胞株であり *5,6、増殖およびその後のスクリーニング研究に適しています。これらの細胞を3Dスフェロイドに成長させ、固定し、CSCマーカーであるnestinで標識する方法を示します *7。その後、ImageXpress® Micro ConfocalハイコンテントイメージングシステムによるハイコンテントイメージングとCSC集団の3Dボリューム解析により、3Dモデルでがん幹細胞生物学を研究するための有用で関連性の高いハイスループットアッセイを実証します。
材料
- U-251 MG細胞(旧名U-373 MG)(ECACC)
- 増殖培地 DMEM 高グルコース、2mM L-グルタミン、10% FCS、1% B27、20ng/ml EGF、20ng/ml FGF
- GrowDex-T ハイドロゲル(UPM Biomedicals)
- Greiner 96ウェルマイクロプレート、μClear® (Greiner)
- 4%パラホルムアルデヒド(PFA)
- リン酸緩衝生理食塩水(PBS)
- 0.1%トリトンX-100含有リン酸緩衝生理食塩水(PBS-トリトン)
- 0.02%アジ化ナトリウム含有リン酸緩衝生理食塩水(PBS-アジド)
- ブロッキングバッファー: リン酸緩衝生理食塩水、0.02%Tween、5%ヤギ血清
- PBSで希釈した4′,6-ジアミノ-2-フェニルインドール二塩酸塩(DAPI)(1:2000)(Sigma-Aldrich)
- PBS(0.2nM、1:100)で希釈したファロイジン-Atto 550(Sigma-Aldrich)
- Nestin マウスモノクローナル抗体(1:250 ブロッキングバッファー希釈)(R&D Systems)
- ヤギ抗マウス Alexa Fluor 488(1:300ブロッキングバッファー希釈)(Invitrogen)
- ImageXpress Micro Confocal、4X Plan Apo Lambda対物レンズ、40X WI CFI Plan Apochromat水浸対物レンズ、レーザー光源、深部組織透過共焦点ディスクモジュール搭載。3Dボリューメトリックツールを備えたカスタムモジュールエディター。
方法
- 2D培養の準備:U-251細胞は2Dで培養拡大し、37°C、10% CO₂でインキュベートしました。トリプシン処理後、細胞を完全培地に再懸濁し、濃度1×10⁷ cells/mLに調整しました。
- 細胞-ハイドロゲルの準備:0.2% GrowDex-Tハイドロゲル中に1×10⁶ cells/mLの作業用細胞溶液を作成し、96ウェルプレートの各ウェルに50 μLを分注しました(図1A)。作業用細胞溶液は、GrowDex-Tハイドロゲル200 μLを完全培地700 μLに加え、気泡を避けながらピペッティングで十分に混合して1 mLの容量にしました。次に、濃度1×10⁷ cells/mLの細胞懸濁液100 μLを加えてよく混合しました。96ウェルプレートに添加後、ハイドロゲル中の細胞を37°Cで30分間インキュベートし、その上に標準培養液50 μLを添加しました(図1A)。
- 3D培養の成長:細胞は37°C、10% CO₂で72時間培養しました。培養期間の中間で培地を1回交換しました。この培地交換および以下に記載する固定・洗浄・染色の各ステップは、ウェルの縁のメニスカスから50 μLの上清を慎重に除去し、ハイドロゲルを乱さないように注意しながら、新しい培地/PBS/PFAをウェルの縁にピペットを置いてゆっくりと添加する方法で行いました。
- スフェロイドの固定:培地を慎重に除去し、ハイドロゲル層を乱さないように注意しながら、4% PFAをウェルに20~30分間添加し、その後PBSで5分間の洗浄を2回行いました。
- スフェロイドの染色:固定したスフェロイドをブロッキングバッファで30分間インキュベートし、続いてnestin一次抗体でインキュベートしました。スフェロイドをPBSで洗浄後、二次Alexa Fluor抗体でインキュベートしました。すべての洗浄とインキュベーションは4°Cで穏やかな撹拌を伴い一晩行いました。その後、PBS-Tritonで30分間洗浄し、PBSで5分間洗浄後、DAPIおよびファロイジン染色で4°Cで一晩インキュベートしました。染色後、サンプルをPBSで一晩洗浄し、PBS-アジドに移してイメージングに備えました。
- イメージングと解析:96ウェルプレートはImageXpress Micro Confocalシステムでイメージングしました。QuickIDターゲット取得を用い、DAPIチャンネルで4X倍率の単一視野を取得しました。スフェロイドはサイズと形状に基づいて自動選択され、その後高倍率でイメージングしました。画像はDAPI、FITC、TRITCチャンネルで取得し、Zスタックは25ステップ、ステップサイズは5 μmでした。
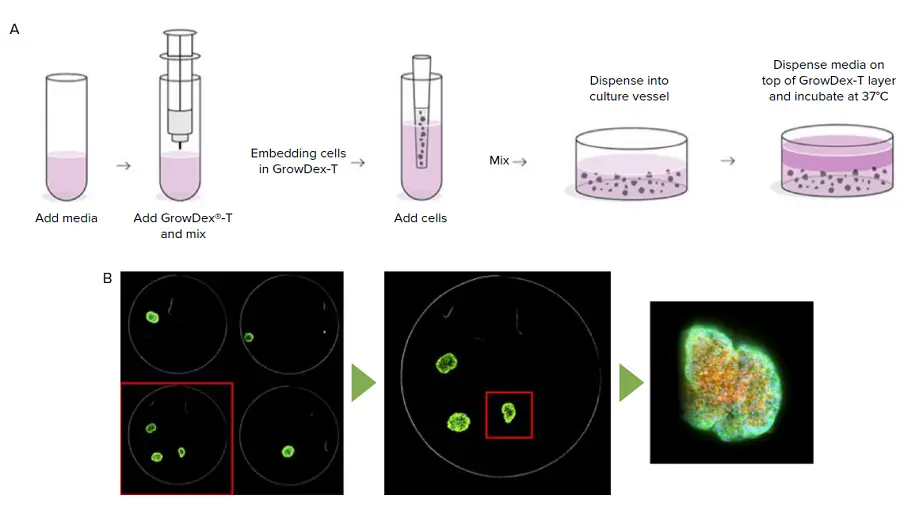
図1.
方法の概要。GrowDex-Tアニオン性ナノフィブリルセルロース(aNFC)は、細胞培養培地で希釈した後、細胞を添加し、96ウェルプレートに分注します(A)。QuickIDターゲット取得の例として、低倍率で構造を識別した後、高倍率で取得する様子を示します(B)。
結果
GrowDex-Tハイドロゲルで成長した3DスフェロイドにおけるCSCマーカーの取得
U-251 MG細胞は、異なる細胞シグナル伝達経路を標的とする化合物を添加して3Dで培養しました。ここでは、ImageXpress Micro Confocalシステムを用いてスフェロイドをハイスループットかつハイコンテントに解析するためのアッセイコンセプトを概説します。完全な結果と化合物の効果については別途公開予定です。
培養72時間後、3DスフェロイドはGrowDex-Tハイドロゲル全体に分布し、周囲のマトリックスに顕著なアウトグロースを示す、ゆるく不規則な形状を呈しました(図2A)。Nestin陽性細胞はスフェロイド全体で明確に確認され、一部のNestin陽性細胞は3D構造内で小さな突起を伸ばしていました(図2B)。ファロイジンで標識されたフィラメント状アクチンはスフェロイド全体に見られ、スフェロイド内に点状染色の明確なクラスターが確認されました(図2C)。
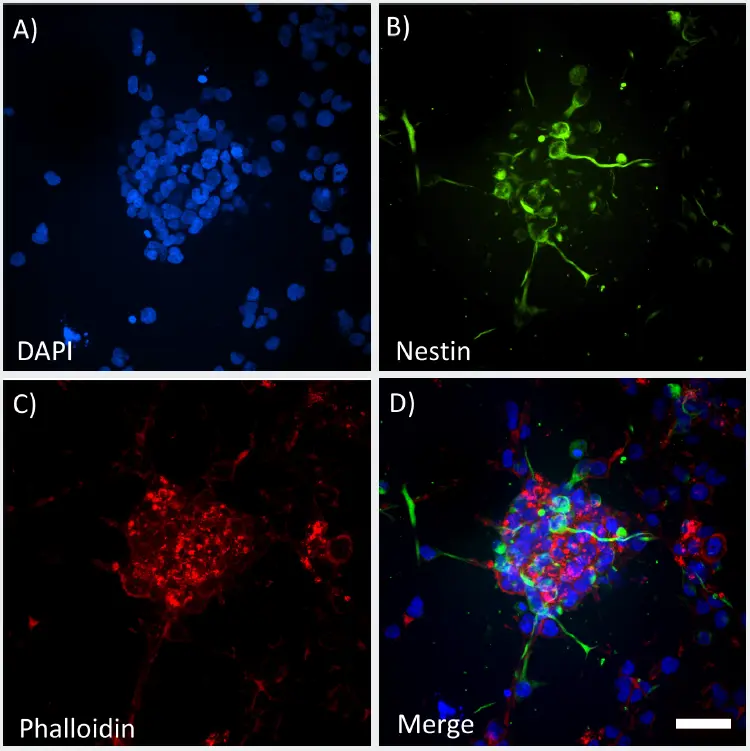
図2
GrowDex-Tで成長した3Dスフェロイドの高解像度画像。ImageXpress Micro Confocalで取得した最大投影画像。40XウォーターイマージョンCFI Apochromat LWD Lambda Sを使用。Zスタックは120 μm(20 × 5 μmステップサイズ)。固定したスフェロイドはDAPI(A)、Nestin(B)、Phalloidin(C)で標識し、すべてのチャンネルをマージしました(D)。スケールバー=50 μm。
スフェロイドはウェル底面から100~200 μm上に位置し、40Xウォーターイマージョンレンズでイメージングしました。構造全体をZスタックで120 μmの深さまで撮影できたのは、ロングワーキングディスタンス(LWD)レンズのおかげです。GrowDex-Tハイドロゲル250 μmを通してイメージングしたにもかかわらず、スフェロイド構造を鮮明に視認できる高解像度画像が得られました。
このセットアップは、U-251細胞が3Dハイドロゲルで成長し、スフェロイド構造の一部集団のみがCSCマーカーを示す方法を示しています。これは、CSCの挙動や生理学をハイスループットまたは自動化された方法で研究する手段となります。
QuickIDターゲット取得による効率向上
複雑な3D細胞培養で画像を取得する際の一般的な課題は、適切な構造とそのウェル内位置を特定することです。このアッセイでは、QuickIDターゲット取得を使用し、最初に4X低倍率スキャン(図3A)を行い、その後40X高倍率で取得しました(図3B)。この機能により、システムはスフェロイドを各視野の中央に自動的に配置できました。低倍率画像でのスフェロイド検出にはCustom Module Editorの機能を使用し、サイズ、形状、位置、強度などの測定値に基づいて構造を偏りなくフィルタリングしました(図3A)。
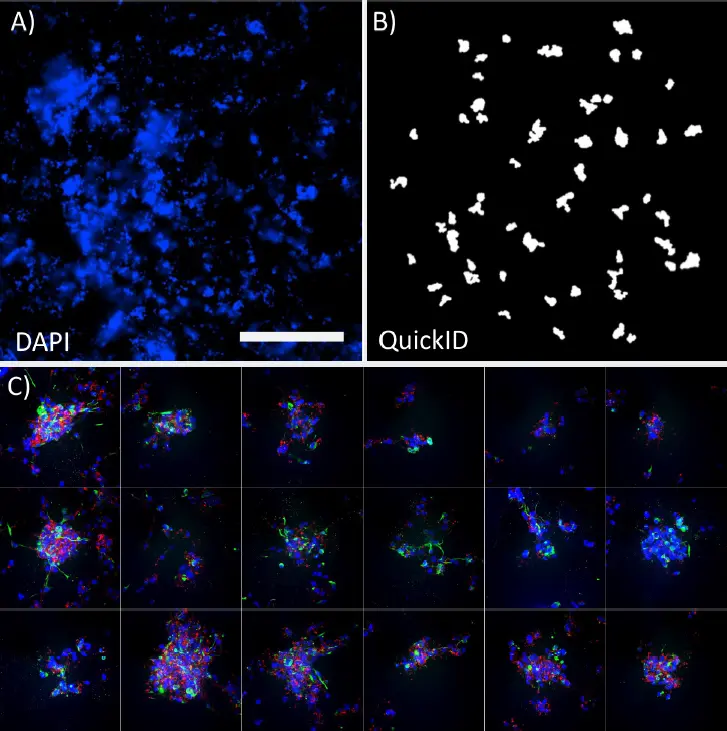
図3.
QuickIDワークフロー。DAPIで標識したスフェロイドの4X低倍率画像(A)と、高倍率スキャン用のQuickIDオブジェクト検出(B)。高倍率(40X)画像のパネルは、スフェロイドが各視野の中央に正確に配置されていることを示します。スケールバー=1 mm。
ターゲット取得プロトコールの使用により、ハイコンテント取得は非常に効率的になり、取得時間とストレージ容量を最小化しつつ、ウォーターイマージョン対物レンズとの完全な互換性を維持しました。この例ではQuickIDはDAPIチャンネルのみで使用しましたが、初期スキャンは複数チャンネルや透過光にも容易に拡張できます。このアプローチにより、40X倍率での画像品質を最大化し、構造を視野中央に正確に配置することで、構造の視認性と解析を改善しました。
Custom Module Editorによるボリューム解析ツールの活用
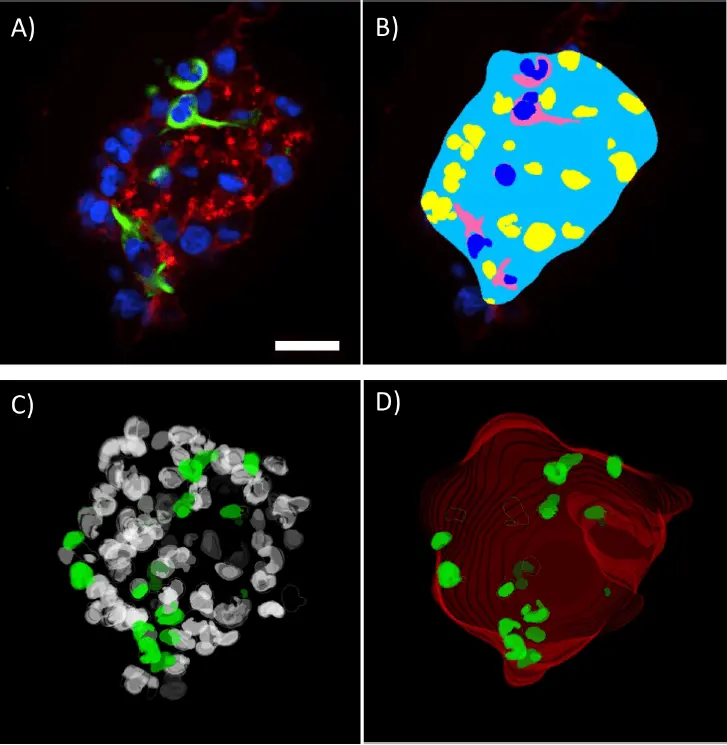
高倍率でのスフェロイド定量は、Custom Module Editorで利用可能な3D解析ツールを使用して行いました(図4A,B)。ファロイジン染色を用いてスフェロイド全体の輪郭を検出するマスクを生成しました。DAPI核染色で全細胞集団を検出し、Nestin陽性細胞質を検出して陽性または陰性としてスコアリングしました。これらすべてのマスクは3Dで構築され、3Dレンダリングを作成し、3Dビューアで回転させて精度を確認しました(図4C,D)。
| 測定 | スフェロイド |
|---|---|
| スフェロイド体積 | 612640 μm³ |
| スフェロイド直径 | 135 μm |
| スフェロイドの深さ | 85 μm |
| スフェロイドの深さ | 85 μm |
| スフェロイドあたりの総細胞数 | 136 |
| ネスチン陽性細胞数 | 25 |
| スフェロイドの深さ | 85 μm |
| スフェロイドあたりのネスチン陽性細胞の割合 | 18% |
| ネスチン陽性体積 | 25176 μm³ |
| 陽性細胞間の平均距離 | 15.9 μm |
図4.
スフェロイドの3Dボリューム解析。DAPI、Nestin、Phalloidinで標識したスフェロイドの単一Z面(A)と、Custom Module Editorで作成した解析マスク(B)。ボリューム核解析マスクの3Dレンダリング(C)は、全細胞集団(白)とNestin陽性核(緑)を示します。スフェロイド輪郭マスク(D)は、スフェロイド全体の輪郭(赤)とNestin陽性核(緑)のボリュームレンダリングを示します。表示されたスフェロイドから定量化された測定値(E)。スケールバー=30 μm。
スフェロイドの形態測定には、ボリューム、深さ、直径が含まれました(図4E)。スフェロイド内のNestin陽性細胞とそのボリュームの定量も可能で、Nestin陰性細胞集団と比較できます。これはCSC集団の定量の一例であり、スフェロイドごとに自動的に定量化できます。
結論
U-251 MGスフェロイドのCSC集団を評価するための3Dアッセイを実証しました。細胞はGrowDex-Tハイドロゲルで成長し、構造が3Dで成長するための支持体を提供しながら、低分子の拡散と高品質画像の取得を可能にしました。
ハイスループットスクリーニングに適した3Dハイコンテントアッセイを開発するには、生理学的複雑性と再現性、使いやすさ、自動化適性などの実験要因のバランスを慎重に検討する必要があります。GrowDex-Tハイドロゲルは、細胞に対して明確に定義された支持体を提供し、アッセイ開発の信頼性を確保しました。特に、光学的に透明なハイドロゲルとImageXpress Micro Confocalシステムの組み合わせにより、各スフェロイド内のCSC集団全体を測定するための高解像度画像取得が可能になりました。
MetaXpress®ハイコンテント画像取得・解析ソフトウェアを使用することで、QuickIDターゲット取得と3Dボリューム解析による高効率な画像取得を実現し、スフェロイドの形態とCSC集団を定量化しました。このアッセイは、グリオブラストーマ細胞株におけるCSC生物学を制御する因子や化合物の研究に適したスケーラブルなハイコンテントアッセイを提供します。
参考文献
- Malinen, Melina M et al. “Differentiation of liver progenitor cell line to functional organotypic cultures in 3D nanofibrillar cellulose and hyaluronan-gelatin hydrogels.” Biomaterials vol. 35,19 (2014): 5110-21. doi:10.1016/j.biomaterials.2014.03.020
- Lou, Yan-Ru et al. "The use of nanofibrillar cellulose hydrogel as a flexible three-dimensional model to culture human pluripotent stem cells.". Stem cells and development 23,4 (2014): 380-92. doi:10.1089/scd.2013.0314
- Sheard, Jonathan J et al. “Optically Transparent Anionic Nanofibrillar Cellulose Is Cytocompatible with Human Adipose Tissue-Derived Stem Cells and Allows Simple Imaging in 3D.” Stem cells international vol. 2019 3106929. 7 Oct. 2019, doi:10.1155/2019/3106929
- Prager, Briana C et al. “Cancer Stem Cells: The Architects of the Tumor Ecosystem.” Cell stem cell vol. 24,1 (2019): 41-53. doi:10.1016/j.stem.2018.12.009
- Cao, Xiangmei et al. “A new approach to screening cancer stem cells from the U251 human glioma cell line based on cell growth state.” Oncology reports vol. 29,3 (2013): 1013-8. doi:10.3892/or.2012.2206
- Zhang, Suojun et al. “Identification of U251 glioma stem cells and their heterogeneous stem-like phenotypes.” Oncology letters vol. 6,6 (2013): 1649-1655. doi:10.3892/ol.2013.1623
- Neradil, Jakub, and Renata Veselska. “Nestin as a marker of cancer stem cells.” Cancer science vol. 106,7 (2015): 803-11. doi:10.1111/cas.12691
PDF版(英語)