Application Note MetaXpress Cell Healthモジュールによる
アポトーシス段階のハイコンテント解析
PDF版(英語)
はじめに
Neal Gliksman, Ph.D., Mary David, Pierre Turpin, Ph.D., Paula Rickert, Ph.D., Molecular Devices Corporation, 1311 Orleans Dr., Sunnyvale, CA 94089 著

細胞の健康に関する研究は、創薬および開発において重要な課題となっています。がんなどの疾患では、変異によってアポトーシス経路が機能不全に陥り、腫瘍細胞の制御不能な増殖を許してしまうことがあります。これに対し、早期の細胞死は、パーキンソン病やアルツハイマー病などの多くの神経疾患、さらに免疫疾患や自己免疫疾患において問題となります。(*1,* 2,*3)
細胞ベースアッセイは、薬剤の毒性作用をモデル化し、抗増殖効果とアポトーシスやネクロシスの誘導を識別するための効率的な方法を提供します。細胞死のメカニズムを特定することで、候補薬の修飾や意図しない毒性の防止が可能になります。細胞の健康状態のさまざまな段階を区別するために、市販の蛍光プローブが多数開発されています。
モレキュラーデバイスのMetaXpress™ソフトウェア用セルヘルスアプリケーションモジュールは、3種類の蛍光色素を用いてアポトーシスおよびネクロシスの細胞ベースアッセイを解析するために設計されています。このソフトウェアモジュールは、複数の色素組み合わせに対応できる柔軟性を備え、細胞ごとのカスタマイズ可能な複数の出力を取得できます。シンプルなインターフェースによりセットアップの手間を最小化し、特定の実験に合わせて設定をカスタマイズする柔軟性を提供します。さらに、Adaptive Background Correction™(ABC)を搭載し、より堅牢なセグメンテーションとアッセイの再現性を実現し、画像全体の不均一な背景を局所的なコンテンツに適応して補正します。
本研究では、MetaXpress Cell Healthモジュールの柔軟性とシンプルさを、さまざまな核染色を細胞の健康指標として使用する均一型アッセイであるVybrant® #7アッセイキットを用いて示します。
材料
- 細胞: DU 145 細胞(ATCC)
- セル培地: 10%dFCS入りHyQ/DME培地(Fisher Scientific)
- PBS(Fisher Scientific)
- スタウロスポリン(Sigma)
- DMSO(Sigma)
- Vybrant #7 Kit(Molecular Probes)
- プレーティング: 96ウェルブラック/クリアアッセイプレート、蓋付き、組織培養処理ポリスチレン、平底(Corning/Costar)
方法
細胞培養
- 接着性DU 145細胞をHyQ/DME培地(10% dFCS添加)で37°C、5% CO₂条件下で培養します。細胞は週に1~2回、1:2~1:5の割合で継代します。
セルヘルスアッセイ
- 各アッセイの前に、DU 145細胞を96ウェルプレートに約7,000細胞/ウェルで播種します。37°C、5% CO₂で一晩インキュベートします。
- 細胞にスタウロスポリンまたはビークルコントロール(DMSO)を細胞培養培地で希釈し、0.05~2 µMの濃度範囲で添加します。37°C、5% CO₂で最大16時間インキュベートします。
- Vybrant #7プローブ(Hoechst 33342、YO-PRO-1、PI)をキットのプロトコールに従ってPBSで希釈します。
- 希釈したプローブを各ウェルに添加し、30分間インキュベートします。
- ImageXpress Micro™システムでMetaXpressイメージング取得ソフトウェアを使用してイメージングを行います(すべてのモレキュラーデバイスイメージングプラットフォームはセルヘルスアプリケーションモジュールに対応)。Vybrant #7色素に対応するフィルターはTable 1に示されています。レーザーオートフォーカスが利用可能な場合は、取得速度を向上させるために使用します。
表 1 には、イメージングに使用する蛍光フィルターの組み合わせが示されています。
| 表 1. Vybrant #7 蛍光色素のイメージングに使用したフィルターセット | |
|---|---|
| 蛍光プローブ | フィルターセット |
| ヘキスト33342 (H33342) |
ブライトライン® |
| YO-PRO-1 | BrightLine FITC-3540B (Semrock) |
| ヨウ化プロピジウム(PI) | Texas Red TXRED-4040B (Semrock) |
表1:標準用量反応曲線を作成するために使用したcGMPキャリブレーターの用量。¹最終濃度は120 µLのアッセイ容量における値です。
自動画像解析
MetaXpress Cell Healthアプリケーションモジュールの詳細については、当社ウェブサイトの「Cell Health Application Module for MetaXpress」データシート(www.moleculardevices.com/pdfs/MX_CellHealth_Datasheet_Rev_B.pdf)をご覧ください。
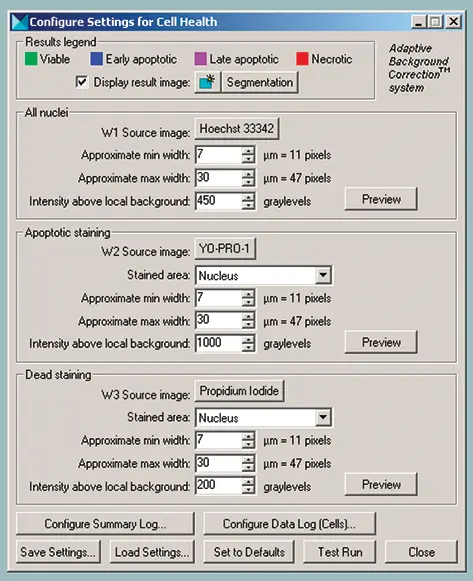
セルヘルスアプリケーションモジュールのダイアログで3つの波長を選択します(図2参照)。
W1(波長1):すべての核を識別するために使用する波長
W2:早期または後期アポトーシス細胞を識別するための色素
W3:後期アポトーシスまたはネクロシス細胞を識別するための色素
W2およびW3では、細胞質、核、または両方のコンパートメントを染色する色素を選択でき、ソフトウェアに位置情報を指定することで画像解析の精度を向上させます。Vybrant #7キットでは、W1にH33342、W2にYO-PRO-1またはH33342、W3にPIを使用します。各波長について、陽性核染色を識別するための適切なサイズ制約とコントラストレベルを選択します。
表2および表3には、Cell Healthアプリケーションモジュールで決定可能なすべてのサイト単位および細胞単位のパラメータが示されており、本アプリケーションノートで使用した測定値も含まれています。
| 表 2. MetaXpress セルヘルスアプリケーションモジュールでサイト単位の測定項目 | |
|---|---|
| 測定項目 | 説明 |
| Total Cells(総細胞数) | W1(全核画像)で検出された細胞の総数 |
|
Viable Cells(生細胞数) % Viable Cells(生細胞の割合) |
アポトーシスまたはネクロシスでない細胞の総数と割合 |
|
Early Apoptotic Cells(早期アポトーシス細胞) % Early Apoptotic Cells(早期アポトーシス細胞の割合) |
W2でアポトーシス染色陽性、W3で死細胞染色陰性の細胞の総数と割合 |
|
Late Apoptotic Cells(後期アポトーシス細胞) % Late Apoptotic Cells(後期アポトーシス細胞の割合) |
W2でアポトーシス染色陽性、W3で死細胞染色陽性の細胞の総数と割合 |
|
Necrotic Cells(ネクロシス細胞) % Necrotic Cells(ネクロシス細胞の割合) |
W2でアポトーシス染色陰性、W3で死細胞染色陽性の細胞の総数と割合 |
|
All Cells Total Area(全細胞の総面積) All Cells Mean Area(全細胞の平均面積) |
W1(全核画像)で検出された細胞の総面積と平均面積 |
|
All Cells W1 Integrated Intensity(全細胞W1積分強度) All Cells W1 Average Intensity(全細胞W1平均強度) |
W1画像で核領域を用いて測定した総強度および平均強度 |
|
All Cells W2 Integrated Intensity(全細胞W2積分強度) All Cells W2 Average Intensity(全細胞W2平均強度) |
W2画像で核領域を用いて測定した総強度および平均強度 |
|
All Cells W3 Integrated Intensity(全細胞W3積分強度) All Cells W3 Average Intensity(全細胞W3平均強度) |
W3画像で核領域を用いて測定した総強度および平均強度 |
注:このアッセイで使用された特定の測定項目は色で示されています
| 表 3. セルヘルスアプリケーションモジュールで利用可能な細胞単位の測定項目 | |
|---|---|
| 測定項目 | 説明 |
| Cell: Nuclear Area(細胞:核面積) |
核領域をµm²単位で測定 2 |
| Cell: W1 Integrated Intensity, Cell W1 Average Intensity(細胞:W1積分強度、W1平均強度) |
W1画像で核領域を用いて測定した総強度および平均強度 |
| Cell: Health Classification(細胞:ヘルスクラス分類) |
核を「生細胞」「早期アポトーシス」「後期アポトーシス」「ネクロシス」のいずれかに分類 |
| Cell: W2 Integrated Intensity, Cell W2 Average Intensity(細胞:W2積分強度、W2平均強度) |
W2画像で核領域を用いて測定した総強度および平均強度 |
| Cell: W3 Integrated Intensity, Cell W3 Average Intensity(細胞:W3積分強度、W3平均強度) |
W3画像で核領域を用いて測定した総強度および平均強度 |
測定値はMDCStore™データベースまたはMicrosoft Excel®に記録し、さらに評価します。IC₅₀の算出には、MDCStoreデータベースと統合されたAcuityXpress™細胞情報解析ソフトウェアを使用します
結果
アポトーシス細胞検出のためのDNA染色
ハイコンテントスクリーニングにより、同一ウェル内で生細胞、ネクロシス細胞、早期および後期アポトーシス細胞を区別できます。アポトーシスまたはネクロシス細胞死を検出・定量するために適した市販の蛍光プローブは多数存在し、選択性、モニタリングする経路、S/N比、使いやすさが異なります。
アポトーシス中には、核膜とクロマチンが分解されます。Vybrant #7アポトーシスアッセイキットは、この分解を検出するためにDNAに特異的な3種類の蛍光プローブを使用します。
Hoechst 33342:細胞の健康状態に関係なくすべての細胞に侵入します。アポトーシス初期に核が凝縮するため、DNA標識の平均強度はアポトーシス細胞で大幅に増加します。そのため、Hoechst 33342はすべての核およびアポトーシス核のマーカーとして使用できます。UV光で励起され、青色光を発します *4。
YO-PRO-1:アポトーシス細胞に選択的に取り込まれます。青色光で励起され、緑色光を発します *5。
Propidium Iodide(PI):膜透過性がなく、通常は生細胞から排除されます。後期アポトーシスおよびネクロシスでは膜の透過性が増し、PIが細胞内に侵入してDNAを標識します。緑色光で励起され、赤色光を発します *6。
DU145細胞は培養後、DMSOまたはスタウロスポリンで12時間処理し、方法で示した蛍光マーカーで標識しました。ImageXpress Microシステムを用いて、自動マルチ波長イメージングにより各サイトで3種類の蛍光画像を取得しました。使用した蛍光フィルターは表1に記載されています。
Vybrant#7キットで得られた蛍光画像(図1)
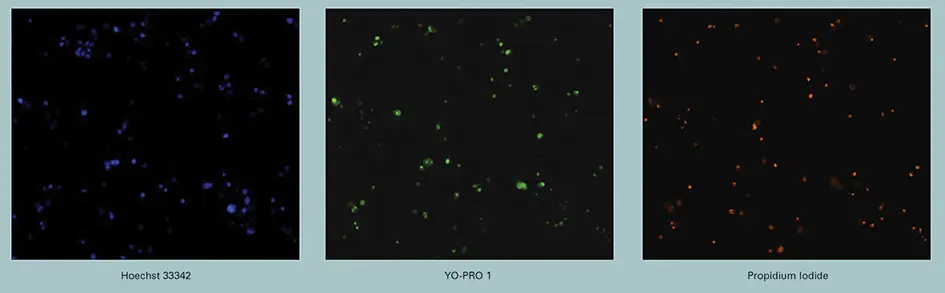
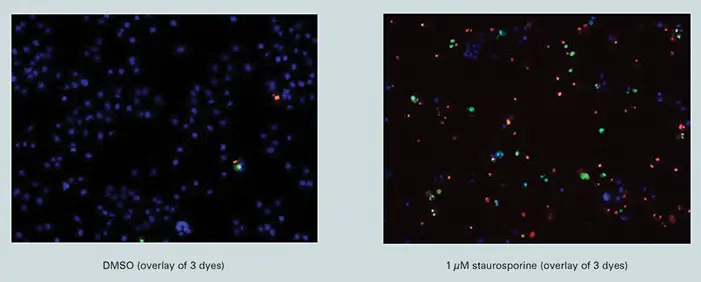
図1に示すように、スタウロスポリンの最大濃度存在下では、3種類の色素で非常に明確な染色パターンが得られました(図上部の単一チャンネル画像または下部のオーバーレイ)。一方、未処理細胞ではYO-PRO-1およびPI染色はほとんど見られず(DMSO処理細胞のオーバーレイ)、色素がアポトーシス過程の各段階に特異的であること、そしてイメージングシステムが色素のシグナルを分離できることを示しています。
画像を自動解析するため、柔軟性と使いやすさを備えたセルヘルスアプリケーションモジュールを選択しました(図2参照)。アプリケーションモジュールは、蛍光マーカーや細胞コンパートメントのラベル付けを柔軟かつ簡単にカスタマイズできます。セルヘルスアプリケーションモジュールはAdaptive Background Correctionを使用し、選択した各波長で陽性染色細胞を正しくセグメント化します。各波長に対して3つのユーザー設定可能なパラメータと、特定のコンパートメントを指定します。「Approximate min width」と「Approximate max width」は、各染色コンパートメントに期待されるサイズ範囲を指定します。「Intensity above local background」は、陽性染色細胞の最適検出のために適切に調整します。サイト単位および細胞単位の測定項目は、MDCStoreデータベース、Microsoft Excel、またはテキストファイルに記録するために選択できます。表2および表3には、Cell Healthアプリケーションモジュールで利用可能な測定項目が示されています。解析結果はMDCStoreデータベースに保存され、AcuityXpress情報解析ソフトウェアでデータマイニングや可視化に使用できます。
MetaXpress用セルヘルスアプリケーションモジュール(図2)
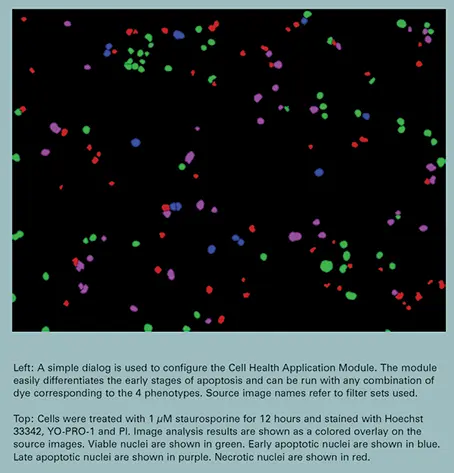
核凝縮はアポトーシスの最も早期のステップの1つであり、このアッセイは早期と非常に早期のアポトーシスを区別できます。核凝縮はHoechst 33342シグナルの強度増加として確認されます。YO-PRO-1の取り込みは、膜透過性が増す前のアポトーシス後期に起こります。明るく染色されたHoechst 33342とYO-PRO-1を比較した画像解析では、凝縮核を持つがYO-PRO-1染色が検出されない細胞が多数確認されました(図2参照)。
用量反応解析
AcuityXpressを用いて、解析から得られたさまざまな用量反応のカーブフィッティングを行いました。セルヘルスアプリケーションモジュールは、Vybrant #7キットを用いて堅牢な用量反応データを生成します。キナーゼ阻害剤スタウロスポリンをさまざまな濃度で12時間処理した後、細胞生存率は0.1~2 µMの濃度で劇的に低下しました(図3参照)。結果はまた、濃度依存的な細胞フェノタイプの変化を示し、最も低い濃度では早期アポトーシス細胞が多く、0.3 µM以上では後期アポトーシス細胞が増加しました *7。
結論
この実験は、Molecular Probes社のVybrant #7アポトーシスアッセイキットを用いたCell Healthアプリケーションモジュールの使いやすさを示しており、細胞の健康に対する多数の化合物の影響を迅速にスクリーニングできます。このモジュールの柔軟性により、細胞の健康を示す幅広い色素に対応可能です。また、潜在的な毒性または非毒性治療薬のスクリーニング、毒性経路の解析において強力なツールです。
AcuityXpressによるスタウロスポリン応答解析(図3)
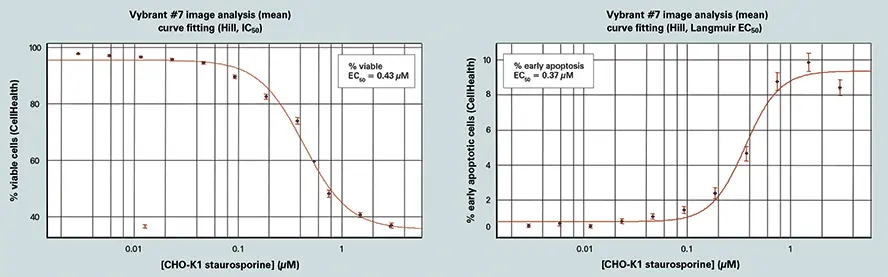
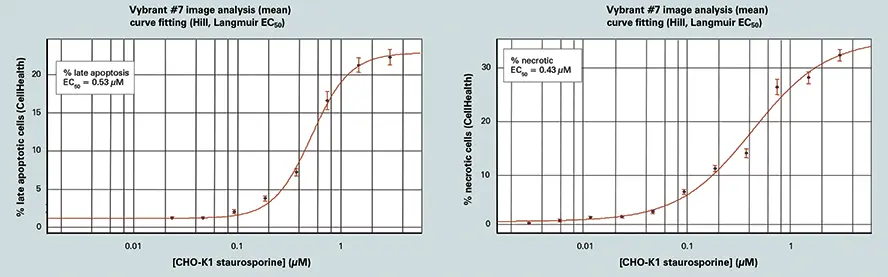
スタウロスポリンの増加する用量に対する細胞の応答(12時間処理)。画像解析と細胞分類はCell Healthアプリケーションモジュールを使用し、カーブフィッティングはAcuityXpressで実施しました。
参考文献
- J.M. Brown, L.D. Attardi (2005). The role of apoptosis in cancer development and treatment response. Nat Rev Cancer 5(3):231-7
- D.W. Dickson (2004). Apoptotic mechanisms in Alzheimer neurofibrillary degeneration: cause or effect? J Clin Invest 114(1):121-30.
- W.G. Tatton, R. Chalmers-Redman, D. Brown, N. Tatton (2003). Apoptosis in Parkinson’s disease: signals for neuronal degradation. Ann Neurol 53(suppl 3): S61-70.
- L. Chiu, H. Cherwinski, J. Ransom, J.F. Dunne (1996). Flow cytometric ratio analysis of the Hoechst 33342 emission spectrum: multiparametric characterization of apoptotic lymphocytes. J Immunol Methods 189(2):157-71.
- T. Idziorek, J. Estaquier, F. De Bels, J.C. Ameisen. (1995). YO-PRO-1 permits cytofluorometric analysis of programmed cell death (apoptosis) without interfering with cell viability. J Immunol Methods 185(2):249-58.
- M. Vitale, L. Zamai, G. Mazzotti, A. Cataldi, E. Falcieri (1993). Differential kinetics of propidium iodide uptake in apoptotic and necrotic thymocytes. Histochemistry 100(3):223-9.
- X. Wang, N.G. Zelenski, J. Yang, J. Sakai, M.S. Brown, J.L. Goldstein (1996). Cleavage of sterol regulatory element binding proteins (SREBPs) by Cpp32 during apoptosis. EMBO J 15(5); 1012-20.
PDF版(英語)