Application Note iPSC由来肝細胞スフェロイドを用いたハイコンテント3D毒性アッセイ
- ヒトiPSC由来肝細胞を用いて肝スフェロイドを形成
- in vitroスクリーニングのために3Dモデルを活用して肝毒性を評価
- 3D画像解析により、対象物の検出とセグメンテーションを最適化
PDF版(英語)
はじめに
発生生物学や組織生物学のモデルとして、3Dスフェロイドの活用に対する関心が高まっており、これらの分野におけるトランスレーショナルリサーチの加速が期待されています *1-3。これに伴い、3D培養を用いたハイスループット定量アッセイの開発が活発に進められています。本研究では、ヒトiPS細胞由来の3D肝スフェロイドの形成方法に加え、毒性評価のための共焦点イメージングおよび解析手法を開発・最適化しました(図1)。
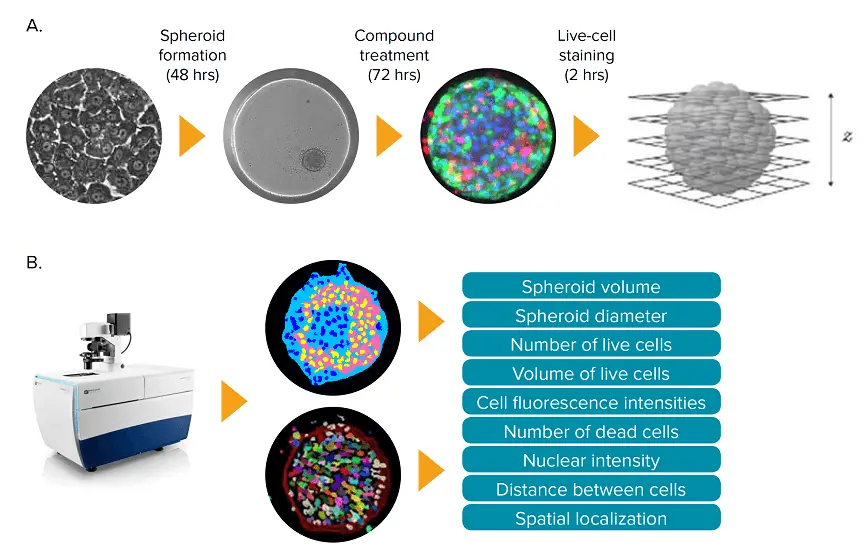
図1. iCell Hepatocytes由来の3Dスフェロイド肝マイクロティッシュを用いた肝毒性アッセイ(A)iCell Hepatocytesは、3D培養の準備として7日間2Dフォーマットで培養されました。スフェロイド形成後、肝マイクロティッシュに化合物を72時間処理し、2時間染色した後にイメージングを行いました。Zプレーン画像は、ImageXpress Micro Confocalシステムを用いて取得しました。(B)取得したZプレーン画像をもとに、2Dおよび3Dの画像セグメンテーションを実施し、3D培養の主要な表現型特徴を定量化しました。
肝スフェロイドの形成
本研究では、ヒトiPSC由来肝細胞 *4、iCell Hepatocytes 2.0(Cellular Dynamics International)およびHepG2細胞(ATCC)を使用しました。凍結保存された細胞は、メーカーのプロトコールに従って解凍・維持しました。ヒトiPSC由来肝細胞のスフェロイド培養を準備するため、iCell Hepatocytes 2.0を2D培養でプレプレートし、Accutaseで剥離後、Geltrex溶液(ThermoFisher Scientific)と混合し、低接着性スフェロイドプレート(InSpheroまたはCorning)に1ウェルあたり1000細胞で播種しました。次に、300 × gで2分間遠心し、細胞を沈降させるとともに気泡を除去した後、37°C、5% CO₂の加湿インキュベーターにプレートを設置しました。なお、HepG2細胞の培養にはマトリックスの添加は不要でした。スフェロイドは24~48時間以内に形成されました。
洗浄不要の染色プロトコールによる肝毒性評価
肝毒性試験化合物による72時間の処理後、スフェロイドは以下の3種類の蛍光色素混合液で染色しました(滅菌PBSにて調製):2 µMのCalcein AM、3 µMのEthD-1、10 µMのHoechst 33342(いずれもLife Technologies製)。別の実験では、CellEvent Caspase 3/7試薬(7.5 µM)およびMitoTracker Orange(200 nM、Life Technologies製)を用いて、化合物によるアポトーシスシグナルの誘導やミトコンドリアへの影響を評価しました。
染色液はスフェロイド培養に添加し、イメージング前に2時間インキュベートしました。染色液は洗い流さず、ピペッティング時にはスフェロイドの損失、崩壊、移動を防ぐよう注意しました。代表的なスフェロイドの合成画像は図2に示されています。
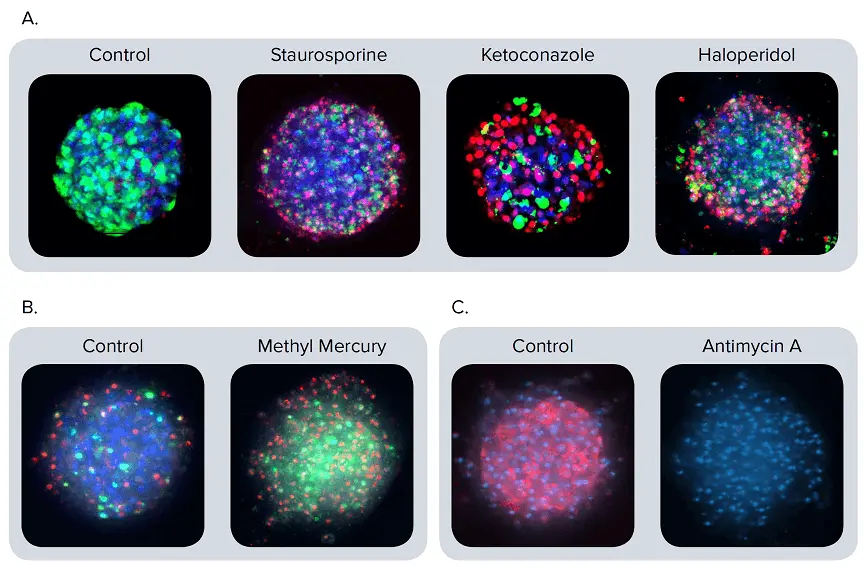
図2. 異なるマーカーで染色したスフェロイドの代表的な合成画像(A)スフェロイドは、スタウロスポリン(1 µM)、ケトコナゾール(30 µM)、ハロペリドール(30 µM)で72時間処理されました。染色にはCalcein AM(緑)、Hoechst(青)、EthD-1(赤)を使用し、合成画像を作成しました。(B)CellEvent Caspase 3/7(緑)、EthD-1(赤)、Hoechst(青)で染色したスフェロイドの合成画像では、アポトーシスが明確に確認できます。メチル水銀(1 µM)で24時間処理したスフェロイドでは、コントロールと比較してアポトーシス細胞(緑)が著しく多く観察されました。(C)MitoTracker Orange(赤)およびHoechst(青)で染色した、コントロールおよびアンチマイシンA(3 µM)処理スフェロイドの合成画像です。アンチマイシンAはミトコンドリア膜の完全性を損なうため、ミトコンドリアの染色は確認されません。
ハイスループット3D画像取得と解析の実装
画像は、ImageXpress® Micro Confocal ハイコンテントイメージングシステム(モレキュラーデバイス)を用いて取得しました。対物レンズは10× Plan Fluorおよび20× Plan Fluorを使用しました。ウェル底から開始し、5–10 µm間隔で11~17枚の画像スタック(深さ100~120 µm)を共焦点イメージングで取得しました。すべての画像(2D最大投影画像を含む)は保存され、解析に使用されました。
3Dオブジェクトの検出と解析
3D画像解析は、MetaXpress® ハイコンテント画像取得・解析ソフトウェアを用いて実施しました。最新版のCustom Module Editorには新しいモジュールが搭載されており(図3)、マルチウェルワークフローにおいて、体積、蛍光強度、距離測定を含む3D構造の定量化を簡素化します。 「Find Spherical Objects」オプションでは、オルガネラから多細胞構造まで、おおよそ球状のオブジェクトを定義できます。ユーザー定義の設定(オブジェクトの最小・最大幅、Zプレーン数、背景との強度閾値)に基づいて検出されます。例:核:幅5–15 µm、Zプレーン1–2枚、閾値200 RFU(相対蛍光単位)、肝スフェロイド:幅100–300 µm、Zプレーン5–11枚、閾値400 RFU。球状オブジェクト解析では、スフェロイドの体積、直径、特定蛍光チャネルでの平均または積算強度などを個別または平均値として取得できます。
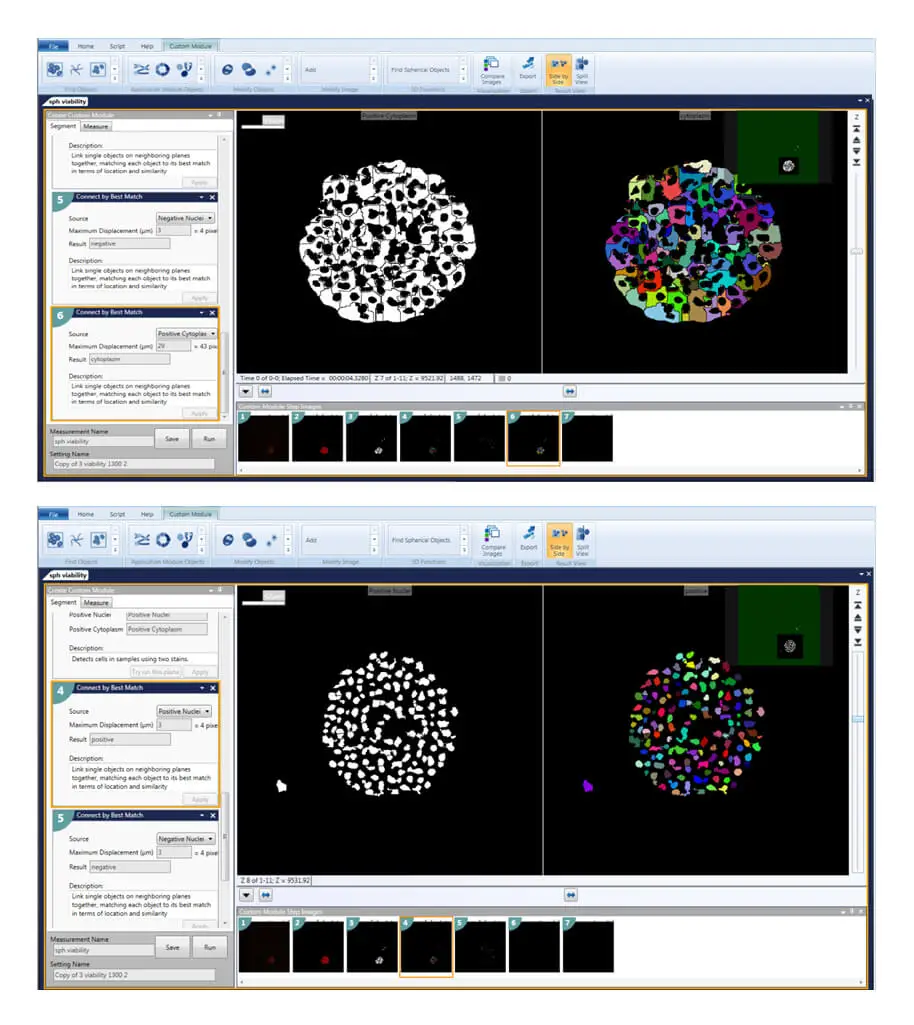
図3. Custom Module Editorによるスフェロイドの定義 スフェロイドを定義すると、目的のマーカーに陽性または陰性の細胞、核、細胞質を個別にカウント・特徴付けできます。
「Find Spherical Objects」解析は、個々の核や細胞を別個のオブジェクトとして定義することも可能です。3D構造解析モジュールの追加機能として、異なるプレーン間のオブジェクトを「Connect by Best Match」「Connect by Touching」「Do Not Connect Objects」のオプションで接続できます。
まず、個々のZプレーン画像を2D画像としてセグメント化・解析し、核数、生死判定、細胞スコアリングなどを測定します。次に、ユーザー定義の最大変位(例:核は3–6 µm、細胞質は20–30 µm)に基づいて「Connect by Best Match」でオブジェクトを接続します。これにより、3D空間内で核や細胞を正確にセグメント化・スコアリングでき、オブジェクトの見落としや重複カウントを防ぎます。Calcein AM陽性/陰性細胞、Ethidium homodimer陽性/陰性細胞など、すべての細胞を定義・カウント可能です。
個々の細胞に異なる色を割り当てることで、積算および平均強度、体積、直径、オブジェクト間距離、3D空間内の位置をセグメント化できます。スフェロイドマスキングを用いることで、含めるべき小さなオブジェクトや除外すべきオブジェクトをカウントできます。例:1ウェルに1つのスフェロイドが存在する肝細胞スフェロイドアッセイでは、シングルセルマスキングによりすべての細胞をカウントでき、スフェロイドに含まれる細胞と含まれない細胞を区別できます。これはスフェロイドの完全性が損なわれている場合に重要です。複数スフェロイドが存在するウェル(例:Matrigelアッセイ)でも、同様の解析により各スフェロイドの細胞構成を定義し、平均値をレポートできます。図4Aは、異なる2DプレーンにおけるCalcein AM陽性細胞のスコアリング解析結果を示しています。最終的に、「Connect by Best Match」オプションを用いて3D空間内でオブジェクトを接続します。同様の手法は、Ethidium homodimer陽性/陰性細胞(生死判定)、ミトコンドリア、蛍光強度、アポトーシス、その他の染色やマーカーの解析にも適用可能です。
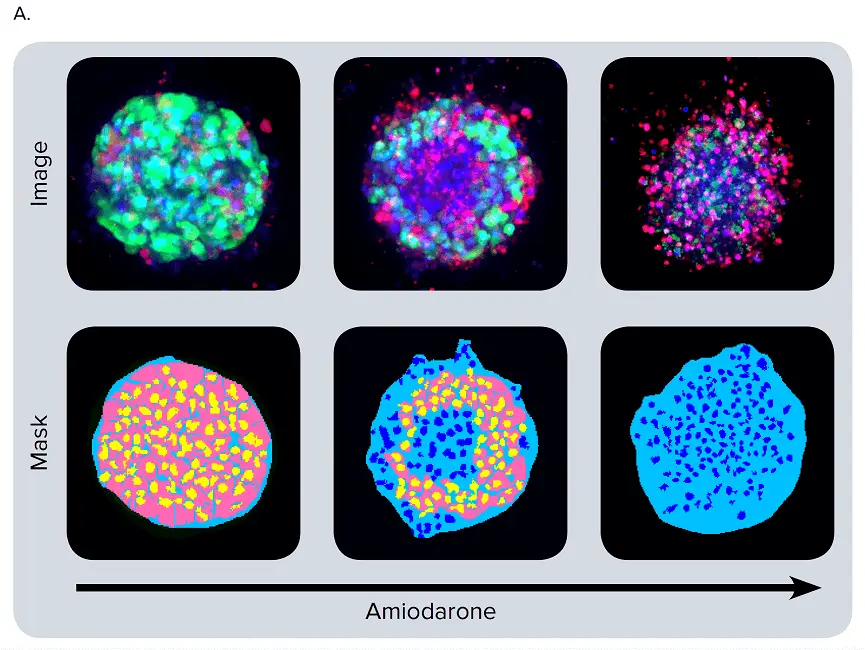
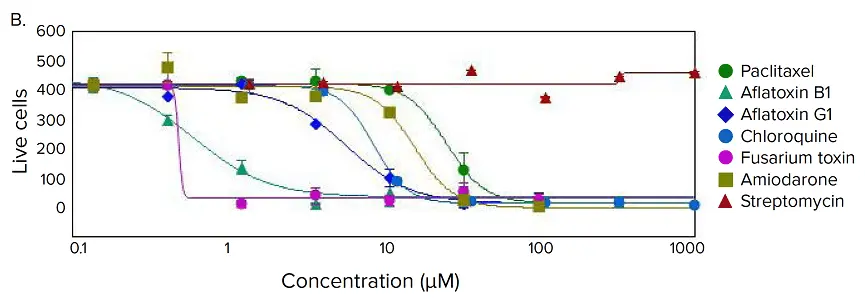
図4. 化合物処理後のスフェロイドにおける表現型の変化(A)iPSC由来肝細胞スフェロイドに肝毒性化合物(アミオダロン)を濃度依存的に処理し、Calcein AM(緑)、Hoechst(青)、EthD-1(赤)で染色しました。合成画像の下には画像解析用マスクが示されています。(B)選択された化合物の用量反応曲線。
マルチパラメータ表現型スクリーニングによる毒性評価
さまざまな肝毒性化合物による処理後、スフェロイドの表現型および細胞構成に顕著な変化が観察されました。多くのスフェロイドは球状の形状を失い、崩壊、疎な構造、扁平化、不規則な形状を示し、細胞が主構造から剥離したり、細胞死により核が凝縮したりする様子が確認されました。これらの表現型変化は、化合物濃度の範囲にわたって発生しました(図4B)。画像の定量解析では、スフェロイドの形態的特徴、細胞構成、複雑性を評価するためのパラメータを導出しました。スフェロイドの体積、直径、蛍光強度に加え、Calcein AM陽性細胞(生細胞)数およびEthD-1陽性細胞(死細胞)数を測定しました。化合物の影響によって総細胞数が減少することはなく、代わりに死細胞数の増加と、生細胞数の濃度依存的な減少が確認されました。Calcein AMの平均蛍光強度は、スフェロイド全体および個々の細胞(細胞質)において著しく低下しました。
細胞毒性メカニズムの詳細な解析のため、アポトーシス表現型およびミトコンドリアの完全性を評価しました。Caspase 3/7染色によるアポトーシスの活性化は、化合物処理後24時間で測定されました。コントロール細胞およびメチル水銀処理細胞における典型的なCaspase 3/7染色パターンは、図2Bに示されています。アポトーシスを誘導する化合物による処理では、Caspase 3/7染色強度およびCaspase 3/7陽性(アポトーシス)細胞数が増加しました。ミトコンドリア膜電位は、MitoTracker Orange染色により評価しました。ミトコンドリアの完全性に影響を与える化合物でスフェロイドを処理した結果、MitoTracker Orangeの染色強度は濃度依存的に減少しました(図2C)。
Calcein AM陽性細胞数、Calcein AM蛍光強度、Calcein AM陽性細胞の体積などの測定項目は、アッセイウィンドウとして有意であり、4パラメータの用量反応曲線モデルに適合しました(図4B)。IC₅₀値(表2)は、SoftMax® Pro 6ソフトウェア(モレキュラーデバイス)を用いて算出されました
| iCell 肝細胞 | ||
|---|---|---|
| 化合物 | IC50 3Dアッセイ (μM) | 説明 |
| メチル水銀 | 2.82 +/- 0.49 | 毒素 |
| フザリウム毒素 | 0.481 | 毒素 |
| アフラトキシンB1 | 0.595 +/- 0.145 | 毒素 |
| ドキソルビシン-塩酸塩 | 5.69 +/- 4.04 | DNAインターカレーター、抗がん剤 |
| スタウロスポリン | 0.91 +/- 0.12 | キナーゼ阻害剤、アポトーシス誘導剤 |
| マイトマイシンC | 2.28 +/- 0.246 | DNAインターカレーター、抗がん剤 |
| クロロキン | 18.60 +/- 0.247 | 抗マラリア剤 |
| ケトコナゾール | 20.4 +/- 10.7 | 抗真菌剤 |
| アミオダロン塩酸塩 | 22.6 +/- 9.68 | 抗不整脈、オートファジー誘導剤 |
| パクリタキセル | 26.2 +/- 6.39 | 微小管阻害剤 |
| フルオキセチン | 28.9 | 抗うつ薬 |
| ピモジド | 35.1 +/- 1.39 | 抗精神病薬 |
| ハロペリドール塩酸塩 | 52.2 +/- 21.6 | 抗精神病薬 |
表2. スフェロイドあたりの生細胞数を指標として測定された選択化合物のIC₅₀値
まとめ
ハイコンテント3Dアッセイと組み合わせた3D肝スフェロイドモデルは、肝毒性を評価するための高感度かつ再現性の高いスクリーニングツールとして有望です。動物試験や臨床データとの予測性については今後の検証が必要ですが、これらの手法およびモデルのさらなる開発により、in vitroスクリーニングにおける有用性が一層高まると期待されます。
参考文献
- Chang, T. T., & Hughes-Fulford, M. (2009). Monolayer and Spheroid Culture of Human Liver Hepatocellular Carcinoma Cell Line Cells Demonstrate Distinct Global Gene Expression Patterns and Functional Phenotypes. Tissue Engineering Part A, 15(3), 559-567.
- Hartung, T. (2009). Toxicology for the twentyfirst century. Nature, 460(7252), 208-212.
- Kunz-Schughart, L. A. (2004). The Use of 3-D Cultures for High-Throughput Screening: The Multicellular Spheroid Model. Journal of Biomolecular Screening, 9(4), 273-285.
- Lu, J., Einhorn, S., Venkatarangan, L., Miller, M., Mann, D. A., Watkins, P. B., & Lecluyse, E. (2015). iPSCDerived Hepatocytes for In Vitro Toxicity Testing. Toxicological Sciences, 147(1), 39-54.
PDF版(英語)