Application Note iPSC由来3D神経共培養系における
神経毒性および神経活性化合物の機能的評価
- 生体内環境により近い高スループット3D培養プラットフォームを活用
- 神経機能および細胞毒性アッセイを特性評価
- 機能的・構造的・終末的エンドポイントを用いて、候補化合物の評価および神経毒性の解析を実施
PDF版(英語)
Oksana Sirenko, PhD|シニアアプリケーションサイエンティスト|モレキュラーデバイス社
Carole Crittenden|アプリケーションサイエンティスト|モレキュラーデバイス
Cassiano Carromeu, PhD|リード・ニューロサイエンティスト|StemoniX
はじめに
アッセイ開発や化合物スクリーニングにおいて、より複雑で生物学的に関連性が高く、予測性に優れた細胞ベースプラットフォームの活用に対する関心が高まっています。StemoniX® microBrain® 3D Assay Readyプレートは、高スループット対応の3D培養プラットフォームであり、ヒトの大脳皮質組織の発生過程や構成により近い環境を再現します。各スフェロイドは、単一ドナー由来の活性型皮質グルタミン酸作動性ニューロンおよびGABA作動性ニューロンとアストロサイトの混合細胞から構成されており、このバランスの取れた細胞構成により、シナプスが豊富な神経ネットワークが形成され、高度に機能的な神経回路が構築されます。microBrain 3Dスフェロイド内の神経細胞は生理学的に活性であり、自発的かつ同期的な神経活動がカルシウムオシレーションとして検出されます。
FLIPR® Tetra システムによる高速キネティック蛍光イメージングを用いて、カルシウム感受性色素を介した細胞内カルシウム濃度の変化を指標に、ニューロスフェロイドのカルシウムオシレーションのパターンおよび頻度を測定しました。NMDA、GABA、AMPA受容体のアゴニストおよびアンタゴニスト、ならびにカイニン酸、鎮痛薬、抗てんかん薬など、既知の神経調節因子を用いて試験を行いました。オシレーションパターンの抑制または活性化として変化が観察され、各神経調節因子の既知の作用と相関しました。
さらに、選定した農薬や難燃剤などの神経毒性化合物を用いて試験を行い、本アッセイが化合物の影響に対して高い感受性を示すことを確認しました。アッセイは384ウェルプレートでのハイスループットスクリーニングに最適化されており、ScreenWorks® Peak Pro™ ソフトウェアによる多変量解析を用いて、神経スフェロイドのオシレーションプロファイルを特性評価しました。自動測定された出力には、オシレーション速度、ピーク頻度、ピーク幅、振幅、波形の不規則性などが含まれます。
ImageXpress® Micro Confocal ハイコンテントイメージングシステムを用いたハイコンテントイメージングにより、化合物処理が細胞生存率およびミトコンドリアの健全性に与える影響を評価しました。各化合物によるCa²⁺オシレーション速度や細胞生存率への影響についてEC₅₀値を算出しました。本研究では、ヒトiPSC由来細胞から形成された3D神経スフェロイドを用いた機能的および形態学的アッセイが、候補化合物の評価および神経毒性解析において、カルシウムオシレーションとハイコンテントイメージングの両手法を活用できることを示しました。
材料
- StemoniX microBrain 3D Assay Ready 384 ウェルプレート(StemoniX)
- ソルボール™遠心機
- FLIPR Calcium 6 Assay Kit(モレキュラーデバイス、cat. #R8190)
- 生存率色素Calcein AM(Invitrogen)
- ミトコンドリア電位色素 MitoTracker Orange (Invitrogen)
- ヘキスト核色素(Invitrogen)
- FLIPR TetraシステムとScreenWorks Peak Proソフトウェア(モレキュラーデバイス)
- ImageXpress® Micro Confocal ハイコンテントイメージングシステムとMetaXpressハイコンテント画像取得・解析ソフトウェア(モレキュラーデバイス)
より複雑で生物学的関連性が高く、予測性に優れた細胞ベースプラットフォームの活用
StemoniX社より提供されたStemoniX microBrain 3D Assay Ready 384ウェルプレートは、高スループット対応の3D培養プラットフォームであり、ヒト脳組織の発生過程および構成により近い環境を再現します。このプラットフォームでは、直径約600 µmのヒトiPSC由来神経スフェロイドが用いられています。スフェロイドは、機能的に活性な皮質グルタミン酸作動性ニューロンおよびGABA作動性ニューロン(MAP2により同定;緑色)、ならびにアストロサイト(GFAPにより同定;赤色)からなる生理学的に関連性の高い共培養系で構成されており、図1に示すように観察されます。このバランスの取れた細胞構成により、シナプスが豊富な神経ネットワークが形成され、高度に機能的な神経回路が構築されます。microBrain 3Dスフェロイド内の神経細胞は生理学的に活性であり、自発的かつ同期的なカルシウムオシレーションが容易に検出可能です。この高度な神経プラットフォームは、384ウェルプレートでのハイスループットスクリーニングに最適化されており、ウェル間およびプレート間で一貫した高機能な性能を示します。
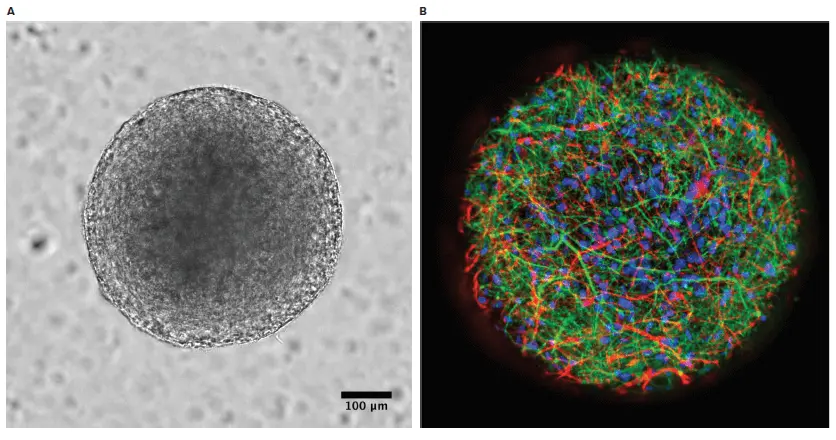
図1. StemoniX microBrain 3Dスフェロイドの明視野および免疫染色画像 A)明視野画像。B)免疫染色画像では、活性型皮質グルタミン酸作動性およびGABA作動性ニューロンがMAP2(緑)で、アストロサイトがGFAP(赤)で、核がDAPI(青)で同定されています。画像はImageXpress Micro Confocalシステムを用いて取得されました。
方法
3D神経培養のセットアップ
StemoniX microBrainプレートは常温下でプレプレート済みの状態で出荷されます。各ウェルには、8〜12週間成熟させた均一サイズのヒトiPSC由来皮質神経スフェロイドが1つ含まれています。到着当日、プレートを200 × gで5分間遠心し、スフェロイドがウェル底部に沈降していることを顕微鏡で確認後、70% エタノールで除染し、シールを除去しました。その後、培地を半量ずつ3回交換し、プレートを37°C、5% CO₂のインキュベーターに5〜7日間設置しました。培地交換は2日ごとに実施しました。
ワークフローの概要は図2に示されています。まず、透過光でウェルをイメージングし、スフェロイドの存在を確認しました。次に、スフェロイドにFLIPR™ Calcium 6染色液を添加し、FLIPR Tetraシステムでカルシウムオシレーションをイメージングしました。その後、細胞に化合物を添加し、細胞生存率を染色してImageXpress Micro Confocalシステムで解析を行いました。

図2. キネティックおよび細胞イメージング解析を活用した3D培養プラットフォームによる多変量ワークフロー 1)StemoniX microBrain® 3D Assay Ready 384ウェルプレートを培養後、ImageXpress Micro Confocalシステムにより透過光で観察しました。2)スフェロイドにカルシウム感受性色素および神経毒性化合物を添加し、処理後のカルシウムオシレーション速度の変化をFLIPR Tetraシステムで解析しました。3)染色した細胞を用いて、機能および生存率のスクリーニングをImageXpress Micro Confocalシステムで実施しました。
カルシウムフラックスアッセイによるカルシウムオシレーションへの初期影響の評価
ニューロン内のCa²⁺フラックスは、FLIPR Calcium 6キットを用いて評価しました(Sirenko, Grimmら 2017 *1 に準拠)。細胞内Ca²⁺フラックスのキネティクスは、FLIPR Tetraシステムにより、励起波長470–495 nm、蛍光検出波長515–575 nmで10分間、8 Hzの頻度で測定しました。露光時間は1回あたり0.05秒、ゲインは2000、励起強度は30%、装置温度は37°Cに維持されました。化合物曝露から60分後にカルシウムオシレーションへの初期影響を測定しました。初期タイムポイントの評価では、化合物添加の2時間前にFLIPR Calcium 6染色液を細胞にプレロードしました。化合物非添加時のベースラインは、通常、化合物添加前に測定されました。24時間試験では、化合物を適切な濃度で22時間曝露した後、FLIPR Calcium 6染色液(4倍濃度)を追加し、化合物濃度を維持するために追加量の化合物も加え、さらに2時間インキュベートしました。定量的データ評価には、ScreenWorksソフトウェアを用いて、以下の代表的な指標を算出しました:ピーク数(10分あたり)、平均ピーク振幅、平均ピーク幅(振幅の10%時点)、平均ピーク間隔(ピーク間の時間)、平均ピーク立ち上がり時間(10%から90%振幅まで)、平均ピーク減衰時間(90%から10%振幅まで)。
ライブ細胞染色による表現型変化の評価
細胞は以下の3種類の染色液でライブ染色しました:生存率染色:Calcein AM(1 µM)、ミトコンドリア膜電位染色:MitoTracker Orange(0.2 µM)、核染色:Hoechst(2 µM)。神経特異的マーカーの評価には、細胞を**4%ホルムアルデヒド(Sigma)**で固定し、**抗MAP2抗体および抗GFAP抗体(BD Biosciences)**で染色しました。
ハイスループット3Dイメージングと解析による神経毒性の評価
スフェロイドはImageXpress Micro Confocalシステムを用い、10X Plan Fluor対物レンズでイメージングしました。スフェロイドアッセイの取得条件は、Sirenko, Mitloら 2015 *2 に準拠しています。各スフェロイドについて、ウェル底部から開始し、光が透過可能な領域(深さ約100–150 µm)をカバーするように、10–15 µm間隔で19枚のZスタック画像を取得しました。すべての画像は保存され、3D解析および2D投影(最大投影)解析に使用されました。画像解析は、MetaXpress® ハイコンテントイメージ取得・解析ソフトウェアのカスタムモジュールエディタを用いて実施しました。解析手法はSirenko, Mitloら 2015 *2に準拠しています。さらに、追加の多変量出力を得るために、MetaXpressのカスタムモジュールエディタでプロトコールを作成し、以下の手順で解析を行いました:1)スフェロイドの同定、2)Calcein AMシグナルにより生存細胞数の同定、3)MitoTracker Orange染色によりミトコンドリアが健常な細胞数の同定、4)Calcein AMシグナルの欠如または減少により死細胞の同定。同様の手法は、Sirenko, Hancockほか 2016 *3で記載されているように、神経毒性評価および3D画像解析による定量的測定にも応用可能です。
結果
神経調節因子によるカルシウムオシレーションへの影響
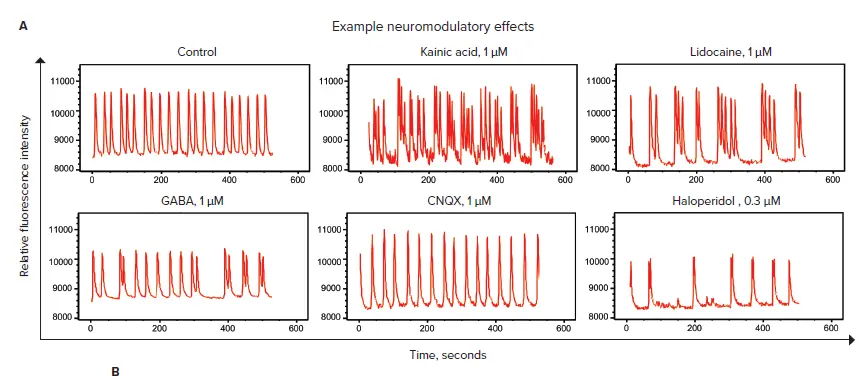
microBrain 3Dスフェロイド内の神経細胞は、自発的かつ同期的なカルシウムオシレーションを生成します。FLIPR Tetraシステムによるキネティック蛍光イメージングを用いて、FLIPR Calcium 6染色液で2時間インキュベート後の細胞内Ca²⁺濃度変化を指標に、ニューロスフェロイドのCa²⁺オシレーションのパターンおよび頻度を測定しました。NMDA、GABA、カイニン酸受容体のアゴニストおよびアンタゴニストを含む、既知の神経調節因子を用いて試験を行いました。化合物添加後1時間のインキュベーションを経て、10分間にわたるスフェロイドのオシレーション頻度を測定しました。6種類の化合物によるオシレーションパターンの一部を図3Aに示します。コントロールと比較した際のオシレーションパターンの違いにご注目ください。各化合物のIC₅₀値および作用機序は図3Bに示されています。
| 化合物 | 作用機序 | カルシウムオシレーションへの影響 (IC50, mM) |
|---|---|---|
| コントロール | NA | |
| カイニン酸 | カイニン酸受容体作動薬 | 2.66 |
| リドカイン | Na+チャネル遮断薬 | 9.47 |
| GABA | GABA作動薬および内因性抑制性神経伝達物質 | 5.93 |
| CNQX | カイニン酸受容体拮抗薬 | 2.05 |
| ハロペリドール | D2拮抗薬およびNMDAサブ拮抗薬 | 0.13 |
図3. 神経活性化合物の評価 A)FLIPR Tetraシステムで評価した、10分間にわたるカルシウムオシレーションのサンプルトレース。スフェロイドは、FLIPR Calcium 6染色液で2時間、化合物で1時間インキュベートされました。B)各化合物の作用機序およびIC₅₀値は、10分間のピーク速度に基づく濃度反応曲線を4パラメータフィットで解析して算出しました。
神経毒性作用の評価
多くの工業化学物質や環境化学物質は、ヒトに対する神経毒性の報告があります。本手法は、カルシウムオシレーションパターンおよび細胞生存率の変化を評価することで、化合物の神経毒性の可能性をスクリーニングするために使用できます。神経毒性の評価では、ニューロスフェロイドを既知の神経毒性化合物とともに24時間インキュベートし、その後FLIPR Calcium 6染色液で2時間染色しました。
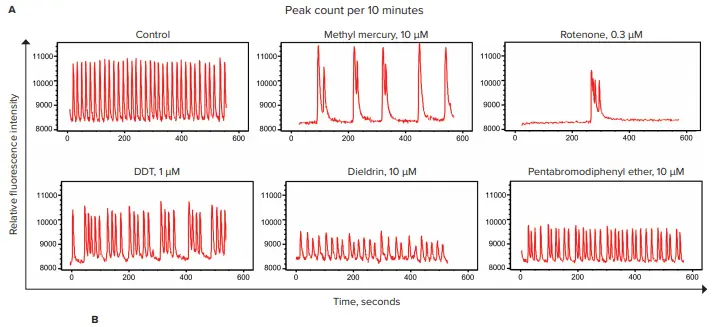
カルシウムオシレーションはFLIPR Tetraシステムで測定されました。データの一部を図4に示します。コントロールと比較して、神経毒性化合物はカルシウムオシレーションパターンに変化を引き起こしました。特に、ピーク頻度の低下やシグナル振幅の著しい減少が、対象化合物で処理されたサンプルで観察されました。
| 化合物 | 作用機序 | カルシウムオシレーションへの影響 (IC50, mM) |
|---|---|---|
| コントロール | NA | |
| メチル水銀 | 生物蓄積性環境毒 | <0.1 |
| ロテノン | 殺虫剤 | <0.1 |
| DDT | 殺虫剤 | 3.37 |
| ディルドリン | 殺虫剤 | 3.43 |
| ペンタブロモジフェニルエーテル | 難燃剤、環境汚染物質 |
4.33 |
図4. 農薬、工業化合物、難燃剤による神経毒性影響の評価 A)FLIPR Tetraシステムで評価した10分間のサンプルトレース。選定された神経毒性化合物を、iPSC由来microBrainニューロスフェロイドとともに22時間インキュベートし、さらにFLIPR Calcium 6染色液を化合物とともに2時間インキュベートしました。カルシウムオシレーションは10分間記録されました。B)表には化学物質の分類とIC₅₀値が記載されており、10分間のピーク速度に基づく濃度反応曲線を4パラメータカーブフィットで解析して算出しました。
ハイコンテントイメージングによる細胞生存率およびミトコンドリア健全性の評価
共焦点イメージングおよび3D画像解析手法を用いて、3D神経スフェロイドに対する化合物の形態および生存率への影響を特性評価しました。細胞毒性の評価では、細胞を各種化合物で24時間処理し、その後Hoechst核染色液、Calcein AM、MitoTracker Orange染色液でライブ染色を行いました。スフェロイドはImageXpress Micro Confocalシステムを用いて、DAPI、FITC、TRITCチャンネルおよび10X対物レンズでイメージングされました。コントロールスフェロイドおよび環境毒素であるメチル水銀で処理したスフェロイドの画像を図5に示します。画像解析はMetaXpressソフトウェアのカスタムモジュールエディタを用いて実施しました。1)スフェロイドの同定 2)Calcein AMシグナルにより生存細胞数の同定 3)MitoTracker Orange染色によりミトコンドリアが健常な細胞数の同定 4)Calcein AMシグナルの欠如または減少により死細胞の同定。
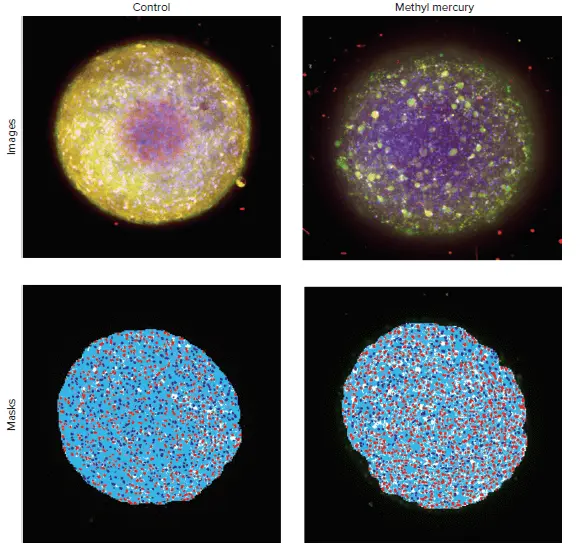
図5. コントロールスフェロイドおよび1 mMメチル水銀処理スフェロイドの最大投影画像 核は青、Calcein AM染色は緑、ミトコンドリア染色はオレンジで表示されています。画像解析マスクには、スフェロイド(白)、ミトコンドリア染色陽性細胞の核(濃青)、ミトコンドリア染色陰性細胞の核(赤)、陽性細胞の細胞質(淡青)が含まれています。上記の例では、未処理スフェロイドには608個の陽性細胞(ミトコンドリア健常)が存在しましたが、メチル水銀処理スフェロイドでは陽性細胞数が228個に減少しました。
結論
本研究では、ニューロスフェロイドが神経毒性影響の評価に応答性を示すことを確認し、さまざまな化合物の神経毒性評価に活用可能であることを示しました。また、本アッセイはハイスループットフォーマットに適応可能であり、化合物スクリーニングにも有用です。
多変量解析により、試験化合物が神経活動、細胞形態、生存率に与える影響を評価するための有益な出力が得られました。神経毒性評価に用いた表現型指標には、カルシウムオシレーションのピーク数、振幅、間隔、ピーク幅、ならびにCalcein AMまたはMitoTracker Orange陽性細胞数が含まれます。 各出力に対する化合物の有効濃度を算出することで、神経毒性の潜在的リスクに基づく化合物のランキングが可能となります。本手法は、医薬品、農薬、難燃剤、多環芳香族炭化水素など、さまざまな化学物質クラスの代表的化合物を含むライブラリーからの毒性影響評価に活用されました。
参考文献
- Sirenko, O., Grimm, F. A., Ryan, K. R., Iwata, Y., Chiu, W. A., Parham, F., Wignall, J. A., Anson, B., Cromwell, E. F., Behl, M.,et al. (2017). In vitro cardiotoxicity assessment of environmental chemicals using an organotypic human induced pluripotent stem cell-derived model. Toxicol. Appl. Pharmacol. 322, 60–74.
- Sirenko, O., Mitlo, T., Hesley, J., Luke, S., Owens, W., and Cromwell, E. F. (2015). High-content assays for characterizing the viability and morphology of 3D cancer spheroid cultures. Assay Drug Dev. Technol. 13, 402–414.
- Sirenko, O., Hancock, M. K., Hesley, J., Dihui, H., Avrum, C., Jason, G., Carlson, C. B., and Mann, D. (2016). Phenotypic characterization of toxic compound effects on liver spheroids derived from iPSC using confocal imaging and three-dimensional image analysis. Assay Drug Dev. Technol. 14, 381–394.
その他の情報については、以下の論文を参照してください。
- Sirenko, O., Parham, F., Dea, S., Carromeu, C., et.al (2018). Functional and Mechanistic Neurotoxicity Profiling Using Human iPSC-Derived Neural 3D Cultures. Toxicological Sciences 167(1).
- Anson, B. D., Kolaja, K. L., and Kamp, T. J. (2011). Opportunities for use of human iPS cells in predictive toxicology. Clin. Pharmacol. Ther. 89, 754–758.
- Camp, J. G., Badsha, F., Florio, M., Kanton, S., Gerber, T., WilschBräuninger, L. E., Sykes, A., Hevers, W., and Lancaster, M. (2015). Human cerebral organoids recapitulate gene expression programs of fetal neocortex development. Proc. Natl. Acad. Sci. U.S.A. 112, 15672–15677.
PDF版(英語)