Application Note マウスES細胞とエンブリオイドボディの
蛍光・レーザー散乱イメージング
PDF版(英語)
はじめに

胚性幹(ES)細胞は、体内のあらゆる種類の細胞や組織を形成する能力を持ち、胚発生や細胞分化の分子基盤を理解するための重要なツールです。ES細胞から分化を誘導する最も一般的な方法は、懸濁培養でエンブリオイドボディ(EB)と呼ばれる凝集体を形成することです。凝集体内の細胞群は、さまざまな組織に分化することが示されています。自己複製と分化のシグナルは集中的な研究対象であり、特定の分化経路を活性化するプロトコールが開発されています。分化した細胞系統を分離、特性評価、精製するための手法を開発する能力は、細胞を識別する能力に依存します。本レポートでは、レーザー散乱および蛍光イメージング用の独自光学系を備えた ImageXpress® Velos システムが、この用途に非常に適していることを示します。
材料と方法
マウスE14 ES細胞およびEBは、ImageXpress Velosシステム(Blueshift Biotechnologies, Inc.)での評価のためにUCSFのDr. R. Peraの研究室から提供されました。E14 ES細胞は、E14培地(Glasgow MEM)に2mMグルタミン、1mMピルビン酸ナトリウム、1x非必須アミノ酸、10%FBS、1x BMEを含み、500mlの培地に対して500µlのESGRO(LIF)を補充して培養しました。E14 ES株はゼラチンコートされたT-25フラスコで培養し、XX-ES株は照射済みマウス胚線維芽細胞(mEFs)上で培養しました。E14 ES株のPmaxGFP(E14-GFP)はCMVプロモーターからGFPを発現しました。XX-ES株には、マウスEBで発現するDazl-GFP系統特異的コンストラクトが含まれています。E14コントロール、E14-GFP、およびXX株(Dazl-GFP)を用いて形成されたEBは、6ウェルTCマルチウェルプレートで懸濁状態のままImageXpress Velos™でスキャンしました。
ImageXpress Velos:ImageXpress Velosシステムのレーザースキャニングプラットフォームは、以下のバンドパスフィルターを用いた3チャンネル取得に設定しました:Ch1: 510–540nm(緑)、Ch2: 450–490nm(レーザー散乱)、Ch3: 560–610nm(オレンジ)。初期の画像取得は10×10µmのサンプリング(ピクセル)サイズで行い、6ウェルプレート全体をスキャンしました。定義されたスキャン領域を含む選択ウェルは、5×5µmおよび2.5×2.5µmのサンプリングでスキャンしました。画像はBlueImageソフトウェアを用いてオブジェクトの識別とカウントを行いました。
結果
Dazl-GFP ES株と陰性コントロールES細胞をmEF上で培養し、スキャンしました。陰性コントロールES細胞は、散乱画像で良好なコロニー形態を示し、緑チャンネルでは非常に弱いシグナルを示しました。Dazl-GFP細胞は散乱画像で同様の形態を示し、緑画像では強いシグナルを示しました。特筆すべきは、散乱画像がコロニーの成長を検出するのに十分な解像度を持っていたことです(図1)。
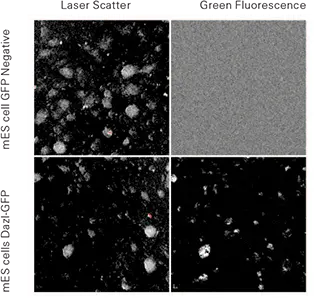
図1. マウスES細胞をマウス胚フィーダー(mEFs)上で培養 上段:Ch2散乱(左)とCh1緑蛍光(右)、GFP陰性株。下段:Ch2散乱(左)とCh1緑蛍光(右)、Dazl-GFP発現株。画像は2.5µmサンプリングで、細胞は6ウェルTCプレート内にあります。
E14-GFP ES細胞を分化培地に懸濁し、各ウェルに2mlを添加、EBの懸濁培養を3日間分化させた後、ImageXpress Velosシステムでスキャンしました。図2は、E14-GFPの3日目EBの5×5µm散乱画像を示します。レーザー散乱画像はEB内の光学的暗部と、TCグレード6ウェルプレートで得られる典型的な画像品質を示しています。緑蛍光と散乱画像の比較により、ImageXpress Velosシステムの独自光学系がEB内の蛍光シグナル検出を可能にしていることが示されました。これは、蛍光シグナルがレーザービームの焦点に沿って生成されるためです。この結果は、蛍光シグナルを持つ細胞を含むEBの識別に、この組み合わせが利用できることを示唆しています。緑GFPとオレンジ画像の比較により、GFP発光がオレンジチャンネルでも観察されることが確認されました。

図2. 6ウェルTCプレート内のエンブリオイドボディのクラスター
GFP発現を自家蛍光シグナルから識別する能力を評価し、直接比較を行うため、陰性コントロールEB(GFPなし)を、Dazl-GFPトランスジーンを含む3日目EBのウェルに追加しました。GFP陰性コントロールEBは、Dazl-GFP EBよりも弱い緑発光を示し、平均蛍光は陰性コントロールの約2.5倍明るくなりました。オレンジ発光チャンネルでは、Dazl-GFP EBは陰性コントロールEBより約1.9倍明るくなりました。緑の平均蛍光とオレンジの平均蛍光の散布図は、比率により自家蛍光を持つEBとGFP発現EBを識別できることを示しました(図3)。特筆すべきは、外れ値が存在することであり、弱いGFP発現を自家蛍光シグナルから識別する能力を評価するにはさらなる研究が必要です。
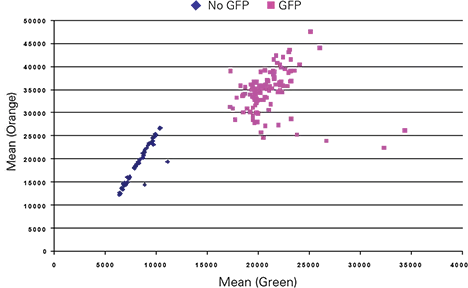
図3. 粒子解析によるCh1緑蛍光とCh3オレンジ蛍光の平均値の散布図。緑とオレンジの比率により、GFP非発現EBとDazl-GFP EBを識別しました。
E14-GFPとE14コントロールEBを1:1で混合し、8日間分化培養した後、画像を2.5µmサンプリングで取得しました。これらの画像を用いてBlueImage解析を行い、散乱シグナルに基づくしきい値処理でEBをオブジェクトとして識別し、EB特異的な蛍光パラメータを生成しました。緑とオレンジのEB解析は最大蛍光値を用いてプロットしました(図4)。プロットの比較により、最大蛍光値がGFP非発現EBとGFP発現E14-GFP EBを明確に区別することが示されました。データは定義されたROI(関心領域)を使用して生成され、合計64個のEBがオブジェクトとして識別・分類されました。64個のEBのうち、28個は最大緑蛍光値が10,000相対蛍光単位(RFU)を超えていました。
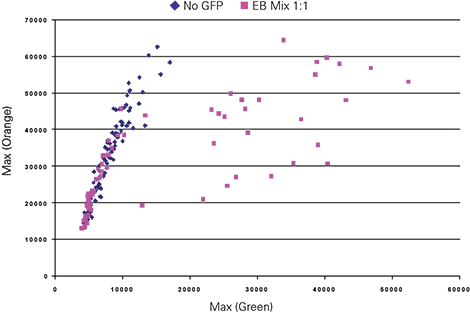
図4. 最大蛍光値を用いた粒子解析によるCh1緑蛍光とCh3オレンジ蛍光の散布図。緑とオレンジの比率により、GFP非発現EBとE14-GFP EBを識別しました。
次に、E14-GFPとE14コントロールES細胞を1:1000の比率で混合し、8日間分化させてEBを形成しました。EBは2.5µmサンプリングでスキャンし、BlueImage解析プログラムを用いて散乱画像でEBを識別し、その内部の蛍光オブジェクトをカウントすることを目的としました。緑とオレンジの最大蛍光値をプロットし、1つのオブジェクトが追加解析のために識別されました(図5 上部;緑枠のデータポイント)。x,y位置パラメータを用いて、散乱画像内のオブジェクトと対応する緑およびオレンジ画像を特定しました(図5 下部)。
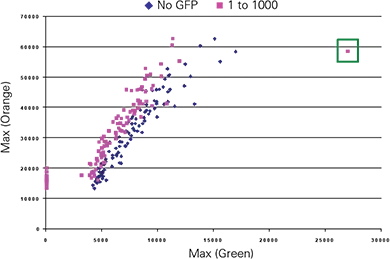
図5. E14-GFPとE14コントロールES細胞を1:1000で混合して形成されたEBにおけるGFP発現の検出。画像は2.5µmサンプリングで取得し、散乱画像のしきい値処理と緑蛍光測定を行いました。上部グラフ:最大蛍光値によるCh1緑蛍光とCh3オレンジ蛍光のEB解析の散布図。緑枠のデータポイントと、分類パラメータで識別された対応オブジェクト(下部パネル)。下部パネル:散乱画像と選択されたEB(選択枠)、および緑・オレンジ蛍光画像で対応する領域。選択されたEBの直径は約400µm、緑蛍光領域は約800µm²。
PDF版(英語)