Application Note ライブセルアッセイを用いた細胞周期阻害剤の評価
- 最大72時間、装置内でライブセルを維持可能
- 作業時間を最小限に抑制
- 明視野イメージング画像を用いて細胞をセグメント化
- 細胞周期センサーをトランスフェクションした細胞を分類
PDF版(英語)
はじめに
細胞周期に対する化合物処理の影響をモニタリングすることは、がん研究や創薬の進展において特に重要です。たとえば、有糸分裂を阻害することが知られている化合物は、がん細胞の分裂を抑制する目的で使用されることがあります。ライブセルを用いたハイコンテントスクリーニングアッセイでは、細胞周期の各段階に応じて細胞を分類することが可能です。この技術では、BacMamデリバリーシステムを用いて、細胞周期により制御される2種類の蛍光融合タンパク質を一過的にトランスフェクションします。
このタイムラプスアッセイは、環境制御機能を備えたImageXpress® Micro ハイコンテントイメージングシステム内で2〜3日間実施され、実験期間中、ライブセルの状態が維持されました。指定された時間間隔で、明視野および蛍光イメージング画像が取得されました。ワークフロー全体には、タイムラプス画像の自動解析が含まれており、統合されたソフトウェア解析モジュールにより、明視野画像からすべての細胞を識別し、蛍光タンパク質の発現に基づいて各細胞を細胞周期の段階ごとに分類します。
細胞周期段階を示す蛍光タンパク質の可視化
細胞周期は、Thermo Fisher社のPremo™ FUCCI Cell Cycle Sensor試薬を用いて時間経過に沿ってモニタリングされました。播種直前に、細胞周期制御タンパク質であるgemininおよびCdt1を蛍光標識してトランスフェクションしました。Geminin-emerald GFPはFITC波長で、Cdt1-tagRFPはTRITC波長で蛍光を発します。Cdt1とgemininは細胞周期の特定の段階でのみ存在するため、核内での発現をもとに細胞周期段階を分類することができます(図1)。
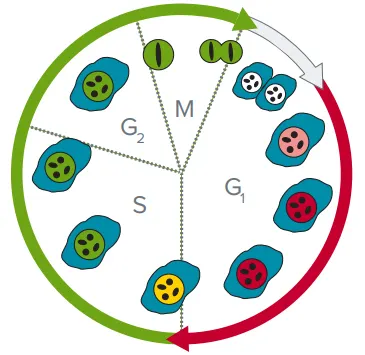
図1. FUCCI Cell Cycle Sensorによる蛍光変化の例 G₁期の細胞はCdt1-RFP(赤)を発現し、G₂/M期の細胞はGeminin-GFP(緑)を発現します。S期の細胞は両方を発現し、黄色に見えます。
方法
- HeLa細胞(40,000 cells/mL)を、各FUCCI試薬を30 particles/cellの割合で混合し、96ウェルプレートに1ウェルあたり4,000細胞の密度で播種しました。プレートは37°C、CO₂ 5%の条件下で約8時間インキュベートし、細胞の接着を促しました。
- その後、細胞分裂阻害剤を各濃度で処理し、プレートをImageXpress Microシステムにセットしました。
- イメージングは20X Plan Apo対物レンズを用いて2〜3時間間隔で実施され、各時間点で明視野および蛍光波長(FITCおよびTRITC)で画像を取得しました。細胞が1〜2回分裂するまで、48〜72時間のタイムラプスイメージングを行いました。
- 取得したタイムラプス画像は、MetaXpress® 画像取得・解析ソフトウェアのCustom Module Editorで解析されました。
明視野画像による細胞の識別と蛍光センサーによる分類
FUCCI細胞周期センサーを用いることで、化合物処理中の細胞周期段階の変化を時間経過に沿って測定でき、固定エンドポイント解析よりも多くの情報が得られます。FUCCIセンサーをトランスフェクションしたHeLa細胞のタイムラプス画像は、MetaXpress解析モジュールで解析され、明視野画像から細胞を識別し、核内の蛍光発現に基づいて分類されました。G₁期の細胞は赤色蛍光、G₂/M期は緑色蛍光、S期は赤+緑の蛍光を発します(図2)。G₀期の細胞は蛍光を発しませんが、明視野画像で検出され、総細胞数の解析に含まれます。さらに、希望すれば個々の細胞を時間経過に沿って追跡することも可能です。
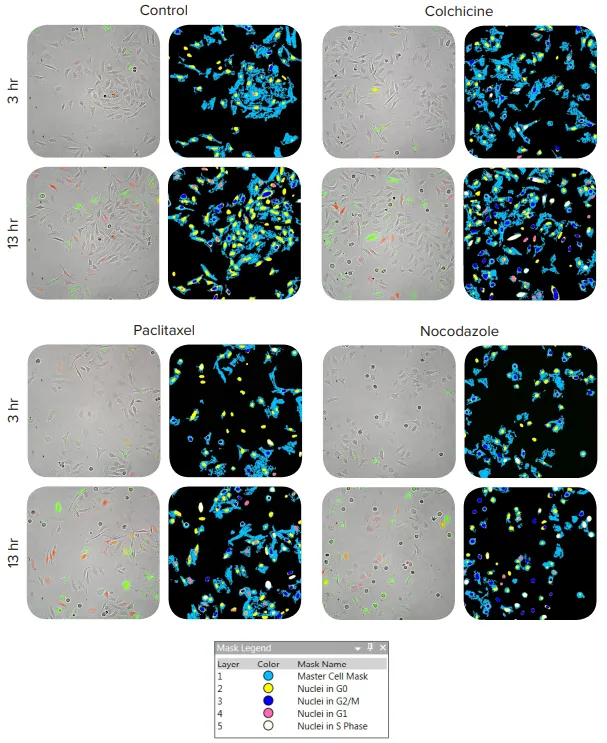
図2. FUCCIセンサーをトランスフェクションしたHeLa細胞のタイムラプス画像 MetaXpressソフトウェアモジュールにより、明視野画像から細胞を識別し、核内の蛍光発現に基づいてスコアリング:G₁=赤のみ、G₂/M=緑のみ、S=赤+緑、G₀=非蛍光。代表的なオーバーレイ画像は、Paclitaxel(2 nM)、Nocodazole(10 nM)、Colchicine(100 nM)処理後の2時間および6時間のタイムポイントから取得。セグメンテーションマスクにより、各細胞周期段階に分類された細胞が示されています。
細胞周期阻害剤は特定の段階で細胞を停止させます
各時間点の解析は、MetaXpress PowerCoreの並列処理機能により高速化されました。化合物処理24時間後、コントロールウェルの細胞の多くはG₀期にあり、細胞周期マーカーを発現している細胞はごくわずかでした。PaclitaxelおよびNocodazoleで処理された細胞では、G₂/M期にある細胞が多数確認され、タイムコース全体を通して細胞周期停止が維持されました(図3)。
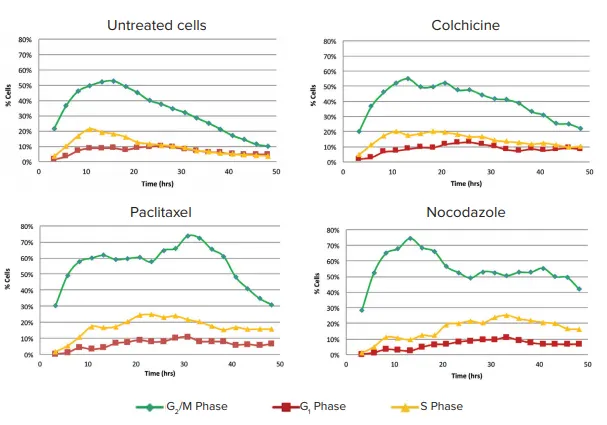
図3. 化合物処理による細胞周期段階への影響(48時間)Paclitaxel(2 nM)処理では、S期、G₂期、M期の細胞割合がコントロールと比較して有意に高くなりました。Colchicine(10 nM)処理では、G₂期およびM期の細胞割合が有意に増加。Nocodazole(100 nM)処理では、細胞分裂が著しく阻害され(実験期間中の細胞数の増加が見られない)、約半数の細胞がG₂/M期で停止しました。
まとめ
Premo™ FUCCI Cell Cycle Sensor試薬と、環境制御機能を備えたImageXpress MicroシステムおよびMetaXpressソフトウェアを組み合わせることで、ライブセルにおける細胞周期段階を高精度かつ効率的に測定することが可能です。このハイスループットスクリーニング技術は、細胞の健常性を維持しながら、細胞周期マーカーの画像ベース定量を迅速かつ高精度に実施できます。さらに、MetaXpressソフトウェアを用いることで、明視野画像の解析が可能となり、ライブセルに対する毒性のある染色の使用を回避できます。一貫性があり統計的に有意な定量解析により、複数の化合物を異なる濃度で評価することができ、あらゆる細胞周期アッセイの条件に適応可能です。
PDF版(英語)