Application Note SpectraMax i3xで行う
Dual-Luciferase Reporterアッセイ
- 6桁のリニアレンジで高感度なルシフェラーゼ活性の定量
- SoftMax Proソフトウェアによる正規化レポーター活性の自動データ解析と計算
- SmartInject™テクノロジーによる最適な結果を得るための試薬混合
PDF版(英語)
はじめに
レポーター遺伝子アッセイは、真核遺伝子の発現を研究するために使用されます。デュアルレポーター遺伝子アッセイでは、細胞に2種類のベクターを導入します。1つ目は、目的の調節プロモーターに結合した実験用レポーター遺伝子を含み、2つ目は構成的プロモーターに結合したコントロールレポーター遺伝子を含みます。実験用レポーターの活性をコントロールレポーターに正規化することで、実験のばらつきを最小限に抑えることができます。
ホタルおよびRenillaルシフェラーゼを用いた生物発光レポーターシステムは、両方のアッセイが容易に実施でき、非常に高感度であるため、広く共レポーターとして使用されています。Promega社のDual-Luciferase® Reporter(DLR)アッセイシステムでは、1つのマイクロプレートウェル内でホタルとRenillaルシフェラーゼ活性を測定できます。ホタルは実験用レポーター、Renillaはコントロールとして機能します。図1は、同じアッセイウェル内で順次進行する2つの酵素反応を示しています。ホタルルシフェラーゼはルシフェリンの酸化を触媒し、光を放出します *1。この反応にはATP、Mg²⁺、O₂が必要です。Renillaルシフェラーゼは、コエレンテラートルシフェリン(コエレンテラジン)のO₂依存的酸化を触媒しますが、Mg²⁺やATPは必要ありません *2。両酵素は異なる基質要件を持つため、同じ反応混合液で測定可能です。
DLRアッセイでは、異なる基質を含む2種類の試薬を順次注入し、それぞれ発光測定を行う必要があります。このワークフローは、SpectraMax i3x マルチモードマイクロプレートリーダーとSpectraMaxインジェクターカートリッジを使用することで容易に実施できます。このシステムは完全にDL Ready認証済みです *3。本テクニカルノートでは、組換えホタルおよびRenillaルシフェラーゼにおいて6桁のリニアダイナミックレンジを示すとともに、195~25,000 cells/wellの範囲でルシフェラーゼ導入細胞のリニア検出を実証します。
材料
- Dual-Luciferase Reporter Assay System (Promega);内容は以下の通り:
◦iferase Assay Buffer II
◦ルシフェラーゼアッセイ基質
◦Stop & Glo Buffer
◦Stop & Glo 基質
◦5X Passive Lysis Buffer(パッシブ溶解バッファー - 精製リコンビナントルシフェラーゼ酵素
◦ホタルルシフェラーゼ QuantiLum ® Recombinant Luciferase (Promega)
◦ウミシイタケルシフェラーゼ 組換えウミシイタケ・ルシフェラーゼ(RayBiotech) - CHO-K1セル (ATCC)
- コントロールルシフェラーゼベクター
◦pGL4.13[luc2/SV40] ホタルルシフェラーゼベクター (Promega)
◦pGL4.74[hRluc/TK] ウミシイタケルシフェラーゼベクター (Promega) - FUGENE HDトランスフェクション試薬 (Promega)
- 6ウェル組織培養プレート (Corning)
- 96ウェルフラットクリアボトム白色TC処理マイクロプレート (Corning)
- BrightMax シーリングフィルム(Genesee)
- 96ウェルおよび384ウェルの白色マイクロプレート(Greiner)
- SpectraMax i3x マルチモードマイクロプレートリーダー
- SpectraMax インジェクターカートリッジ
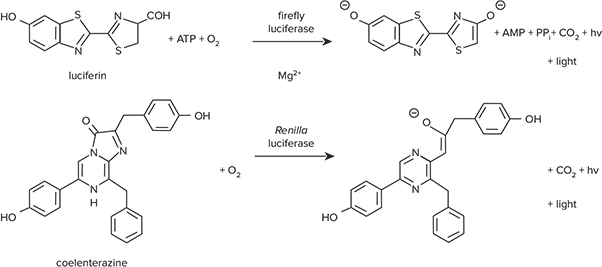
図1. ホタルおよびRenillaルシフェラーゼが触媒する反応 両酵素は異なる基質要件を持ちます。
方法
酵素標準曲線
ホタルルシフェラーゼのストック溶液は、提供された12.4 mg/mL溶液を1X Passive Lysis Buffer(PLB、Dual-Luciferase Reporterアッセイシステムの構成成分)で1 mg/mLに希釈し、1 mg/mL BSAを含めて調製しました。Renillaルシフェラーゼのストックは、凍結乾燥酵素を1X PBSで再構成し、1 mg/mLにしました。
ホタルおよびRenillaルシフェラーゼの作業溶液(10 µg/mL)は、ストック溶液(1 mg/mL)10 µLをPLB 990 µLに移して調製しました。次に、両ルシフェラーゼ作業溶液10 µLずつをPLB 980 µLに加え、各100 ng/mLの混合ルシフェラーゼ標準液を作製しました。この混合標準液を1:10で連続希釈し、100 fg/mL~100 ng/mL(1.6 fM~1.6 nM)の濃度範囲の標準液を得ました。Luciferase Assay Reagent II(LAR II)およびStop & Glo Reagentは、Dual-Luciferase Reporterアッセイシステムのテクニカルマニュアルに従って調製しました。
SpectraMaxインジェクターカートリッジのInjector 1には260 µLのLAR IIを、Injector 2には260 µLのStop & Glo Reagentを充填しました。SoftMax ProではAcquisition Viewを使用して、注入を含むプレートリードを設定しました(図2)。両インジェクターはSmartInjectテクノロジーを用いて、96ウェルプレートでは100 µL、384ウェルプレートでは25 µLの試薬を注入しました。SmartInjectは注入と同時にプレートをシェイクし、試薬を完全に混合します。その後、2秒のディレイと10秒の積分を行いました。各ルシフェラーゼ標準液は、96ウェルプレートでは20 µL、384ウェルプレートでは10 µLをアッセイウェルに分注しました。プレートをSpectraMax i3xプレートリーダーのプレートドロワーにセットし、測定を開始しました。データ解析とグラフ作成はSoftMax Proソフトウェアで行いました。SoftMax Proのプロトコールライブラリには、Dual-Luciferase Reporterアッセイの事前設定プロトコールが含まれています。
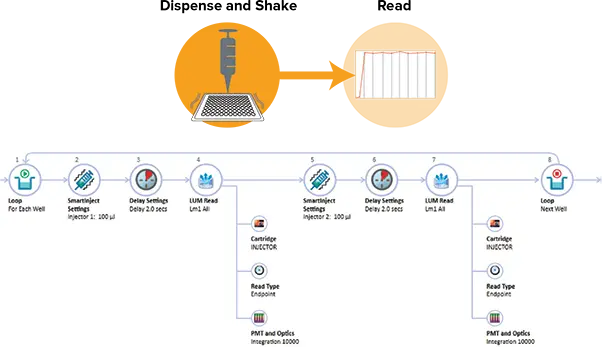
図2. DLRのAcquisitionプラン SoftMax ProのAcquisition Planエディターでは、各ウェルに適用する操作をドラッグ&ドロップで設定できます。上図はDLRアッセイの設定例です。2回の注入と測定ステップが適用されています。SmartInjectは、注入中および2秒のディレイ中にシェイクを行い、試薬を完全に混合し、ウェル間で一貫した信号を迅速に発現させます。
細胞ベースアッセイ
CHO-K1細胞を6ウェル培養プレートに2.5×10⁵ cells/wellで播種し、一晩培養しました。翌日、Fugene HDトランスフェクション試薬の標準プロトコールに従って、pGL4.13[luc2/SV40]ホタルルシフェラーゼベクターとpGL4.74[hRluc/TK] Renillaルシフェラーゼベクターを一過性に導入しました。導入比率はホタル:Renilla=10:1とし、各ウェルに合計1 µgのDNAと3 µLのFugene HDを添加しました。
トランスフェクション後24時間で、細胞を96ウェル白色TC処理済みフラットクリアボトムプレートに195~25,000 cells/wellの密度で播種し、一晩培養しました。その後、1X Passive Lysis Bufferで細胞を溶解し、Dual-Luciferase ReporterアッセイシステムとSpectraMax i3xプレートリーダー(インジェクターカートリッジ付き)を用いて同じプレートで測定しました。測定前に、発光信号の検出を最大化するため、プレート底面に白色シールを貼付しました。
結果
ルシフェラーゼ標準曲線
ホタルおよびRenillaルシフェラーゼの信号は、1.6 fM~1.6 nMの範囲で6桁のリニアレンジを示しました(図3)。96ウェルプレートでは1 fg~1 ng/well、384ウェルプレートでは0.5 fg~0.5 ng/wellに相当します。両フォーマットで同様のリニア性とダイナミックレンジが得られ、DLRアッセイとSpectraMax i3xシステムがどちらのフォーマットにも適していることが示されました。
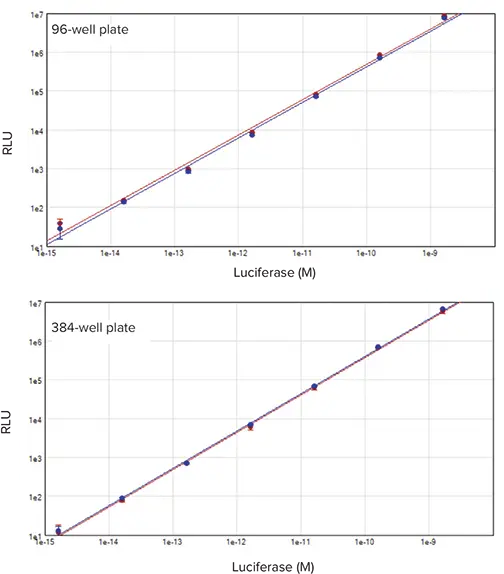
図3. 96ウェルおよび384ウェルのデュアルルシフェラーゼ標準曲線 精製組換えホタル(赤プロット)およびRenilla(青プロット)ルシフェラーゼをDLRシステムで測定しました。6桁のリニアレンジが確認されました(r² = 0.994)。上:96ウェルフォーマット、下:384ウェルフォーマット。
細胞ベースアッセイ
ホタルおよびRenillaルシフェラーゼの信号は、195~25,000 cells/wellの広範な細胞密度でリニア性を示しました(図4)。両酵素の発光信号の大きさの違いは、細胞導入時のホタル:Renillaベクター比率(10:1)およびSV40(ホタルベクター)とTK(Renillaベクター)プロモーターの強度差によるものです。
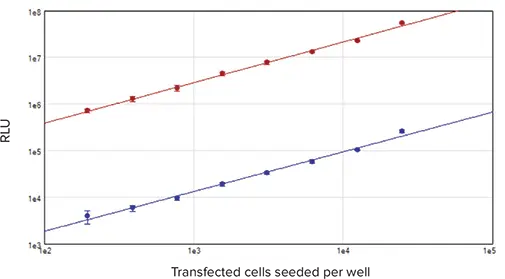
図4. 細胞ベース標準曲線 ホタルおよびRenillaルシフェラーゼを導入した細胞を96ウェルプレートに播種し、DLRシステムで測定しました。結果はRLUと播種細胞数の関係としてプロットしました。赤プロット:ホタルルシフェラーゼ信号、青プロット:Renillaルシフェラーゼ信号(r² = 0.99)。
図5は、ホタルルシフェラーゼのRLU値をRenillaルシフェラーゼのRLUで正規化した結果を示しています。正規化値は、全細胞密度範囲で類似していました。
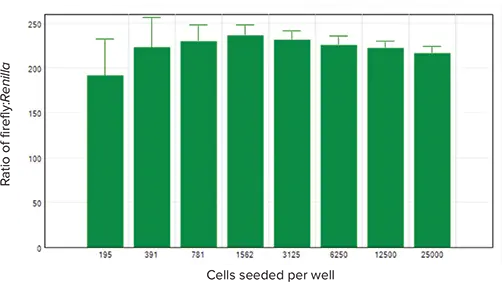
図5. トランスフェクト細胞のホタルルシフェラーゼ信号をRenillaルシフェラーゼ信号で正規化し、播種細胞数に対してグラフ化しました。
結論
本結果は、ホタルおよびRenillaルシフェラーゼでウェルあたり1 fg未満までの高感度検出と、6桁のダイナミックレンジを示し、広範な発現レベルおよび細胞密度で正確な測定が可能であることを示しています。
SpectraMax i3xプレートリーダーは、発光測定時の低バックグラウンドノイズを実現する冷却PMTを搭載しています。SpectraMaxインジェクターカートリッジと組み合わせることで、レポーター遺伝子アッセイを含む多様なフラッシュ型発光アプリケーションにおいて、卓越した感度とダイナミックレンジを提供します。解析は、SoftMax Proの事前設定プロトコールを使用することで迅速に行え、各ルシフェラーゼ値の表示と正規化比率の計算により、結果の解釈が容易になります。
参考文献
- DeLuca, M.A. and W.D. McElroy (1978) in Meth. Enzymol., 53:3.
- Matthews, J. C. et al. (1977). Purification and properties of Renilla reniformis luciferase. Biochemistry, 16:58.
- https://www.promega.com/products/pm/ dlready-luminometers/dlready-validatedluminometers
SpectraMax i3x マルチモードマイクロプレートリーダーの詳細はこちら >>
PDF版(英語)