Application Note がん患者由来オルガノイドで
疾患モデルを構築する方法
- 患者由来細胞を用いた疾患モデル化の実証
- 3Dマイクロティッシュの化合物処理とプロセスを自動化
- がんマイクロチューマーに対する化合物効果を多パラメータ解析で評価
PDF版(英語)
Matthew Hammer, Oksana Sirenko | モレキュラーデバイス
Evan F Cromwell | Protein Fluidics, Inc
Margarite Matossian, Matthew E Burow | Tulane University School of Medicine
はじめに
患者由来腫瘍組織の利用は、創薬およびターゲット探索研究の分野を変革し、腫瘍生物学を評価するためのトランスレーショナルツールであり、生理学的に関連性の高いシステムを提供しています。創薬においてより予測性の高いツールとして、2Dアッセイから3D細胞モデルシステムへの移行が進んでいます。これは、ヒトのin vivo環境をより正確に再現できるためです。その一例が、がん研究における患者由来オルガノイド(PDO)の利用です。PDOは腫瘍生検や外科手術から生成され、患者特異的な薬剤応答の理解やがん細胞増殖の研究に役立つモデルとなります。消化された腫瘍片や患者由来腫瘍から採取された細胞は、がん幹細胞(CSC)様の特性を示し、複数回の継代で増幅可能で、元の腫瘍の分子特性を保持した多数のオルガノイドを生成できます *1。 ここでは、患者由来腫瘍TU-BcX-4IC *2から単離した初代細胞で形成されたPDOを用いた乳がん疾患モデル化の結果を示します。TU-BcX-4ICは、稀な乳がんサブタイプであるメタプラスティック乳がん(MBC)を表し、トリプルネガティブ乳がん(TNBC)の組織学的サブタイプに分類されます。この腫瘍は、アドリアマイシン、シクロホスファミド、パクリタキセルを組み合わせたネオアジュバント療法にもかかわらず、術前に急速な増殖を示しました。PDOは、標的抗がん化合物の存在下で24~48時間インキュベートされ、その後、生存マーカーまたはE-カドヘリン/CD44マーカーで染色しました。実験で観察されたPDOの化学療法薬に対する耐性は、患者の腫瘍応答と一致していました。この作業を容易にするため、Pu·MA Systemとフローチップを使用し、ハイコンテントイメージングと組み合わせた半自動オルガノイドアッセイを実施しました。このマイクロ流体技術を用いた新しいアッセイ手法は、in vivo条件を模倣した3D細胞培養の自動化を可能にし、幅広いアッセイ検出モダリティを提供します。ここで説明する作業は、構造的に繊細な3Dシステムを試験するin vitro創薬研究におけるPu·MA Systemの有用性を示し、すべての固形腫瘍タイプに適用可能です。
Pu·MA Systemアッセイ
Pu·MA Systemフローチップは、チャンバーとリザーバーを便利なマルチウェルプレートフォーマット(384ウェル間隔)で配置し、1プレートあたり最大32のオルガノイドサンプルを提供します。腫瘍オルガノイドと試薬をフローチップにロードすると、プレートはPu·MA Systemにセットされ、保護されたサンプルチャンバーに接続されたマイクロ流体チャネルを介して試薬交換が自動的に行われます *3。
複数の試薬交換は、内蔵プログラムを使用したアッセイプロトコールで実行されます。アッセイプロトコールはシステムにプリロードされ、直感的なタッチスクリーンインターフェースで操作します。Pu·MA System全体はインキュベーターに設置でき、37°CおよびCO₂条件でアッセイを実行します(図1)。システム構造と流体移動に空気圧を使用することで、サンプルチャンバーへのガス交換が可能となり、セルヘルスを維持します。

図1. ハイコンテント3Dイメージングと組み合わせた半自動腫瘍オルガノイドアッセイワークフローの模式図

装置構成
Pu·MA Systemと3Dフローチップの特徴:
- 保護チャンバー内の細胞に対して自動メディア交換を実施
- 細胞分泌をモニタリングするために上清を採取可能
- 高感度メタボロミクス解析のためにin situで細胞を溶解可能
- スフェロイドはフローチップ内でイメージング可能、または免疫アッセイやメタボロミクス解析のためにサンプルを取り出し可能
アッセイプロトコールはPu·MA Systemソフトウェアで編集可能
ImageXpress® Micro Confocal ハイコンテントイメージングシステム
- 5色+透過光
- 環境制御
- 自動データ解析
システムはMetaXpress® ハイコンテント画像取得・解析ソフトウェアで制御されます。
腫瘍オルガノイド形成と染色
- 腫瘍オルガノイドは、初代腫瘍由来のTU-BcX-4IC細胞から形成されました。この腫瘍は、アドリアマイシン、シクロホスファミド、パクリタキセルを組み合わせたネオアジュバント療法にもかかわらず、術前に急速な増殖を示しました。
- 4IC細胞は腫瘍オルガノイドあたり約2,000細胞を分注し、72時間インキュベートして緊密な腫瘍オルガノイドを形成しました。腫瘍オルガノイドは、Pu·MA Systemフローチップ内での分注と配置を容易にするため、磁性ナノ粒子(NanoShuttle(NS)、Greiner Bio-One)でコーティングされました(図2)。
- 腫瘍オルガノイドは、図4に示すようにPu·MA Systemを用いて半自動的に処理および染色されました。このシステムは、生存率染色と免疫蛍光染色の両方に使用できます。
- 腫瘍オルガノイドは化合物で処理され、生存マーカーで染色され、ImageXpress Micro Confocalシステムでイメージングされました(図3)。画像スタックは、生細胞(calcein AM陽性)と死細胞(EthD-1陽性)の割合を解析しました(図6)。
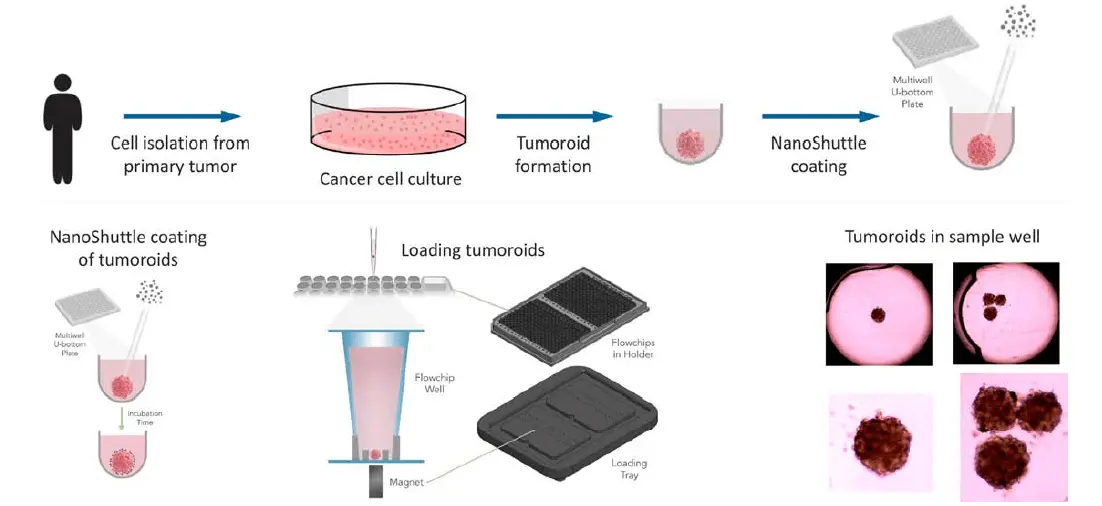
図2. 上:腫瘍オルガノイド形成のワークフロー。下:腫瘍オルガノイドの磁気ラベリングおよび配置プロトコールの模式図。右側には腫瘍オルガノイドの透過光画像を示します。NanoShuttle粒子による光学的アーティファクトはなく、腫瘍オルガノイドはウェル中央に配置されています。
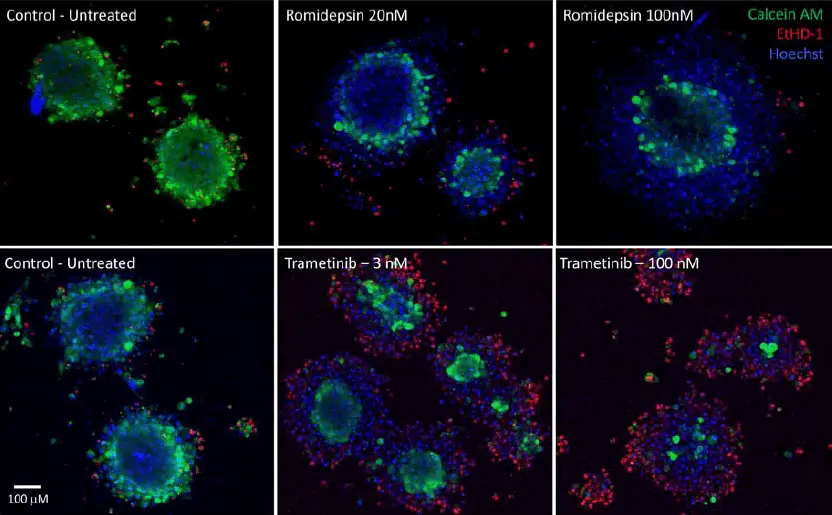
図3. Romidepsinで処理した腫瘍オルガノイド(上)とTrametinibで処理した腫瘍オルガノイド(下)の画像。画像は10X対物レンズで取得した共焦点スタックの最大投影像です。
マイクロ流体フローチップ技術
各Pu·MA Systemフローチップには、試薬ウェルがマイクロ流体チャネルで接続された8つのレーンがあります。4つのフローチップはホルダーに配置され、384ウェルプレートフォーマットで全ウェルを位置決めし、1アッセイあたり32サンプルを提供します。各レーンの化合物ウェルには、培地、化合物、または追加のアッセイ試薬を保持します。腫瘍オルガノイドはサンプルウェルに配置され、ウェル底部の保護チャンバーに位置します。これにより、試薬をサンプルウェルに出し入れしても、マイクロティッシュを乱したり乾燥させたりすることがありません。
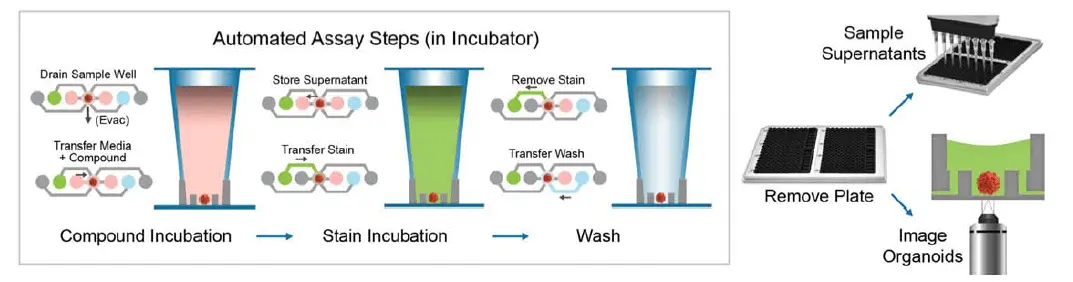
図4. 腫瘍オルガノイドアッセイのプロトコール手順。腫瘍オルガノイドは化合物で一晩処理され、その後、生存率染色(1 μM calcein AM、3 μM EthD-1、33 μM Hoechst 33342)またはE-CadherinおよびCD44に対する蛍光標識一次抗体(BD Biosciences)で染色されました。コンディションドメディアは追加解析のために除去可能です。
がん疾患モデル化
- TU-BcX-4ICスフェロイドは、NCI 60パネルの抗がん剤3種で24または48時間処理されました:
・Romidepsin – ヒストン脱アセチル化酵素(HDAC)阻害剤
・Trametinib – MEK1およびMEK2活性の選択的可逆的アロステリック阻害剤
・Paclitaxel – 微小管成長を阻害する有糸分裂阻害剤 - スフェロイドはPu·MA Systemで生存率および細胞表面バイオマーカーで染色され、ImageXpress Micro Confocalシステムでイメージングされました(図5)。画像スタックはCD44陽性細胞の割合を解析しました(図6)。
- Paclitaxelに対する腫瘍オルガノイドの低感受性は、患者腫瘍の臨床所見と一致していました。
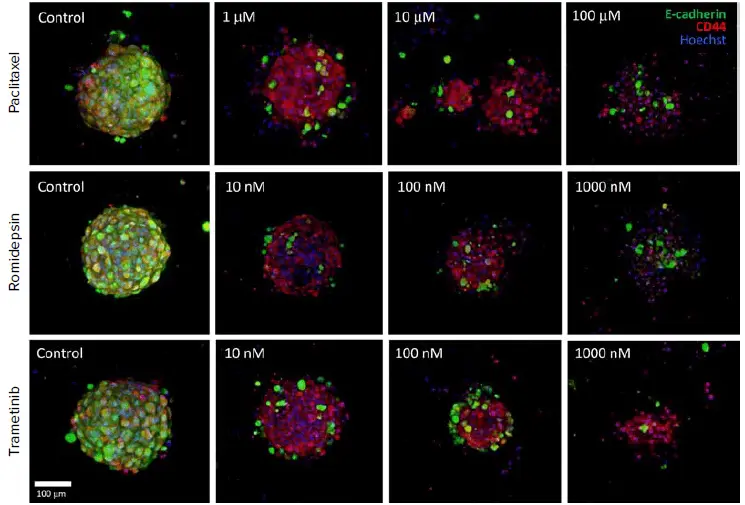
図5. 腫瘍オルガノイドは化合物で24時間インキュベートされ、E-Cadherin(緑)およびCD44(赤)でラベル化されました。画像は20X水浸対物レンズで取得した共焦点スタックの最大投影像です。処理によりE-Cadherinの喪失とオルガノイドの破壊が生じました。EC₅₀値はCD44陽性細胞の割合で測定されました。
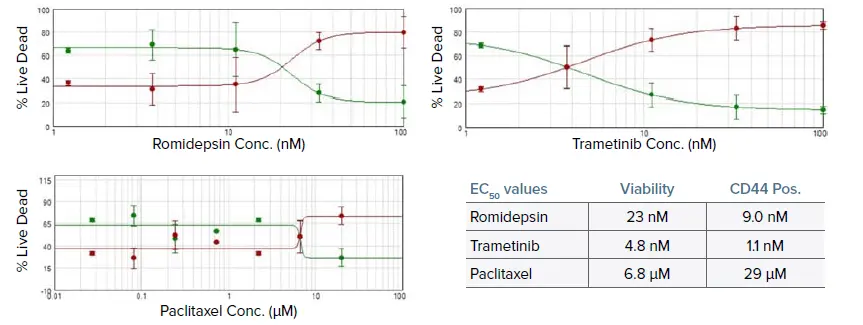
図6. Romidepsin、Trametinib、Paclitaxelで処理した腫瘍オルガノイドの生存率アッセイから得られた濃度応答曲線。EC₅₀値は、生存率染色およびCD44染色の両方から表に示されています。RomidepsinとTrametinibの値は正常範囲内である一方、Paclitaxelは有意に高値を示しました。これは患者腫瘍の治療応答と一致しています *2。
結論
- 私たちは、インキュベーター環境で3D細胞モデルを用いた複雑なプロトコールを実行できる新しい半自動腫瘍オルガノイドアッセイシステムの機能を実証しました。
- 初代腫瘍由来の患者腫瘍オルガノイドは、細胞表面マーカーの高解像度共焦点イメージングとLive/Dead染色による生存率評価を用いて化合物応答を解析しました。
- 腫瘍オルガノイドやオルガノイドをin situで解析し、毒性情報を取得し機能的アッセイを実施できる能力は、疾患モデル化に大きな可能性を示しています。
参考文献
- Drug resistance profiling if a new triple negative breast cancer patient-derived xenograft model. Matossian, M.D. et al (2019) 19(1): 205, BMC Cancer
- In-depth characterization of a new patient-derived xenograft model for metaplastic breast carcinoma to identify viable biologic targets and patterns of matrix evolution within rare tumor types. Matossian, M.D. et al (2021) Clin. & Trans. Oncology (in revision)
- Disease modeling with 3D cell-based assays using a novel flowchip system and high-content imaging. Cromwell, E.F. et al (2021) 26(3): 237, SLAS Technol.
- Three-dimensional tissue culture based on magnetic cell levitation. Souza, G.R. et al (2010) 5(4): 291, Nat. Nanotechnol.
- High-Content Assays for Characterizing the Viability and Morphology of 3D Cancer Spheroid Cultures. Sirenko, O. et al (2015) 13, 402, Assay and Drug Dev. Tech.
PDF版(英語)