Application Note タンパク質解析を効率化する
ScanLaterウェスタンブロット検出システム
- Western blotプロトコールは、二次抗体とのインキュベーションを除き変更はありません
- 基質は不要です
- Europium標識二次抗体を用いたTRF検出により、バックグラウンドを低減しながらダイナミックレンジを拡大します
- デジタルフォトンカウントにより、変化のないTRFカウントを提供します
- Europiumはフォトブリーチングに耐性があり、数週間安定しているため、ブロットの再利用が可能です
PDF版(英語)
はじめに
タンパク質の検出は、現在の製薬および臨床研究において重要であり、そのために最も一般的に使用される方法のひとつがウェスタンブロットです。ウェスタンブロットメンブレン上のタンパク質検出には、蛍光や化学発光などさまざまな技術が用いられています。しかし、各技術には制約があり、定量性、精度、ダイナミックレンジの改善が求められています。ここでは、SpectraMax® i3およびSpectraMax® Paradigm® マルチモードマイクロプレートリーダーに組み込まれた新しいウェスタンブロットメンブレンタンパク質解析システムをご紹介します。本システムは、バックグラウンドの低減によるダイナミックレンジの拡張に加え、時間経過や複数回の測定における検出の安定性を実証しました。さらに、ScanLaterウェスタンブロット検出システムと化学発光法の比較により、感度の向上も確認されています。
アッセイ原理
ScanLaterウェスタンブロット検出システムのワークフローは、二次抗体インキュベーションステップまで標準的なゲルロードおよびブロッティング手法に従います。メンブレンは、目的タンパク質に結合した一次抗体に特異的に結合するEuropiumキレート標識二次抗体またはストレプトアビジンとインキュベートされます(図1)。
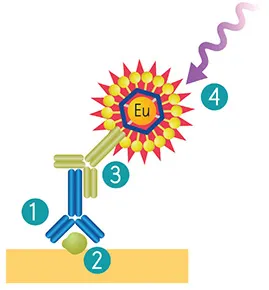
図1. ScanLaterウェスタンブロット検出システムのワークフロー 既存の一次抗体(1)を使用して目的タンパク質(2)に結合。Eu標識ScanLater二次抗体(3)が一次抗体に結合。ScanLater TRFウェスタンブロット検出カートリッジ(4)で検出。
画像は、蛍光寿命1 msを持つEuropium(Eu)の時間分解蛍光(TRF)モード検出を利用して生成されます。これにより、自家蛍光や短寿命発光源からのバックグラウンドが大幅に低減されます。化学発光や標準蛍光検出でよく見られるカメラブルーミングは発生せず、鮮明なバンドと優れた画像品質を提供します。
この方法は酵素検出を伴わず、Euキレートはフォトブリーチングに耐性があります。そのため、シグナルは数週間から数か月間安定し、メンブレンの再測定が可能となり、より正確な定量化を実現します。ScanLaterウェスタンブロット検出システムは、マルチモードプレートリーダーで優れたタンパク質解析を提供する、シンプルで高感度かつ安定したプラットフォームです。
SoftMax Proソフトウェアによるウェスタンブロットデータ解析
すべての実験は、SpectraMax i3またはSpectraMax Paradigm マルチモードマイクロプレートリーダー用のScanLaterウェスタンブロット検出システムを使用して実施しました。マイクロプレート検出システムを使用することで、明確な利点があります。まず、デジタルフォトンカウントにより、TRFカウントが未加工データとして提供され、改変されることはありません。画像はSoftMax® Proソフトウェアで最適化および保存できます。未加工カウントは、統合されたExcelマクロスプレッドシートに直接エクスポートして解析・定量化することも可能です。あるいは、ImageJに直接エクスポートして解析することもできます。
感度とダイナミックレンジ
本システムの感度とダイナミックレンジは、グルタチオンS-トランスフェラーゼ(GST)を用いてテストしました。GSTを1xランニングバッファで3倍希釈系列に調製し、4-20%グラジエントゲルにロードして30分間泳動しました。タンパク質はImmobilon FLメンブレンに転写され、ビオチン標識ウサギ抗GSTで2時間プローブした後、ScanLater Eu標識ストレプトアビジンで1時間インキュベートしました。ブロットは洗浄、乾燥後、SpectraMax Paradigmプレートリーダーでスキャンしました(図2)。本システムは、GSTのサブピコグラム検出限界を示し、シグナル量とGST量の間で4ログ以上の正の応答を実証しました(図3)。
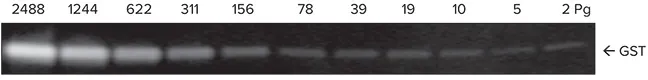
図2. SpectraMax ParadigmプレートリーダーでスキャンしたGST希釈系列の画像
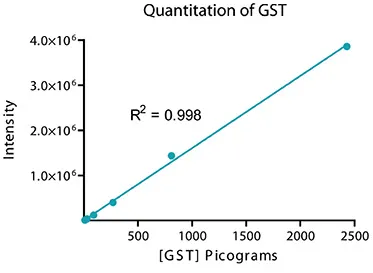
図3. 図2に示した各バンドの統合強度をSoftMax Pro統合Excelマクロで解析し、総ダイナミックレンジ4ログ、線形ダイナミックレンジ3ログを示す
シグナルの安定性
Eu標識の特筆すべき特徴は、シグナルの安定性とフォトブリーチング耐性です。メンブレンは数か月間安定しており、後でスキャン可能です(図4、図5)。

図4. Eu標識のシグナル安定性とフォトブリーチング耐性
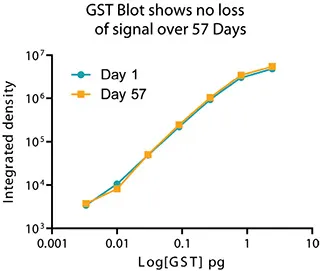
図5. GSTのピコグラム量に対する平均強度のプロットは、57日後のシグナル安定性を示す
メンブレンは複数回スキャンしてもシグナルが失われない
トランスフェリンを1xサンプルバッファで2倍希釈系列に調製し、4-20%グラジエントゲルにロードして30分間泳動しました。タンパク質はImmobilon FLメンブレンに転写され、ウサギ抗トランスフェリンで2時間プローブした後、Eu標識抗ウサギIgGで1時間プローブしました。メンブレンは洗浄、乾燥後、SpectraMax Paradigmプレートリーダーで7回連続スキャンしました(図6)。
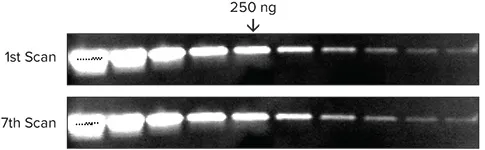
| 250ng | Area | Mean | Integrated Density |
|---|---|---|---|
| Scan 1 | 261 | 8678 | 2264874 |
| Scan 7 | 261 | 8609 | 2247047 |
図6. 複数回スキャン後もシグナルは非常に安定して再現性があります
化学発光ウェスタンブロットとの比較
HEK293T細胞を、DNA損傷を引き起こす発がん物質メチルメタンスルホネート(MMS)で0、50、100 ppm処理しました。抽出物(80 μg)をゲルで泳動し、メンブレンをマウス抗Rad18でプローブした後、ScanLater Eu標識抗マウス抗体またはHRP標識抗マウス抗体(化学発光アッセイ用)でプローブしました(Immobilon Western Chemiluminescent HRP Substrate、Millipore cat. no. WBKLS 0500)。
Rad18はDNA損傷修復に不可欠なタンパク質で、ユビキチン化型と非ユビキチン化型の2種類があります。図7に示すように、MMS曝露によりユビキチン化Rad18の量が減少し、非ユビキチン化Rad18の量が増加します。ScanLaterブロットの定量化は、SoftMax Proソフトウェアでシグナルを取得し、Excelマクロに直接エクスポートして解析しました。化学発光ブロットのシグナルはAlphainnotech化学発光イメージャーで取得しました。図8に示すScanLaterブロットの定量解析では、MMSレベルの増加に伴いRad18タンパク質の増加とユビキチン化Rad18の減少が明確に示されました。この相関は化学発光法では不明瞭でした。
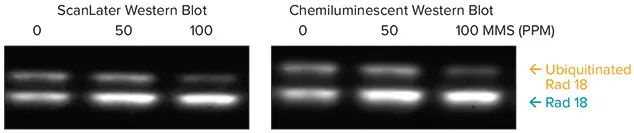
図7. ScanLaterウェスタンブロット検出システムと化学発光システムを用いたRad18の内因性およびユビキチン化型の検出比較
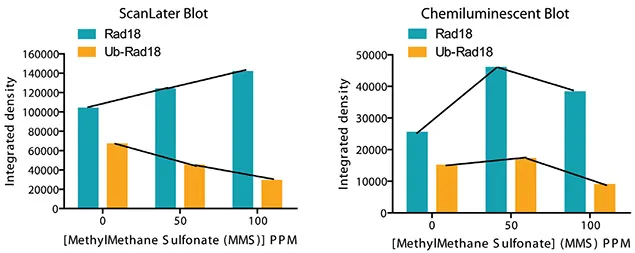
図8. ScanLaterウェスタンブロット検出システムは、MMSレベルの増加に伴う非修飾Rad18の定量的増加とユビキチン化Rad18の減少を明確に検出します データは、ScanLater TRFウェスタンブロットが化学発光ブロットと同等以上の感度と精度を持つことを示しています
結論
ScanLaterウェスタンブロット検出システムを使用することで、ユーザーはアプリケーションに最適化されたワークフローを実行できます。Eu標識二次抗体により、SpectraMax i3またはSpectraMax ParadigmマルチモードマイクロプレートリーダーのTRFモードで低バックグラウンド検出が可能です。画像はSoftMax Proソフトウェアに保存され、カスタムExcelマクロやImageJへの統合エクスポートによる解析が可能です。
ScanLaterウェスタンブロット検出システムは、4ログのダイナミックレンジと3ログの線形レンジでタンパク質を定量化します。さらに、シグナルは時間経過や複数回のスキャンでも安定しています。ScanLaterウェスタンブロット検出システムは、マルチモードマイクロプレートリーダーで優れたタンパク質解析を提供する、シンプルで高感度かつ安定したプラットフォームです。
PDF版(英語)