Application Note CatchPoint cGMP蛍光アッセイキットを用いた
完全なcGMPワークフローソリューション
- 細胞ベースアッセイにおけるcGMPの正確な測定
- 洗浄ステップは1回のみで簡便な操作
- 高いシグナル安定性(10分~24時間)
- Z’ファクター:0.82
PDF版(英語)
イントロダクション
この研究では、CatchPoint® cGMP Fluorescent Assay KitとSpectraMax® i3 MultiMode Detection Platformを組み合わせることで、心房性ナトリウム利尿ペプチド(ANP)で処理したRFL-6細胞のcGMPを測定できることを実証します[1, 2]。図1のアッセイワークフローをご参照ください。
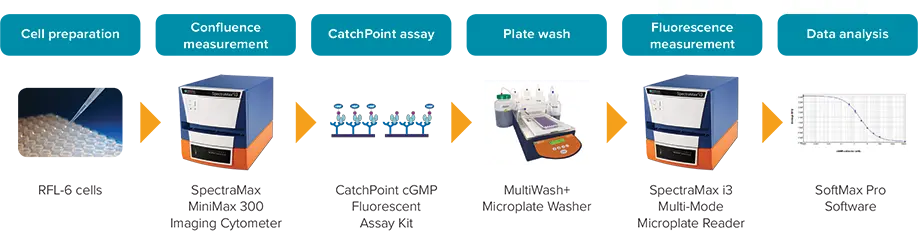
図 1: CatchPoint cGMP ワークフロー。
セカンドメッセンジャーである3', 5'環状グアノシン一リン酸(cGMP)とその関連タンパク質は、平滑筋弛緩、血管拡張、腎機能、光伝達、陰茎勃起などの生理的反応の制御に不可欠であることが示されています[3-7]。
多くの脊椎動物に見られるホルモンであるANPは、cGMPを介してシグナルを送り、腎臓からのナトリウムと水分の排泄を促し、血管平滑筋を弛緩させることによって血圧を下げます [8, 9]。ANPが受容体に結合すると、GTPがcGMPに変換され、プロテインキナーゼGが活性化され、生物学的に関連する多くの標的が活性化されます。
CatchPoint cGMP Fluorescent Assay Kitは、競合イムノアッセイによりcGMPレベルを測定します(図2)。アッセイに必要なのは1回の洗浄工程のみで、測定は基質添加後わずか10分、あるいは24時間以内に行うことができます。

図2:CatchPoint cGMPアッセイのメカニズム。細胞が産生する非標識cGMPは、抗cGMP抗体との結合においてcGMP-HRP結合体と競合します。細胞内cGMP量の増加は、HRP活性の低下として検出されます。
材料
- CatchPoint cGMP Fluorescent Assay Kit(モレキュラーデバイス #R8074)
- RFL-6ラット肺線維芽細胞(ATCC)
- F-12K培地(Kaighn's Modification of Ham's F-12培地、ATCC)
- ウシ胎児血清 (Gemini Bio-Products cat. #100-106)
- ペニシリン-ストレプトマイシン(Life Technologies)
- クレブス-リンゲル炭酸水素緩衝液(KRGB緩衝液、Sigma )
- 炭酸水素ナトリウム (Sigma)
- ウシ血清アルブミン(Sigma)
- リン酸緩衝生理食塩水(PBS、Life Technologies)
- ヒトANP (Sigma)
- ホスホジエステラーゼ阻害剤、3-イソブチル-1-メチルキサンチン(IBMX、Sigma)
- 3%過酸化水素(H₂O₂)溶液
- 96ウェル、透明底、組織培養処理済みマイクロプレート(Corning)
- SpectraMax i3 マルチモードマイクロプレートリーダー
- SpectraMax® MiniMax™ 300イメージングサイトメーター
方法
RFL-6細胞を完全培地(\( \frac{\text{F-12K medium} + 20\%\,\text{FBS} + 1\%\,\text{pen}}{\text{strep}} \))で90%以上コンフルエンスまで培養しました。細胞を0.05%トリプシンで回収し、組織培養処理した黒壁透明底96ウェルマイクロプレートに\( \frac{20000\,\mathrm{cells}}{\mathrm{well}} \)(\( \frac{15000-50000\,\mathrm{cells}}{\mathrm{well}} \)が許容範囲)で播種しました。細胞は、5% CO2、37℃のインキュベーターで少なくとも18時間接着させました。
アッセイ当日、SpectraMax® MiniMax® 300イメージングサイトメーターの透過光チャンネルとStainFree™ Cell Detectionテクノロジーを用いて細胞コンフルエンスを測定し、品質管理の目的で細胞数または細胞で覆われた面積(コンフルエンス)を正確に測定しました。細胞コンフルエンスが高く、ウェル間のばらつきが少ないセル列を CatchPoint アッセイ用に選択しました(図 3)。細胞を、0.75 mM IBMXを封じ込めたKRBG緩衝液で、室温で10分間インキュベートしました。次に、セルをANPで1 µMから37℃で15分間、1:3希釈系列で処理しました。処理後、CatchPoint assayのプロトコールに従って細胞を溶解しました。
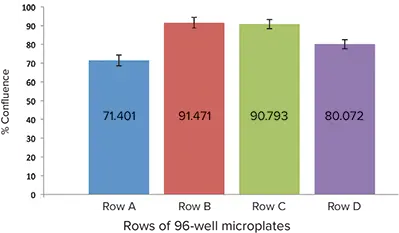
図3:RFL-6細胞を播種したウェルの相対的コンフルエンス。B列はコンフルエンスが高く、ウェル間のばらつきが小さいため、アッセイに選択されました。
CatchPoint アッセイは、製品添付文書に記載されているとおりに実施しました。アッセイ性能を検証し、細胞アッセイサンプル中のcGMP量を算出する手段を提供するために、cGMPキャリブレーター曲線を実施しました。サンプルは、StopLight Red基質添加の60分後にSpectraMax i3 MultiModeマイクロプレートリーダーで読み取りました。すべてのデータ解析とカーブフィッ ト処理は、SoftMax® Proソフトウェアで行いました。事前に設定されたプロトコールは、ソフトウェアのプロトコールライブラリーで利用可能です。
結果
細胞の前刺激および処理前のコンフルエンスを評価するため、MiniMaxサイトメーターとStainFreeテクノロジーを用いて、マイクロプレートの異なる列間の細胞コンフルエンスパーセントを比較しました(図3)。ウェル間のコンフルエンスが一定であったため、B列をアッセイに選びました。各処理ウェルからトリプリケートサンプルを採取し、アッセイしました。
図4と図5は、CatchPoint cGMPキャリブレーター曲線とANP応答細胞ベースアッセイの結果を示しています。どちらの曲線も、SoftMax Pro ソフトウェアの 4パラメータカーブフィットを使用して作成されました。キャリブレーター曲線のEC50は3.1 nMで、既報のデータとほぼ一致しました。Z'ファクターは0.82でした。
RFL-6細胞で観察されたANP濃度反応は、EC50が41 nMであり、これも既報の結果と一致しました。
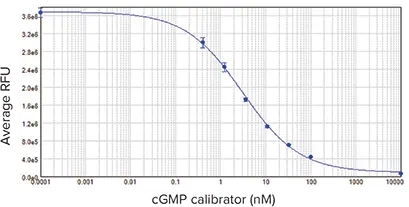
図4:cGMPキャリブレーター曲線。EC50は3.1 nMで、既報の結果と同様でした。サンプルはトリプリケートで行いました。
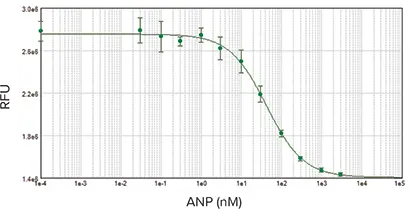
図5:3倍希釈系列で1000 nMから始まるANP濃度反応曲線。EC50は41 nMで、既報の結果と一致しました。サンプルは二重測定しました。
結論
CatchPoint Cyclic GMP Fluorescent Assay Kitは、細胞ベースアッセイにおけるcGMP測定のための正確でロバスト性の高いキットです。本アッセイの高輝度シグナル安定性(基質添加後 10 分~24 時間で読み取り可能)、優れた Z'ファクター、蛍光強度検出モードのあるプレートリーダーでの測定が可能であることから、本アッセイはハイスループットなスクリーニングに多用途に使用できます。SpectraMax MiniMax® 300イメージングサイトメーターとStainFree分析により、細胞ベースアッセイの品質管理がさらに向上します。
| 注文情報 | |||
|---|---|---|---|
| 試薬 | 試薬名 | 品番 | |
| CatchPoint cGMP Assay Kit(96 well format)、エクスプローラー | 192反応 | R8074 | |
| CatchPoint(96 well format)、バルク | 960 反応 | R8075 | |
| CatchPoint cGMP Assay Kit(384 well format)、エクスプローラー | 768 反応 | R8065 | |
以下のモレキュラーデバイス製システムと互換性があります。

参考文献
- Pollock, Jennifer S., et al. "Purification and characterization of particulate endothelium-derived relaxing factor synthase from cultured and native bovine aortic endothelial cells.". Proceedings of the National Academy of Sciences 88.23 (1991): 10480-10484.
- Schmidt, H. H., et al. "Purification of a soluble isoform of guanylyl cyclase-activating-factor synthase". Proceedings of the National Academy of Sciences 88.2 (1991): 365-369.
- A Short History of cGMP, Guanylyl Cyclases, and cGMP-Depedent Protein Kinases – 2009 – Alexander Kots + Ferid Murad
- Denninger, John W., and Michael A. Marletta. “Guanylate cyclase and the .NO/cGMP signaling pathway.” Biochimica et Biophysica Acta (BBA)-Bioenergetics 1411.2 (1999): 334-350.
- Fesenko EE, Kolesnikov SS, Lyubarsky AL. Induction by cyclic GMP of cationic conductance in plasma membrane of retinal rod outer segment. Nature. 1985;313:310–3.
- Brown, R. Lane, et al. "The pharmacology of cyclic nucleotide-gated channels: emerging from the darkness.". Current Pharmaceutical Design 12.28 (2006): 3597.
- Schmidt, Harald HHW, Suzanne M. Lohmann, and Ulrich Walter. “The nitric oxide and cGMP signal transduction system: regulation and mechanism of action.” Biochimica et Biophysica Acta (BBA)- Molecular Cell Research 1178.2 (1993): 153-175.
- de Bold, Adolfo J. “Atrial natriuretic factor: a hormone produced by the heart.” Science 230.4727 (1985): 767-770.
- Leitman, Dale C., et al. "Atrial natriuretic peptide binding, cross-linking, and stimulation of cyclic GMP accumulation and particulate guanylate cyclase activity in cultured cells.". Journal of Biological Chemistry 263.8 (1988): 3720-3728.
CatchPoint cGMP Fluorescent Assay Kitの詳細はこちら >>
PDF版(英語)