Application Note CloneSelect Imager FLによる
Day 0 モノクロナリティの迅速な蛍光検出
- Day 0 モノクロナリティ保証
- クローンの早期拒絶または受け入れ
- マルチチャンネル蛍光検出による様々なCRISPR編集の確認と追跡 - 標識不要の報告
- ハイスループット・アプリケーションの要求を満たす高速取得
- モノクローナリティの評価と報告のための設定済みアルゴリズム
- 6ウェルから384ウェルマイクロプレートまで様々なウェルフォーマットに適合性
PDF版(英語)
はじめに
Prathyushakrishna Macha, Ph.D. | Research Scientist | モレキュラーデバイス
遺伝子編集は、さまざまなツールを用いたDNA操作、すなわち付加、欠失、改変を可能にします。現在、ゲノム研究のためのいくつかのヌクレアーゼが利用可能です:ジンクフィンガーヌクレアーゼ(ZFN)、タレンヌクレアーゼ(TALEN)、メガヌクレアーゼ、およびCRISPR(Clusteredly Regular Interspaced Short Palindromic Repeats)関連タンパク質9(Cas9)。特にCRISPRを用いた標的遺伝子編集は科学に革命をもたらし、主に細胞株開発、細胞治療、遺伝子治療など、様々な分野で多くの応用がされています。
ヒトp53遺伝子は、内的あるいは外的要因によって誘発されるストレスに起因する細胞障害を排除することができます。p53の増殖抑制特性は、細胞内の損傷DNAの複製を抑えます。p53の役割は、細胞周期停止、老化、アポトーシス活性にも及びます。ヒトにおけるp53の機能をよりよく理解する必要性から、毒物学、薬理学、癌研究など、p53の役割を探る多くの研究が行われています。
ここで述べたp53ノックアウトのような細胞株を得るための遺伝子編集には、いくつかのステップがあります *1。そのステップには、安定的トランスフェクション、編集細胞プールの作製、シングルセルプリンティング、安定タンパク質発現モノクローナル細胞株のスクリーニングが含まれます。これらの適切なツールを用いてステップを効果的に最適化することは、細胞株開発の効率的なプロセスに貢献します。これは、研究開発の加速、創薬の革新、病気の治療、遺伝子編集作物の生産拡大など、さまざまな科学的進歩の時間、労力、コストのダウンにつながります。
CloneSelect® Imager FL (CSI-FL)は、細胞株開発ワークフローのアップストリームプロセス開発において大きな助けとなります。細胞株開発のモノクローナリティに関する厳しい規制も、CSI-FLの蛍光検出機能を使えば、シングルセル細胞株であることを確認し、モノクローナリティをDay 0で保証することができます。シングルセルプリンティング(SCP)や限界希釈法4 を用いて、モノクロナリティ スクリーニングのためにマイクロプレートのウェルに播種された細胞は、通常、数が単一で、目的のタンパク質を発現している必要があります。
ここでは、CRISPRに基づくp53ノックアウトプラスミドで遺伝子編集した後、ピューロマイシン選択用の赤色蛍光タンパク質(RFP)マーカーを持つモノクロナリティ HEK-293細胞を同定するための蛍光法をご紹介します。編集された細胞は、シングルセルプリンターで96ウェルプレートにプレーティングされました。その後、CSI-FLを用いてモノクロナリティを評価し、RFPと白色光チャンネルを通して成長をモニターしました。
蛍光検出法は、破片、ほこり、気泡、不要な細胞の検出を除外します。画像化プロセス中に価値の高いクローンを選別します。生存可能な健全な細胞をスクリーニングするための蛍光は、当社の細胞特異性蛍光色素(Cell Tracker Green CMDFA)、または標識不要のアプローチ、すなわち遺伝子挿入によるマーカーとしての蛍光タンパク質の発現によって達成することができます。
CSI-FLのFusionソフトウェアは、細胞数と遺伝子編集の蛍光マーカーの存在を分析します。各ウェルは、蛍光画像2,3 を用いたロバストな単一細胞同定技術によって解析されます。
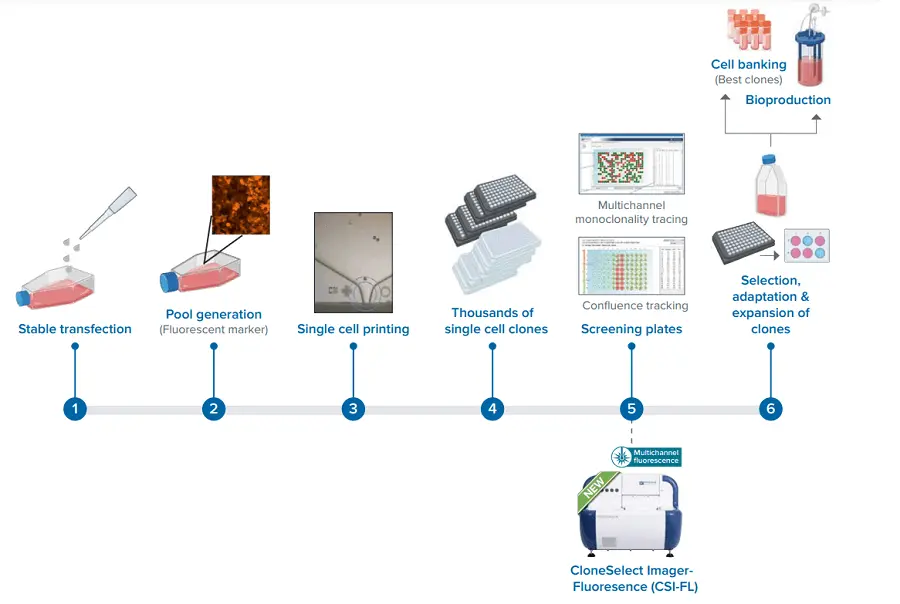
新しいCSI-FLを用いた細胞株開発ワークフロー。
材料および素材
ATCCのHEK-293細胞は、Santa Cruz社のp53 CRISPR/Cas9ノックアウト(KO)プラスミドとp53相同性指向性修復(HDR)プラスミドを用いて、トランスフェクションシステムTransIT-X2(Mirus Bio社製)を用いて、製造元の指示に従ってTP53ノックアウトを行う前に、説明書に従って維持しました。ピューロマイシンの濃度は、最初の72時間は1.5μg/mLでしたが、その後、安定した株が生成されるまで定期的に培地交換を行い、0.5μg/mLまで徐々に漸減させました *1。
無血清培地で100万細胞/mLのプールを用いて、CloneSelect® Single-Cell Printer(f.Sight)を用いて96/384ウェルプレートにシングルセルプリントを行いました。これらのプレートはDay 0にモニターされ、続いてDay 1、4、6、7、11に白色光とCSI-FLのRFPチャンネル(対物レンズ4倍)を用いて成長を記録しました。これらの細胞をさらに、ImageXpress® Microハイコンテントイメージングシステム(IXM-C)を用いて画像化し、細胞のより詳細な画像を得ました(対物レンズ10倍)。コンフルエンスまで増殖した細胞は、12ウェルプレート→6ウェルプレート→25cm2フラスコ→75cm2フラスコに移され、さらなる実験のために冷凍保存されました。
結果
HEK-293細胞にKOプラスミドをトランスフェクトし、HDRでピューロマイシンを選択すると、RFPが発現しました(長期間)。このポリクローナル細胞プールを、モノクローナル細胞株開発のためにさらにスクリーニングしました。これは、細胞プール(図1)を96ウェル/384プレートにシングルセルプリンティングすることによって行われ、後にピューロマイシンで選択され(より良好な増殖のために濃度を漸減)、さらなるアッセイのためにスケールアップされました。CSI-FLの蛍光とプレート・ウェルのレイアウトを利用することで、96ウェル・プレートの個々のウェルで細胞の位置を特定し、シングルセルをモニターして拡大することが容易になりました(図2および3)。CSI-FL(倍率4倍)でイメージングされた細胞は、IXM-Cでより高倍率(10倍、20倍、40倍)でイメージングされました(図5)。CSI-FLは、マルチチャンネルを使用した複数プレートのハイスループット読み取りを2、3時間で迅速に行うことができました。
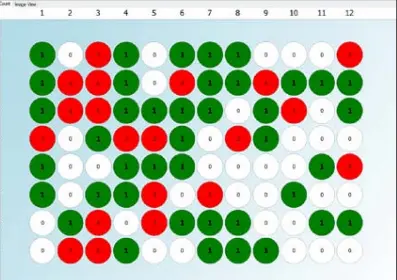
図1. CSI-FL 蛍光イメージングと Fusion ソフトウェアを使用して作成しました、シングルセルがプリントされた 96 ウェルプレートのDay 0のモノクローナリティレポート(緑:ウェル内に 1 つの細胞を検出、灰色:細胞検出なし、赤:複数の細胞を検出)。
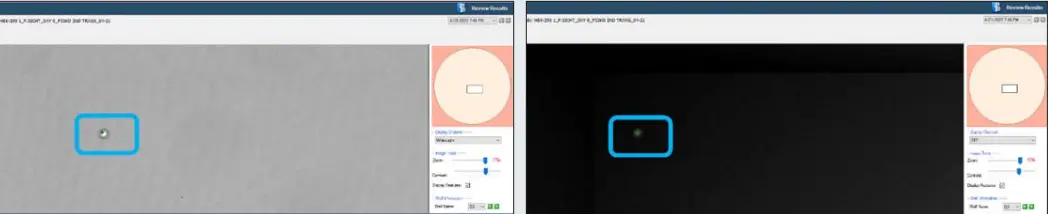
図2. CSI-FL Fusionソフトウェアの白色光イメージング(左)とRFPイメージング(右)。モノクローナリティ保証プレートレポート。細胞上の緑色の点(括弧付き)は、Fusionソフトウェアの細胞数表示。
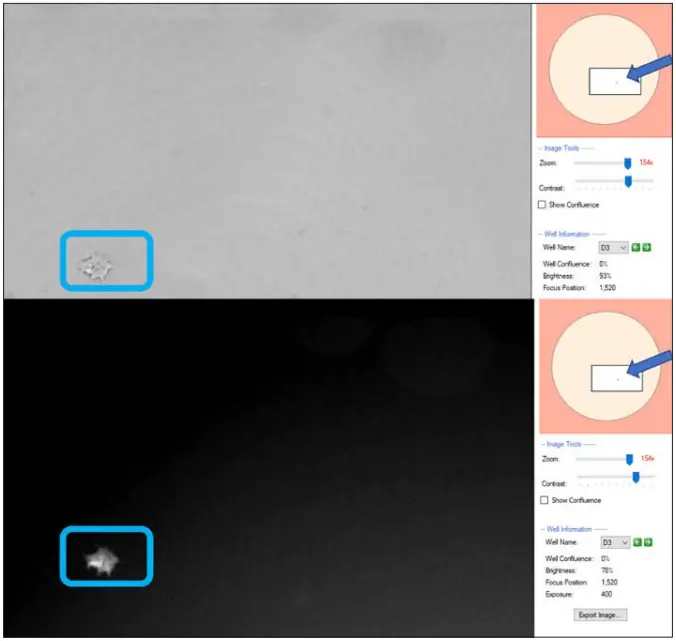
図3. モノクローナリティレポート(図1)のプレート1のウェルD3のDay 6のCSI-FL Fusionソフトウェアの白色光(上)とRFP(下)イメージングチャンネル画像。両画像の右側(矢印)には、ズームした画像の位置(枠)とウェル内の細胞(緑色の点)を示すウェルレイアウトが表示されています。
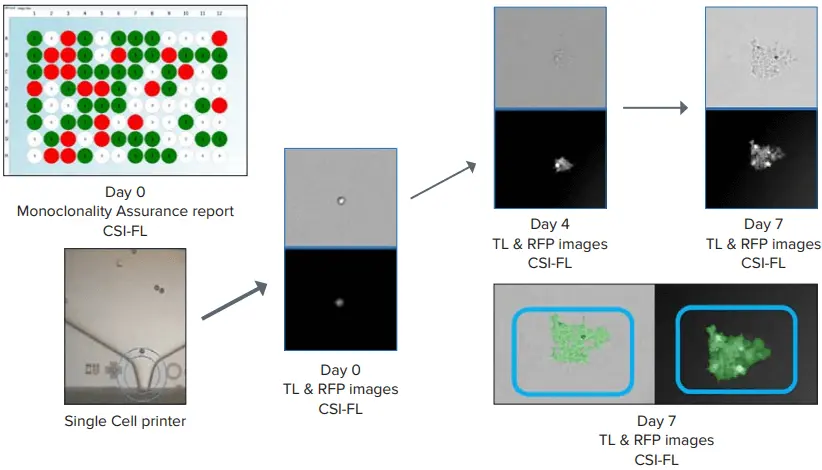
図4. 96ウェルプレートで作成したDay 0のモノクローナリティレポート(左上) シングルセルプリンティング(SCP)と細胞増殖(Day 0→Day 7)の表現。コンフルエンス(青いボックス、右下)は、Fusionソフトウェアを用いて細胞数をカウントするために生成されました。白色光イメージングとRFPイメージの両方を考慮しました。

図5. 上-CSI-FL(A.)4倍、IXM-C(B.)10倍によるRFPマーカーを用いたCRISPRベースp53 KOモノクローナル細胞のプレートレイアウト画像[Day 11のプレート1]。下-CSI-FL(4倍)(C., D.)とIXM-C(10倍)(E., F.)をそれぞれ用いたDay 11のウェルD3の白色光イメージングとRFPイメージング。
概要
CSI-FLは、モノクローナル細胞株開発のための効果的で迅速なプロセスを確立し、モノクローナリティを早期に検出しました。SCPプリント細胞のハイスループットスクリーニングと、蛍光ベースのモノクローナル性保証を用いたDay 0のモノクローナリティ評価が達成されました。この細胞は、自動コンフルエンス解析によるCSI-FLモニタリングを使ってさらに増殖させました。さらに、スケールアップ(96ウェルから6ウェルプレート)の全過程で、蛍光機能を用いたクローンのRFP発現が確認されました。したがって、蛍光スクリーニング機能を持つCSI-FLシステムは、目的のタンパク質(ここではRFP)を発現する単一細胞の迅速な選択に役立ちます。
参考文献
- CloneSelect Imager FLで 遺伝子編集細胞株の開発を加速
- CloneSelect Imager(CSI and CSI FL)
- 細胞株開発を促進する迅速なモノクローナリティの検証方法
PDF版(英語)