Application Note iPSC由来3D大脳オルガノイドの
自動モニタリングと解析
- 使いやすいディープラーニングベースの解析ツールで3Dバイオロジーワークフローを改善します
- in vivoの発生と一致する細胞自己組織化をより適切に再現する手法を開発します
- 大脳オルガノイドの培養とモニタリングを自動化します
PDF版(英語)
Angeline Lim | Sr. Applications Scientist | モレキュラーデバイス
Oksana Sirenko | Sr. Manager of Assay Development | モレキュラーデバイス
はじめに
ヒトの脳は非常に複雑であり、in vitroやモデル生物での研究は困難です。培養ニューロンは、脳の3D構造、複雑性、および微小環境を十分に再現できません。また、モデル生物の使用は保存された発生経路の一部要素を定義するのに役立ってきましたが、加齢関連の神経疾患など、特定の疾患を研究するための適切なモデルは不足しています。
しかし、iPSC(誘導多能性幹細胞)由来の脳オルガノイドの使用は有望なモデルです。これはヒト神経発生の側面を再現し、離散的な脳領域に自己組織化し、その遺伝子発現パターンはin vivoデータと類似しています *1,*2。これまでの取り組みにより、脳オルガノイドを培養するための複数のプロトコールや、脳発生および関連疾患の研究を可能にする技術が開発されました。特に、大脳オルガノイドの培養が可能になったことで、ヒト皮質発生とその関連疾患の研究が進展しました。機能ゲノミクス研究、創薬、化合物誘発毒性の研究において、大脳オルガノイドをスケールで使用するには、さらなる改良が必要です。
ここでは、大脳オルガノイドの半自動培養とモニタリングの方法、さらにCa²⁺オシレーションの記録による機能的な神経活動の評価について説明します。大脳オルガノイドは、既報の方法²,³に基づきiPSCから作製しました。本方法は、ImageXpress® Micro Confocal ハイコンテントイメージングシステムを用いた部分的な自動化ワークフローと培養モニタリングに適応しました。発生中の脳マイクロティッシュのサイズと形態を透過光で20週間にわたりモニタリングしました。IN Carta® イメージ解析ソフトウェアによるディープラーニングベースの画像解析を用いて、組織のサイズと形状を定義しました。選択したマイクロティッシュは、発生の異なる段階でSox2、TuJ1、GAFPマーカーの発現を共焦点イメージングで解析しました。機能的活動の検出には、選択したマイクロティッシュクラスターからカルシウムオシレーションをイメージングで記録しました。オシレーションは培養50日以降に観察され、マイクロティッシュ全体に散発的に現れました。
材料と方法
細胞培養
フィーダーフリー条件に適応したヒトiPSC細胞(SC102A-1、System Biosciences)は解凍後、Matrigelコートプレート(Corning、cat.#354277)でComplete mTeSR™ Plus培地(STEMCELL Technologies)を用いて培養しました。培地は毎日交換しましたが、週に1回は倍量の培地を追加し、翌日の交換を省略しました。細胞は酵素不使用試薬ReLeSR™(STEMCELL Technologies)を用いて4~5日ごとに1:6~1:10の分割比で継代しました。
大脳オルガノイド分化
オルガノイド作製に使用した試薬はすべてSTEMdiff™ Cerebral Organoid Kit(STEMCELL Technologies #08570)由来です。このキットはLancasterら¹に基づき最適化されています。簡単に説明すると、iPSC細胞を96ウェル超低接着プレート(Corning)にEB播種培地でウェルあたり9,000細胞で播種しました。培地はEB形成培地に置換しました。5日目にEBをイメージングし、神経誘導の準備が整っていることを確認しました。EBは誘導培地を含む24ウェルプレートに移しました。7日目にEBをMatrigel(Corning)ドロップレットに移し、6ウェルプレートに6~8ドロップを配置し、成熟培地を加えました。オルガノイドを含むプレートは37°Cのインキュベーターでオービタルシェーカー上で成熟させ、培地は3~4日ごとに交換しました。
カルシウムフラックスアッセイ
カルシウムフラックスはFLIPR® Calcium 6 Assay Kit(モレキュラーデバイス)を用い、メーカーのプロトコールに従って評価しました。17日目以降、1つの大脳オルガノイドを2時間染色し、ImageXpress Micro Confocalでイメージングしました。
免疫蛍光
オルガノイド全体を4%PFAで4°Cで一晩固定し、PBSで洗浄しました。透過処理はPBS中の0.5% Triton-Xで行いました。オルガノイドは以下の抗体と染色剤で48時間インキュベートしました:Hoechst(33 µM、Invitrogen cat.#33342)、Alexa Fluor 555 mouse anti-β-tubulin(1:100、Becton Dickinson cat.#560339)、Alexa Fluor 647 mouse anti-Sox2(1:100、Becton Dickinson cat.#562139)、Alexa Fluor Plus 750 Phalloidin(ThermoFisher Scientific cat.#A30105)。
画像取得と解析
すべての画像はImageXpress Micro Confocalシステム(モレキュラーデバイス)で取得し、MetaXpress® ハイコンテントイメージング解析ソフトウェアを使用しました。解析はIN Carta™ イメージ解析ソフトウェアで行いました。IN Carta SINAPモジュールを用いて画像のセグメンテーションを実施し、各モデルは解析プロトコールで使用する前にトレーニングと検証を行いました。カルシウムイメージングではカメラビニングを2に設定し、取得速度を向上させるために50 µm共焦点スリットモジュールを使用しました。
結果
iPSC由来大脳オルガノイドの培養と分化
大脳オルガノイドは、Lancaster et al. *3のプロトコールに基づき培養しました。この方法では、オルガノイドは自己組織化とパターン形成を促進する培養培地で成長します。胚様体(EB)は、神経上皮の極性化を改善し、大きな神経上皮芽の成長をサポートするため、細胞外マトリックス(Matrigel)でさらに分化します。これらの芽はEBから伸長し、脳室に類似した空洞を含みます。図1は、iPSC由来大脳オルガノイドを生成するために使用した主要なステップを示しています。

図1. 内在的パターン形成アプローチを用いて生成されたiPSC由来大脳オルガノイドです。iPSC細胞を用いてEBを作製しました。A) iPSC由来大脳オルガノイドを生成するために使用した主要なステップです。プロトコールはLancaster & Knoblich(2014)に基づき、STEMCELL Technologies社の培地を使用しました。B) 5日目までに、EBの大部分は直径400 μm以上になりました。EBは滑らかな輪郭を示し、表面近くの領域は明視野顕微鏡で光学的に明るく見えます。右側にプレート全体のEBの例を拡大表示しています。スケールバー = 100 μm。C) EBを神経誘導培地に移した後の画像です。光学的に半透明な縁は神経上皮形成を示唆します。スケールバー = 100 μm。D) 8~10日目に、オルガノイドをMatrigelに埋め込み、神経上皮の拡張をサポートしました。多数の上皮芽の形成に注目してください。E) オルガノイドをオービタルシェーカーに移し、成熟させました。デジタルカメラで成熟中の大脳オルガノイドを撮影しました。F) オルガノイドを固定し、Hoechst(核、青)、TUJ1(ニューロン、緑)、SOX2(放射状グリア、赤)で染色しました。画像に見える暗い線はタイル画像の結果です。
AIベースの解析ツールを用いた発生中の大脳オルガノイドのモニタリング
発生中のオルガノイドの品質をモニタリングするため、明視野イメージングで取得した画像をAIベースのセグメンテーションで解析しました。EBとオルガノイドの成長は、時間経過に伴う直径測定でモニタリングできます。EBを識別するためにディープラーニングベースの手法を使用する利点の一つは、より堅牢なセグメンテーションです。モデルは、ほとんどのデブリ、埃粒子、およびイメージングアーティファクトを除外するようにトレーニングされています。
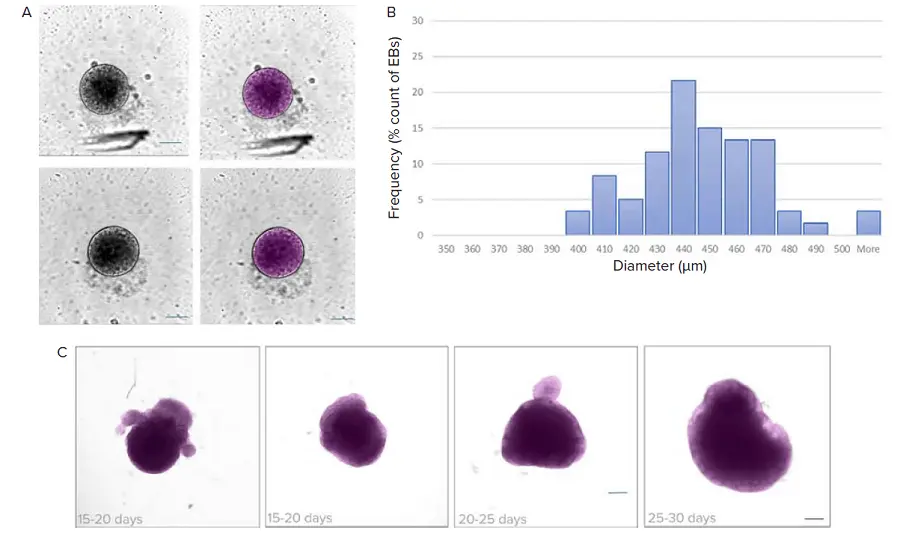
図2. ディープラーニングベースのセグメンテーション(SINAP)を用いた明視野画像の解析です。A) 神経誘導ステップに進む前にEBのサイズをモニタリングしました。IN CartaソフトウェアのSINAPツールを使用した画像と対応するセグメンテーションマスク(マゼンタ)の例を示します。B) EB直径の分布を示すヒストグラムです。ビンサイズ = 10 μm。C) オルガノイドの成熟は明視野イメージングでモニタリングでき、IN Carta SINAPツールで解析されます。カスタムディープラーニングモデルをトレーニングし、データセットに適用しました。セグメンテーションマスク(マゼンタ)を付けたオルガノイドの例を示します。SINAPモデルは、異なる形状とサイズのオルガノイドをセグメント化できることに注目してください。スケールバー = 100 μm。
オルガノイドを構成する細胞型を決定するため、選択したオルガノイドを固定し、SOX2(放射状グリア)、TUJ1(ニューロン)、Hoechst(核)で免疫染色しました。大脳オルガノイドは、発生中の脳を想起させる組織構造を示します。放射状グリア細胞はオルガノイド内の脳室周囲に存在しました。成熟度の低いオルガノイド(4週)と比較して、古いオルガノイド(8週)はより大きく、数の少ない脳室を持っていました(図3)。
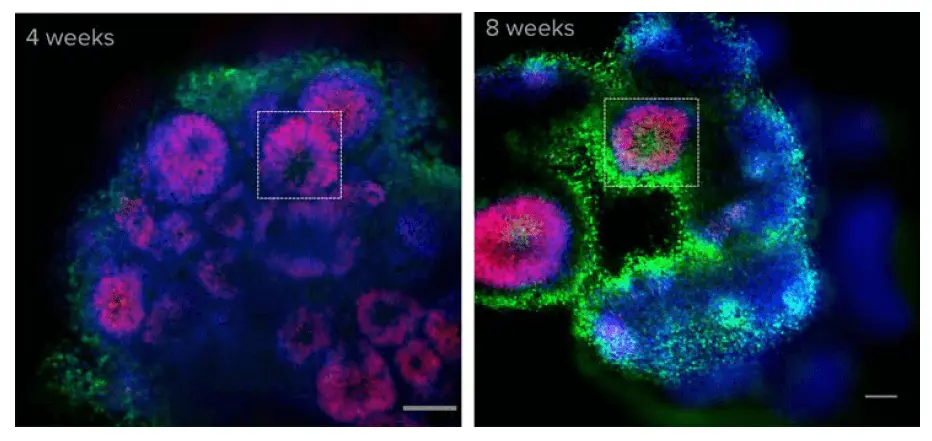
図3. 大脳オルガノイドは発生中の脳を想起させる組織構造を示します。カルシウムイメージング後、オルガノイドを固定し、Hoechst(青)とSOX2(放射状グリア、赤)で染色しました。ここに示すのは光学断面の一例です。脳室(枠内)は4週および8週のオルガノイドの両方で観察されます。SOX2染色は、放射状グリア細胞が脳室近くに局在し、発生中の皮質の細胞組織に類似したパターンを示すことを示しています *3。スケールバー = 100 μm。
全脳オルガノイドのカルシウムイメージング
カルシウムイメージングは、ニューロン活動を決定するための機能的アッセイとして使用できます。4週目以降、FLIPR® Calcium 6染料をロードした大脳オルガノイドでカルシウム活動を観察しました(図4)。カルシウム活動の頻度は低く、その時点でオルガノイド内のニューロンがまだ未成熟であることを示唆しています。13週目には、カルシウム活動がより同期的に現れ、ニューロンが機能的ネットワークで相互接続されていることを示唆しました(図5)。
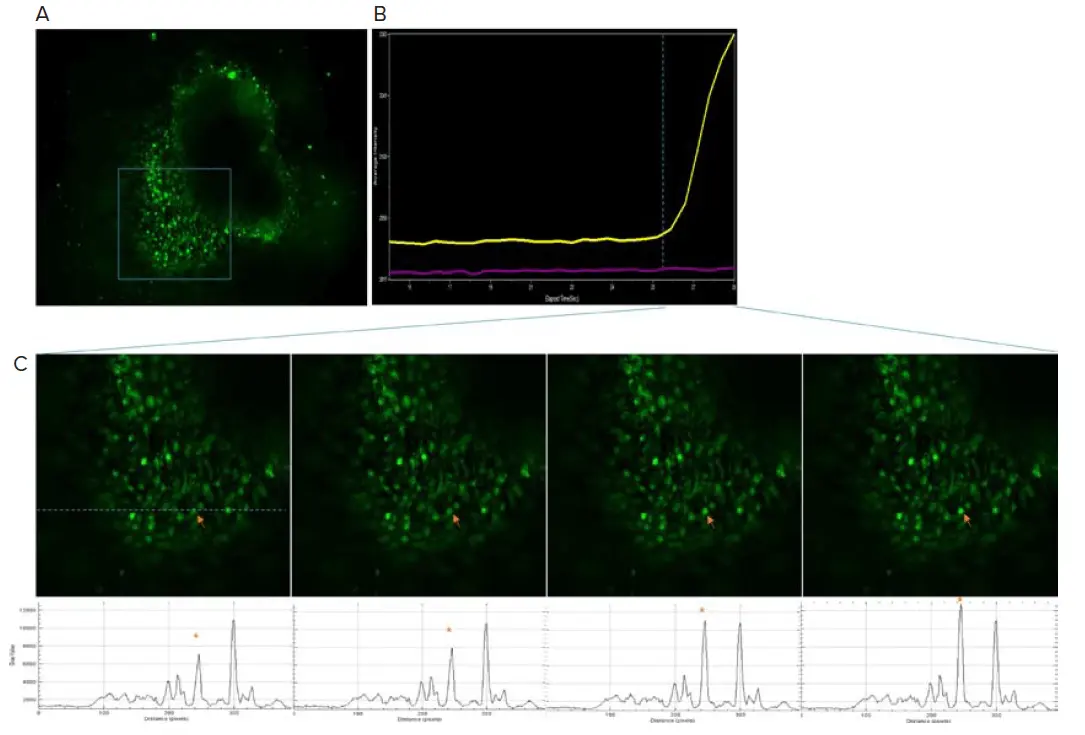
図4. 4週目から観察されたカルシウム活動です。A) オルガノイドにFLIPR Calcium 6染料をロードし、ImageXpress Micro Confocalシステムでカルシウムフラックス活動をモニタリングしました。B) 右側に時間経過に伴うカルシウム強度プロットを示します。黄色のトレースは(C)の矢印で示された領域に対応します。紫のトレースは隣接領域を表します。C) (A)の枠内領域の拡大図です。点線に沿った強度プロファイルを下部に示します。矢印は強度プロファイルのアスタリスクピークに対応します。
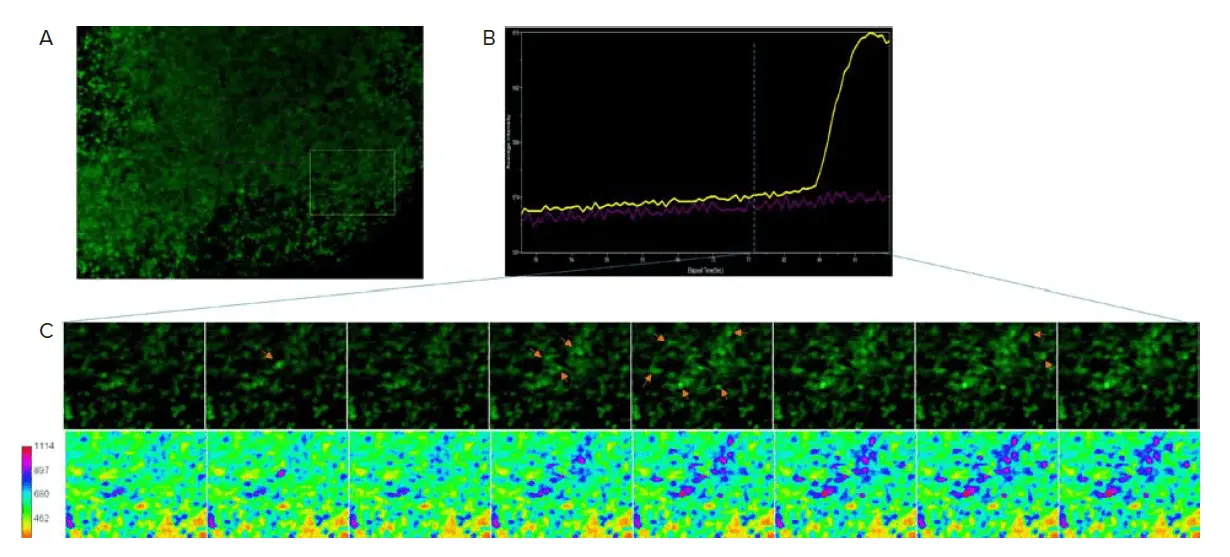
図5. 13週目に同期的なカルシウム活動が観察されました。A) カルシウム6をロードしたオルガノイドの光学断面画像です。B) 枠内領域のカルシウム強度を時間経過に伴う平均強度として表示します。C) (A)の枠内領域の時間経過を示す拡大図です。矢印は強度の上昇を示します。下部の画像はカルシウム強度をヒートマップとして表します。初期スパイクから広がる強度は、ニューロンネットワークの存在を示唆しています。
これらの大脳オルガノイドを毒性試験に使用する可能性を探るため、オルガノイドを4-アミノピリジン(神経刺激剤)やムシモール(神経抑制剤)などの化合物とインキュベートしました。場合によっては、4-APがカルシウム活動の活性化を引き起こしました(図6)。
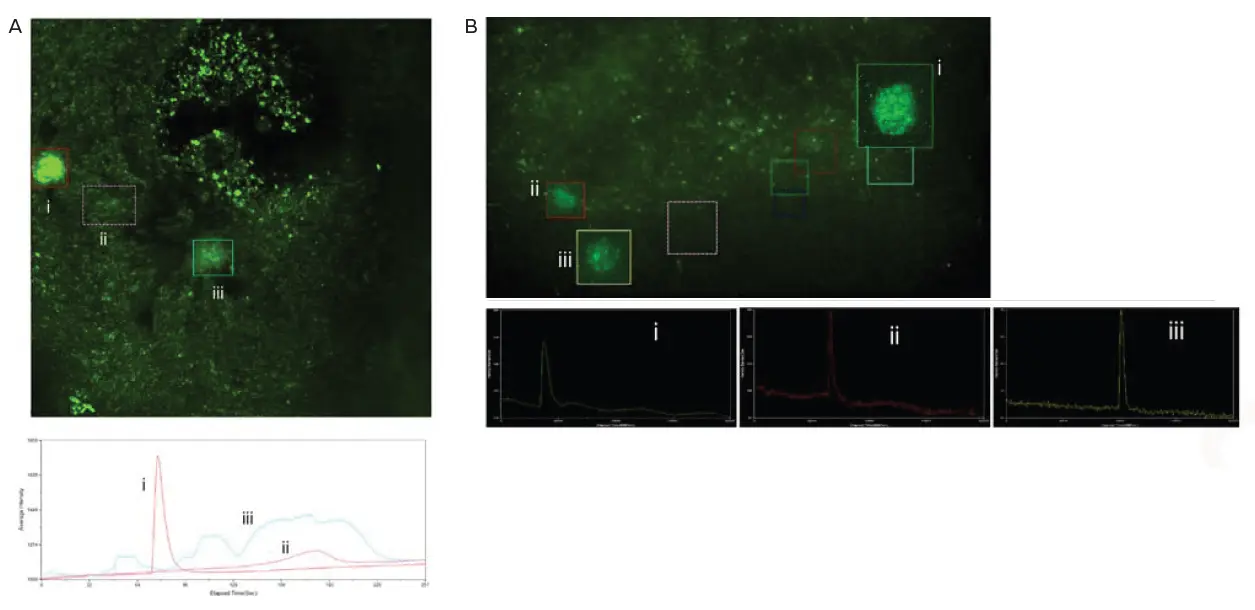
図6. 神経刺激剤によって誘発されたカルシウム活動です。A) オルガノイドを100 nMの4-APで30分間インキュベートし、その後イメージングしました。多数のカルシウムシグナルイベントが観察されました。枠内領域はカルシウムスパイクが観察された領域を示し、その対応する強度プロファイルを下に示します。B) ムシモールで処理したオルガノイドです。ここに示すのは、ムシモール除去後のカルシウム活動の回復例です。GABAの抑制効果は、オルガノイドの活動が一過性かつ不一致であったため、結論付けられませんでした。枠内領域に示されたカルシウムシグナルイベントとその強度プロファイルを表示します。
結論
- 本研究では、大脳オルガノイドのイメージングを自動化し、発生をモニタリングするためのワークフローとツールを示しました。
- カルシウムフラックスの存在とオルガノイド内の細胞組織は、in vivo皮質発生と一致しています。
- 結果は、将来的に大脳オルガノイドを化合物スクリーニングアッセイに使用できる可能性を示しています。ただし、培養および解析方法は、より堅牢で一貫した性能を達成するためにさらに最適化する必要があります。
参考文献
- Gordon, A., Yoon, SJ., Tran, S.S. et al. Long-term maturation of human cortical organoids matches key early postnatal transitions. Nat Neurosci 24, 331–342 (2021).
- Lancaster, M., Renner, M., Martin, CA. et al. Cerebral organoids model human brain development and microcephaly. Nature 501, 373–379 (2013).
- Lancaster MA, Knoblich JA. Generation of cerebral organoids from human pluripotent stem cells. Nat Protoc. Oct 9(10), 2329–40 (2014)
- Grienberger C, Konnerth A. Imaging calcium in neurons. Neuron 73, 862–885 (2012)
PDF版(英語)