Application Note ハイドロゲル細胞モデルを用いた
自動分注とアッセイ開発
- 3D細胞モデルの開発、維持、イメージングのワークフローを統合
- 使いやすく、cGMP認証済みのインターフェースにより、BioAssemblyBot® 400とImageXpress®製品群のイメージング間で容易な統合と操作が可能
- ハイスループットアッセイに対応する、温度非依存かつキセノフリーの3D細胞モデル用マトリックス
- 自動化されたBAB400とImageXpress® Micro Confocal ハイコンテントイメージングシステム(IXM-C)で、3D細胞モデルのハイスループット・ハイコンテントイメージングアッセイを強化
PDF版(英語)
はじめに
Prathyushakrishna Macha, PhD | Research Scientist | モレキュラーデバイス
さまざまな微小環境をより正確に再現する3D細胞モデルは、正確な創薬スクリーニングや疾患モデル化において非常に重要です。これらはin vitroおよびin vivoモデルとして使用でき、生物学的に関連する治療法の発見に不可欠なハイスループットかつコスト効率の高いアッセイを実施できます。創薬研究やスクリーニングにおいて3Dモデルをより広く採用し、労力のかかるプロセスを簡素化するためには、コストと市場投入までの時間を大幅に削減するハイスループットスクリーニングと自動化処理の需要が高まっています。
Advanced Solutions社のBioAssemblyBot 400(BAB400)は、複雑な生物学的モデルの構築に使用できるcGMP認証済みのマルチツールです。モデル構築に使用できる多目的プラットフォームであり、空気圧分注と3Dプリント機能により、さまざまな3Dモデルやオルガノイドを損傷なく構築・操作できます。液体ハンドリングツールは、ハイドロゲル、Matrigel®、その他適切な細胞外マトリックスに所定の細胞数を効果的に分注し、マルチウェルプレートに配置します。その後、培地の添加や交換、プレートの搬送を行い、スマートで統合された自動ワークセルに組み込むことで、基礎的、薬理学的、バイオメディカルなワークフローを実行できます。
本研究では、VitroGel®マトリックスを用いて96ウェルフォーマットで細胞を含む3D構造をプリントしました。The Well Bioscience社のVitroGelは、調整可能でキセノフリー(動物由来成分不使用)のバイオ機能性ハイドロゲルシステムであり、3D細胞培養環境を最大限に操作できる柔軟性を提供します。温度非依存で、Matrigelなどの動物由来細胞外マトリックスの優れた代替品となり、幅広い細胞種や最終構造要件に対応します。VitroGelのユニークなせん断希釈性と迅速な回復性のレオロジー特性により、分注後の細胞分布が優れ、液体ハンドリングシステムとの自動化が非常に容易になります。
本研究では、患者由来のトリプルネガティブ乳がん細胞(引用)をVitroGelマトリックスと混合し、96ウェルフォーマットでバイオプリントにより3D培養を作成しました。このモデルは、細胞増殖の観察や薬剤効果の評価に使用できます。
VitroGelを用いた3D細胞モデルのワークフローを提示します。この統合システムでは、分注、モニタリング、薬剤スクリーニングアッセイの実施、イメージングおよびデータ解析を行います。このシステムにはBAB400とImageXpress Micro Confocalシステムが含まれます(図1)。
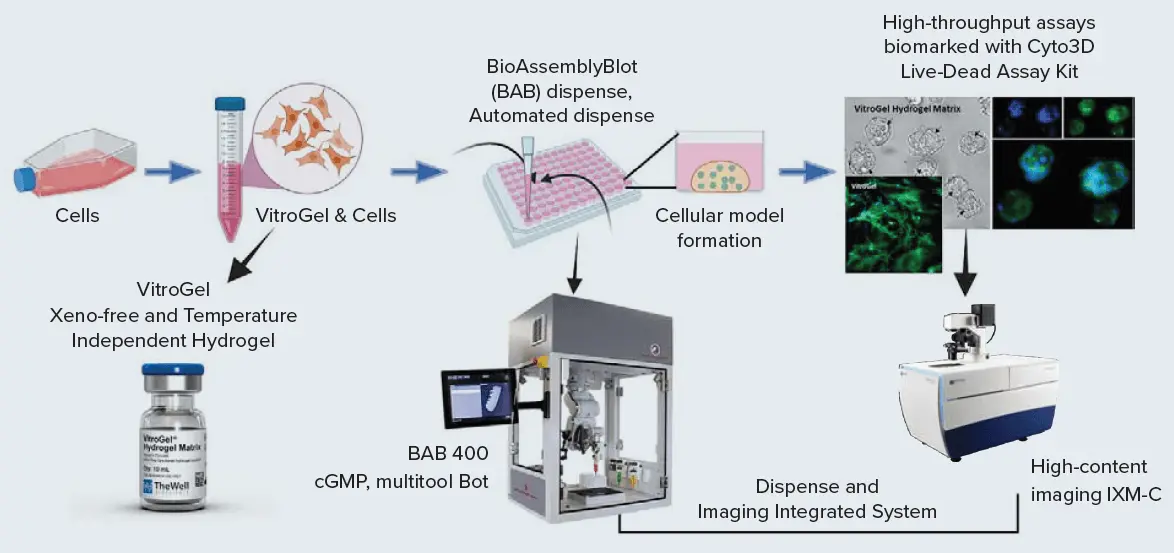
図1. 統合システムワークフローの模式図[BABによる自動分注とIXM-Cによるイメージング]
方法
スフェロイド用VitroGelと細胞懸濁液
4IC細胞 *1は、グルコース、NEAA、2mMグルタミン、インスリン120μg/L、10% FBS(Gibco 12491-015)を補充したAdvanced DMEMで培養しました。アッセイでは、フェノールレッドを含まないDMEM+10%透析血清(2mMグルタミン、5mMグルコース)でスフェロイドを培養しました。
患者由来トリプルネガティブ乳がん細胞はトリプシンで回収し、30% FBSを含む培地に5×10⁵ cells/mLの濃度で懸濁しました。3D細胞培養はVitroGel Hydrogel Matrix(SKU: VHM01)で以下の手順で実施しました:
- VitroGel Hydrogel Matrixを室温または37°Cに調整
- ハイドロゲル溶液と細胞懸濁液を2:1(v/v)で混合
- 96ウェルプレート(非組織培養処理済み)の各ウェルにハイドロゲル細胞混合液10 μLを添加
- 室温で10~15分間静置し、ハイドロゲル形成を待機(形成中はプレートを傾けたり振動させない)
- ハイドロゲルの上に細胞培養培地90 μLを慎重に添加
- プレートをインキュベーターに入れ、カバーメディアを隔日で交換
BioAssemblyBot 400による分注(ピペットツール)、培地交換、薬剤スクリーニング、Live/Deadアッセイ
BAB400はHEPA気流システムによる無菌環境を提供します。ツールや電子機器を除く表面をスプレーとワイプで清掃し、使用の少なくとも1時間前(可能なら一晩前)にHEPAフィルター機能をオンにします。BAB400のヒューマンマシンインターフェース(HMI)とジョイスティックコントローラーを使用して、各ステップに応じたパスを設計します。パスは、リザーバー、プレート、チューブ、廃棄物などの座標を記録するコンソールで設定します。VitroGel中のメディアと細胞懸濁液は事前にBAB400で準備し、リザーバーに移します。
グリッパー(PnPツール)シーケンスを使用してプレートの蓋を開閉し、分注完了後にプレートをImageXpress Micro Confocalシステムに移動してイメージングします。BAB400は人手を介さずにマルチステッププロセスを実行できます。カスタム実験プロトコールを組み合わせることで、実験を自動化ワークフローに変換し、3D細胞モデルを構築できます。BioApps™ Makerは、分注、維持、イメージングの一連のステップを自動化するために使用される簡単なソリューションです。
例:ハイドロゲル分注シーケンスのステップは以下の通りです:
チップを取得 → ピペットツールがハイドロゲルリザーバーへ移動 → 降下(リザーバー内へ) → 所定回数混合(定義された速度で吸引と分注を繰り返す) → プレートへ移動(左右の方向指定後、ウェル中央へ) → 分注(容量と分注速度を定義) → チップを廃棄(BAB400内のバイオハザードバッグへ)。 同様のパスは、培地の吸引と分注にも設計できます。この場合、VitroGelドームを損なわないように、チップはウェルの端に移動します。選択した薬剤を含む培地やLive/Dead染色の添加も、スフェロイドのさらなる処理やイメージングアッセイに使用できます。オプションステップ: BAB400の温度制御ステージを10°Cに予冷し、96ウェル内で分注されたVitroGelドロップレットのゲル化を迅速化します。
ImageXpress Micro Confocalによるイメージングと解析
BAB400がマイクロウェルプレートをImageXpress Micro Confocalイメージングシステム(モレキュラーデバイス)に移動した後、MetaXpress®ハイコンテント画像取得・解析ソフトウェアを使用して透過光(TL)または蛍光画像を取得しました。スフェロイドのZスタック画像は、共焦点モードで4Xまたは10X対物レンズを使用して取得しました。解析はすべてMetaXpress 画像取得・解析ソフトウェアで実施しました。BioApps™は、特定のシーケンスや実験に適したイメージング取得・解析ファイルを呼び出して実行できます。
結果
複数の96ウェルプレートにVitroGelドーム内で4IC乳がん細胞を播種し、BAB400と手動分注の両方でセットアップしました。これらは3日目にCyto3D® Live-Dead Assay Kit(TheWell Bioscience, SKU: BM01)で染色し、前述のイメージング方法で解析しました。Live/Dead解析により生細胞と死細胞をカウントしました。手動と自動分注の間で細胞生存率に有意差は認められませんでした。BAB400ワークフローの平均生存率は93%、手動分注プレートは92.4%でした(図2)。したがって、自動化された細胞プリントは細胞生存率に影響を与えませんでした。
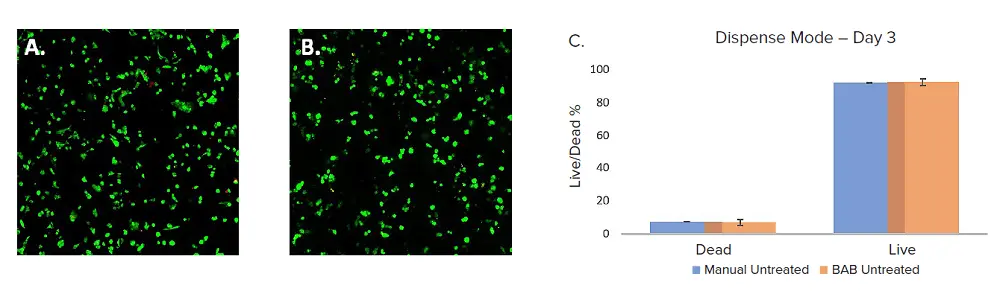
図2. A. BAB B. 手動分注、VitroGelとトリプルネガティブ乳がん細胞(4IC)をCyto3Dで染色(緑=生細胞、赤=死細胞)し、Day 3にIXM-Cでイメージング。C. MetaXpressソフトウェアで解析したデータのグラフ表示
薬剤処理ワークフローを検証するため、TrametinibとIdarubicinをDay 3にマルチウェルプレートへ添加し、最終濃度4 μMとしました。48時間処理後のDay 5に効果を評価しました。両薬剤処理群では、コントロールと比較して細胞生存率が有意に低下しました(図3)。細胞生存率は、前述の方法で生存染色後にイメージング法で判定しました。Idarubicin 4 μMでは死細胞率が最も高く、スフェロイド内の細胞の97%が死細胞でした。一方、Trametinibでは66.4%、コントロールでは7.5%でした(図3)。
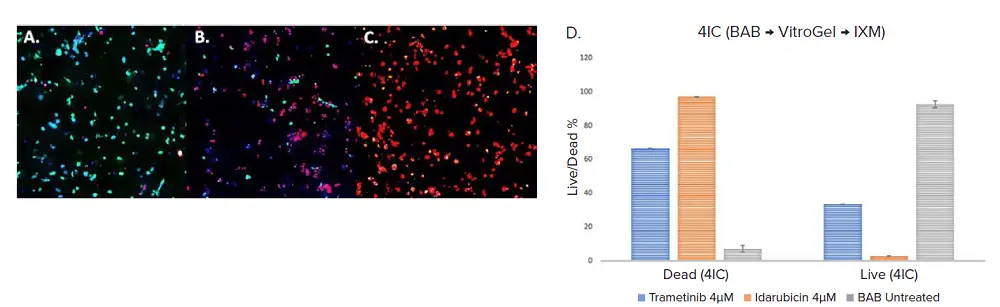
図3. BABで分注したVitroGelとトリプルネガティブ乳がん細胞(4IC)。コントロール(A)と処理サンプルはCyto3D(緑=生細胞、赤=死細胞)およびDAPI(青=核)で染色。処理群はTrametinib(B)とIdarubicin(C)を4 μMで48時間処理。Day 5にIXM-Cでイメージング。D. MetaXpressソフトウェアで解析したデータのグラフ表示
結論
3D細胞モデルのワークフローは、BAB400とImageXpress Micro Confocalイメージングシステムを統合し、取り扱いやすく調整可能なECMマトリックス(VitroGel)を用いることで自動化できます。このシステムは、2D/3D細胞培養、維持、3D細胞モデルの分化に対応し、化合物スクリーニングや多様なアッセイに利用可能です。これにより、時間とコストを節約し、反復ステップを削減することで、基礎研究、薬理学研究、バイオメディカル研究および製品開発に効果的に貢献します。
謝辞
患者由来細胞株をご提供いただいたDr. Matthew E. Burow(Tulane Cancer Centerプログラムメンバー、医学准教授)に感謝いたします。
参考文献
- Cromwell EF, Sirenko O, Nikolov E, Hammer M, Brock CK, Matossian MD, Alzoubi MS, Collins-Burow BM, Burow ME. Multifunctional profiling of triple-negative breast cancer patient-derived tumoroids for disease modeling, SLAS Discovery 2022; 27(3): 191–200.
PDF版(英語)