Application Note ヒトiPSC由来の3D三重共培養心筋スフェロイドにおける
化合物応答の自動培養および機能解析
- 非標識神経突起の正確なセグメンテーションを作成iPSC由来の3D三重共培養心筋スフェロイドを用いることで、in vitro毒性評価に関する有益な知見を得ることが可能
- 成熟した心筋スフェロイドを効率的に作製するための完全自動化プロトコールを紹介
- 自発的カルシウム振動活動の機能的動態記録および詳細解析を通じて、化合物の毒性を高精度に測定することが可能
PDF版(英語)
はじめに
Oksana Sirenko、Krishna Macha、Angelina Chopoff|モレキュラーデバイス
Ravi Vaidyanathan、Coby Carlson|FUJIFILM Cellular Dynamics, Inc.
ヒトiPSC由来細胞を用いたヒト組織モデルの構築は、創薬および安全性/毒性評価を促進する有望なアプローチです。個々の高度に専門化された細胞種を3Dで混合・共培養することで、ヒト組織により近い細胞モデルを構築することが可能です。たとえば、心臓は心筋細胞、血管内皮細胞、線維芽細胞、その他の支持細胞で構成されています。FUJIFILM Cellular Dynamics, Inc.(FCDI)は、同一のヒトiPSCドナー由来の心筋細胞(CM)、血管内皮細胞(EC)、心線維芽細胞(CF)からなる3D三重共培養モデルの作製手法を開発しました。
本研究では、CellXpress.ai 自動細胞培養システムを用いて、これらの三重共培養心筋スフェロイド(別名:iCell® Cardiospheres)の形成および維持プロセスを自動化しました。このプラットフォームは、細胞播種、定期的な培地交換、モニタリング、ならびに3D環境下でのスフェロイドのサイズおよび形態の経時解析など、細胞培養における全工程を自動化することが可能です。培養開始から2週間後、カルシウム感受性蛍光色素(Calcium 6, モレキュラーデバイス)を細胞に導入し、FLIPR Pentaハイスループットセルベーススクリーニングシステム(高速動態蛍光記録装置)を用いて自発的カルシウム振動を記録することで、機能的活性を評価しました。細胞には、心機能調節薬、イオンチャネル遮断薬、既知の心毒性化合物など、18種類の化合物パネルを投与しました。波形パターンの解析には、ScreenWorks® Peak Pro 2ソフトウェアを使用し、さらにアッセイ後にはイメージングを通じて細胞の生存率および形態の追加評価を実施しました。
iPSC技術と細胞培養の自動化、ならびに機能的カルシウム動態イメージングを組み合わせることは、複雑な細胞モデルを用いたハイスループット化合物プロファイリングにおいて、再現性と堅牢性を確保する上で極めて重要です。
材料と方法

使用装置およびソフトウェア
CellXpress.aiシステムは、細胞の播種および培養を自動化し、定期的な培地交換とスフェロイドの継続的なモニタリングを行うために使用しました。本システムは、自動細胞培養に必要な4つの主要コンポーネントを備えています:液体ハンドラー、自動インキュベーター、自動イメージャー、そして複雑なプロトコール、スケジューリング、画像解析、意思決定を自動化するAI搭載の統合ソフトウェアです。
FLIPR Pentaシステムは、3D三重共培養心筋スフェロイドからのカルシウム振動を記録・解析するために使用しました。高速EMCCDカメラにより、FLIPR カルシウム 6色素を導入した細胞の細胞内Ca²⁺濃度変化に対応する自発的な波形振動のパターンおよび周波数が測定されました。ScreenWorks Peak Pro 2ピーク解析ソフトウェアでは、ピーク数や周波数、ピーク振幅、ピークの延長、不規則性、二次ピークの出現など、複雑な振動パターンに関する複数の指標が得られました。
イメージングおよび画像解析 スフェロイドの生死判定解析は、CellXpress.aiシステムおよびソフトウェアを用いて10倍対物レンズで撮像した後に実施されました。生細胞染色には、以下の3種類の色素を混合して使用しました:Calcein AM(1 μM)、EtHD(2 μM)、Hoechst 33342核染色(2 μM)(Life Technologies)。高解像度でのハイコンテント画像解析には、ImageXpress® Micro Confocalハイコンテントイメージングシステムを用いて、異なる蛍光チャネルで抗体または色素により染色された微小組織全体の3D画像を取得しました。MetaXpress®ハイコンテント画像取得ソフトウェアに搭載されたカスタムモジュールエディター(CME)は、微小組織の3D構造を再構築し、解析内容を目的に応じて柔軟に調整できる画像解析機能も備えています。
細胞およびアッセイ
凍結保存されたヒトiPSC由来の細胞種、最適化された培地およびサプリメントは、FUJIFILM Cellular Dynamics, Inc. より市販されています。プロトコルの詳細は「Generation of 3D iCell Cardiospheres with iCell Products」というアプリケーションプロトコールに記載されており、模式的なワークフローも参照できます。 Corning製の384ウェルフォーマットの超低接着(ULA)3Dスフェロイド形成プレートを用いて、心筋細胞(CM)、血管内皮細胞(EC)、心臓線維芽細胞(CF)を65:15:20の比率で混合し、三重共培養心筋スフェロイドを形成しました。3Dスフェロイドは48時間以内に形成され、培養4〜5日目には自発的かつ規則的な収縮を開始しました。実験開始前には、3D培養系における強い同期収縮の存在を目視にて確認しています。 アッセイ当日(通常は培養14日目)、細胞に2倍濃度のFLIPR Calcium 6蛍光色素を導入し、2時間インキュベートしました。FLIPR Pentaシステムにより自発的な心筋波形が検出され、1〜2分間のベースライン記録を取得しました。その後、細胞に所定濃度の薬剤を投与し、15〜90分後に再度記録しました。
結果
CellXpress.aiシステムによる心筋微小組織の自動形成・培養・モニタリング
手作業による培養およびオルガノイドの追跡は多大な労力を要するため、CellXpress.ai自動細胞培養システムを用いて、細胞播種、培地交換、心筋スフェロイドのイメージングに関する自動化プロトコールを開発しました。三重共培養細胞は96または384ウェルのULAプレートに播種され、約14日間にわたり培養されました。培養中は48時間ごとにイメージングおよび培地交換を実施し、10倍対物レンズによる透過光画像を取得するとともに、液体ハンドラーにより培地の半量が自動的に交換されました。蛍光マーカーのイメージングおよび解析は、CellXpress.aiシステムに統合されたイメージャーを用いて行いました(図1)。培養されたスフェロイドはサイズのばらつきが少なく、アッセイ当日には強く安定した自発的活動を示しました(図2)。

図1. CellXpress.aiシステムの稼働状況 (A) CellXpress.aiシステムによる384ウェルプレートでの培地交換の様子。ハンズフリーかつ流量制御された液体ハンドリングにより、エラー率が低減され、ラボ内の他の作業に充てる時間を節約できます。 (B) 96ウェルプレートで培養されたiPSC由来の3D三重共培養心筋スフェロイドの透過光画像(10倍対物レンズ)。 (C) 3D細胞培養中のセグメンテーションおよび自動解析にはCME(カスタムモジュールエディター)が使用されました。
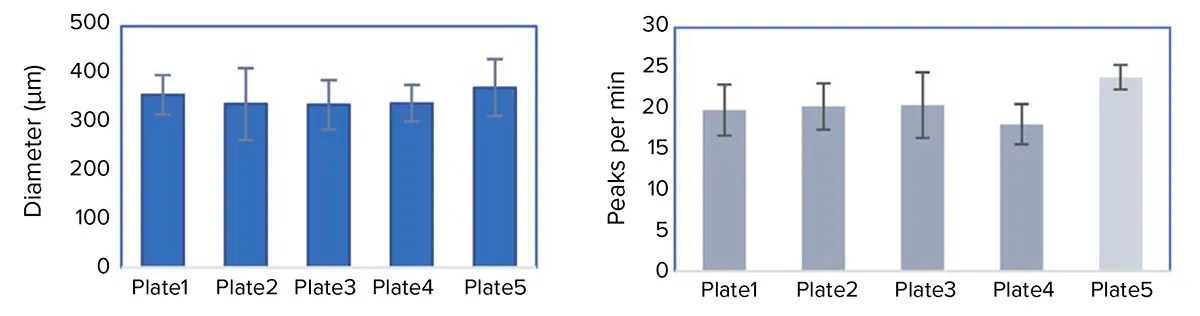
図2. 図2. 再現性の高い3Dスフェロイドの形成 形成された3D三重共培養心筋スフェロイドの直径は、実験期間中、2日ごとに測定されました。直径の測定値は、同一ウェル内、プレート間、さらには実験間においても一貫性があり、変動係数(%CV)は20%以下でした。さらに、各プレートの未処理細胞/コントロールサンプルにおいて、自発的なカルシウム振動の頻度(1分あたりのピーク数)を指標とした機能解析が行われ、こちらも%CVが25%以下と高い再現性が確認されました。
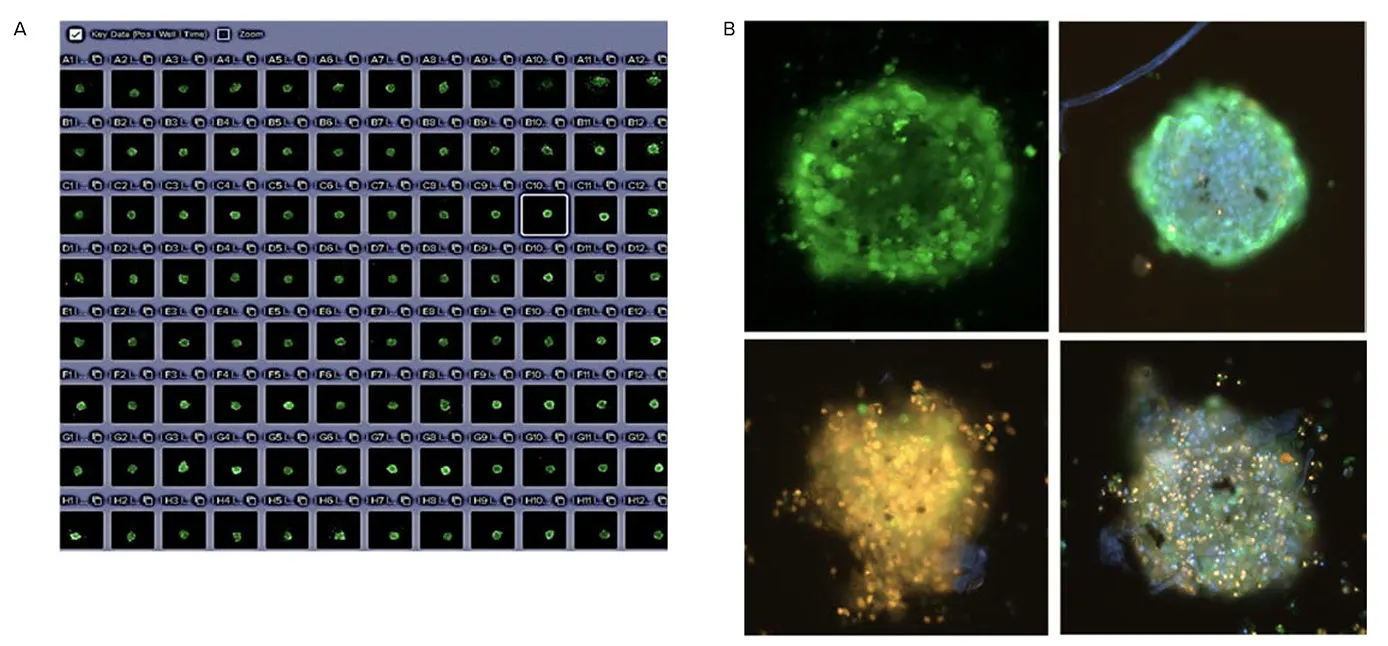
図3.CellXpress.aiによる3Dスフェロイドの画像取得 (A) FLIPRアッセイ用にCalcium 6色素で染色された心筋微小組織は、CellXpress.aiシステム(FITC、10倍対物レンズ)を用いて撮像されました。画像のZスタックから最適焦点投影を取得し、10 µm間隔で撮影されました。 (B) 細胞生存率評価用に染色された細胞の最適焦点投影画像(10倍対物レンズ)。使用された色素は、Hoechst(青)、Calcein AM(緑)、EtHD(赤)です。8枚の画像を10 µm間隔で取得し、最適焦点投影を作成しました。細胞には心毒性化合物(100 μMドキソルビシンおよび10 μMスタウロスポリン)が投与されました。3D心筋スフェロイドは、CellXpress.aiシステムを用いて撮像され(DAPI、FITC、Texas Red、10倍対物レンズ)、画像解析によりスフェロイドの面積および各蛍光色素の平均強度が評価されました。細胞生存率は、生細胞/死細胞の平均蛍光強度の正規化比として提示することが可能です。
FLIPR Pentaシステムによるカルシウム振動パターンの測定を用いた心機能および化合物効果の機能解析
自発的に収縮する3D三重共培養心筋スフェロイドは、収縮活動に対応するカルシウム振動を生じ、カルシウム感受性色素を用いて可視化することが可能です。微小組織にCalcium 6色素を導入後、FLIPR Pentaシステムにより振動が記録されました。スフェロイドには、7段階濃度の用量反応を設定した化合物パネルが三重(n=3)または四重(n=4)で投与され、通常は投与30分後にアッセイ記録が取得されました。
iCell Cardiospheresの心機能を評価するため、心機能調節薬、イオンチャネル遮断薬、既知の心毒性化合物を含む18種類の化合物パネルをスフェロイドに投与しました。hERG阻害薬、イオンチャネル遮断薬、β遮断薬など、選定されたすべての化合物は、期待される作用機序に一致したCa²⁺振動パターンの顕著な変化を示しました(図4)。たとえば、イソプロテレノールは振動頻度の増加を引き起こし、hERG遮断薬として知られるE-4031、シサプリド、フレカイニドはピークの著しい延長を誘導し、ジゴキシンは振動活動の停止をもたらしました。
振動パターンの波形解析は、ScreenWorks® Peak Pro 2ソフトウェアを用いて実施され、ピーク数または周波数、ピーク振幅、ピーク延長、不規則性、二次ピークの出現など、振動パターンの変調を特徴づける複数の指標が得られました。化合物による振動頻度の変調に対するEC₅₀値または有効濃度が算出され、表2に示されています。
| 化合物名 | EC50, µM | 説明 | 作用機序 |
|---|---|---|---|
| Amiodarone | 7.6 | K⁺チャネル遮断薬 | クラスIII抗不整脈薬 |
| Digoxin | 0.2 | 強心配糖体 | Na⁺/K⁺ポンプ阻害 |
| Droperidol | 0.6 | ドーパミン拮抗薬 | 制吐薬・抗精神病薬 |
| Verapamil | 0.4, 0.1 | Ca²⁺チャネル遮断薬 | クラスIV抗不整脈薬 |
| Isoproterenol | 1.38 | βアドレナリン作動薬 | カテコールアミン |
| Cisapride | 1.96 | セロトニン作動薬 | 消化管運動促進薬 |
| E-4031 | 0.29 | K⁺チャネル遮断薬 | クラスIII抗不整脈薬 |
| Flecainide | 0.5 | Na⁺チャネル遮断薬 | クラスI抗不整脈薬 |
| Lidocaine | 1.8 | Na⁺チャネル遮断薬 | クラスI抗不整脈薬・局所麻酔薬 |
| Ranolazine | 4.4 | 狭心症治療薬 | 非血行動態性、作用機序は完全には解明されていない |
| Mixiletine | 5 | Na⁺チャネル遮断薬 | クラスI抗不整脈薬 |
| Doxorubicin | 26 | アントラサイクリン系 | 抗生物質・化学療法薬 |
| Staurosporine | 0.23 | プロテインキナーゼ阻害薬 | アポトーシス誘導 |
| Bepridil | 1 | Ca²⁺チャネル遮断薬 | クラスIおよびIV抗不整脈薬 |
| Quinidine | 6.8 | Na⁺チャネル遮断薬 | クラスI抗不整脈薬 |
| Terfenadine | 0.8 | 抗ヒスタミン薬 | フェキソフェナジンのプロドラッグ |
| Diltiazem | 1.6 | Ca²⁺チャネル遮断薬 | 非ジヒドロピリジン系 |
表2
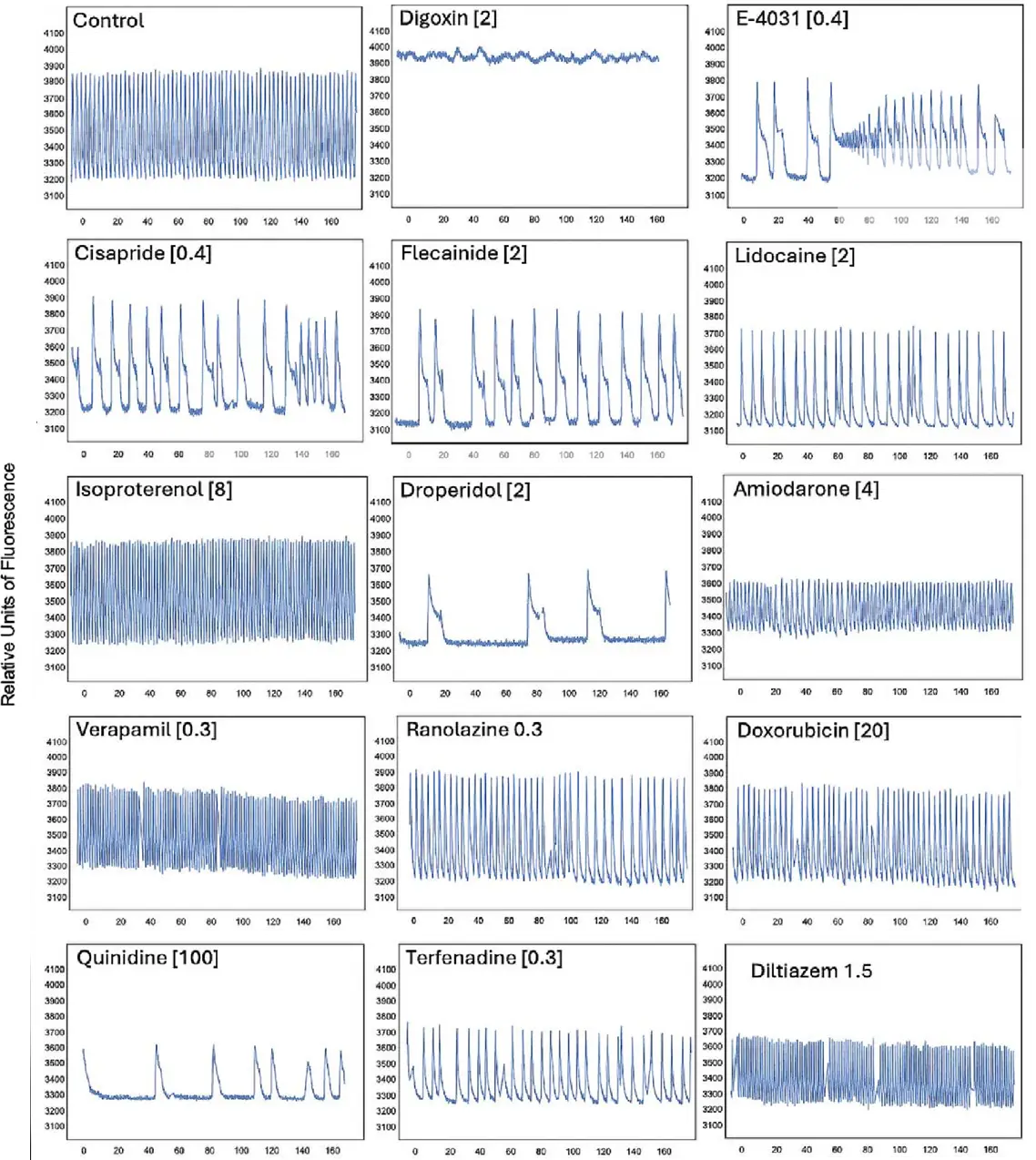
図4. 3Dスフェロイドを用いたカルシウムアッセイ 各種化合物(濃度は[μM]で表示)を3D心筋スフェロイドに投与後、カルシウム振動を測定いたしました。Ca²⁺波形はFLIPR Pentaシステムによる動態カルシウムイメージングで記録され、Peak Pro 2ソフトウェアにて解析されました。化合物投与後に得られた波形パターン(コントロールとは大きく異なるもの)は代表的なトレースとして示されております。ピーク周波数、振幅、ピークの延長、その他の指標について、化合物および濃度ごとに評価を行いました。
ハイコンテントイメージングによる細胞生存率および形態への化合物影響の評価
さらに、細胞生存率染色を施した3D微小組織に対して画像解析を行い、形態および生存率の評価を実施いたしました。3D三重共培養心筋スフェロイドに化合物を24時間投与した後、自動化されたワークフローとImageXpress® Micro Confocalハイコンテントイメージングシステムを用いて形態変化を評価しました。共焦点画像の解析では、核染色による細胞セグメンテーションを行い、Calcein AMおよびEtHD染色により生細胞数および割合を算出しました。ドキソルビシンおよびスタウロスポリンの投与により、24時間後には細胞生存率が著しく低下したことが図5に示されています。他の化合物では、細胞生存率への明確な影響は認められませんでした。
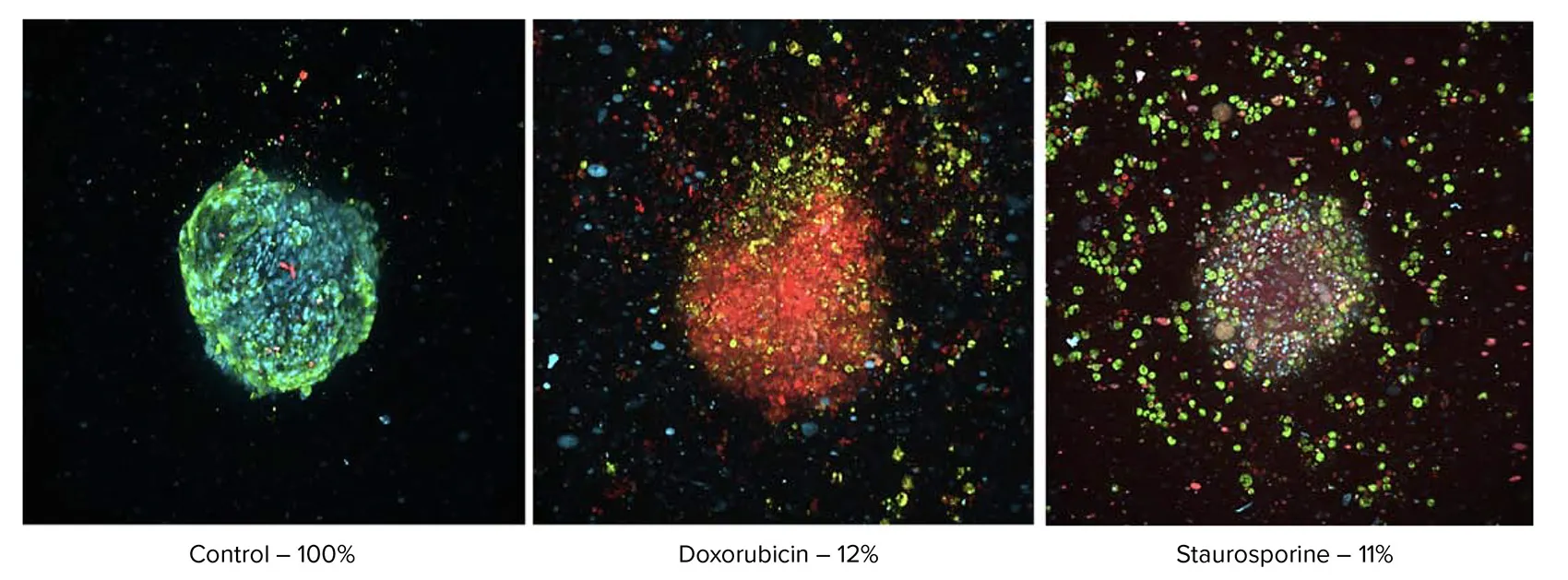
図5. エンドポイントアッセイ:ハイコンテントイメージングによる形態変化の評価 Hoechst、Calcein AM、EthDで染色された複合共焦点画像を、それぞれDAPI、FITC、Texas Redチャネルで表示しています。10倍対物レンズで撮像し、8 µm間隔で取得した15枚の画像から最大投影画像を作成しました。本例では、100 μMのドキソルビシンおよび10 μMのスタウロスポリンを投与しています。各画像の下部には、生存細胞の割合が示されています。
本研究では、CellXpress.aiシステムを用いた細胞培養ワークフローの自動化と、複雑な生物学的システムから得られる機能的および形態的な指標を通じた化合物影響のエンドポイントアッセイを実証しました。得られたデータは、ヒト心筋組織に対する潜在的な心毒性を評価するモデルとして、iPSC由来の細胞種を用いた3D微小組織の有用性と生物学的妥当性を示しています。iPSC技術と自動化された細胞培養およびイメージングの組み合わせは、複雑な細胞モデルを用いた化合物プロファイリングにおいて、一貫性とスループットを確保するために不可欠です。
まとめ
- 心機能に関連するヒトiPSC由来の細胞種から構築された3D三重共培養心筋スフェロイドは、心毒性および心機能活性薬の有効性を評価するための有用なin vitro細胞モデルです。
- カルシウム動態の解析により、心筋微小組織の機能的活性が示され、薬剤による振動パターンの変化や毒性評価の指標を提供します。
- 培地交換やイメージングを含む心筋微小組織の形成および培養に関する完全自動化手法は、複雑な生物学的システムにおける堅牢性とスループットの向上に寄与します。
- 本アッセイプラットフォームは、化合物の影響評価および心毒性の早期検出において有望な可能性を示しています。
PDF版(英語)