Application Note ヒトiPSC由来心筋スフェロイドを用いた
心筋細胞の生理機能に対する薬剤効果の評価
- ハイコンテントイメージングを用いて、心筋スフェロイドの拍動パターンをタイムラプスイメージングで取得・解析
- FLIPR Tetraシステムを使用して、全ウェルにおけるカルシウムフラックスの動態を同時に取得
- 心筋スフェロイドの生存率に対する各種化合物の影響を測定
PDF版(英語)
はじめに
細胞モデルは、in vivoの微小環境をより忠実に再現し、化合物の有効性および毒性の予測精度を高めるために、ますます複雑化しています。組織生物学や毒性評価のモデルとして、3Dスフェロイドの活用に対する関心が高まっています。3D培養を用いた高スループット定量アッセイの開発は、現在活発に研究が進められている分野です。本研究では、ヒト人工多能性幹細胞(iPSC)由来の心筋細胞から形成された3Dスフェロイドの作製方法を開発しました。**ハイコンテントイメージング(HCI)と高速動態蛍光イメージング(FLIPR)**の両方を用いて、カルシウム感受性染色による細胞内カルシウム濃度の変化を指標として、心筋スフェロイドの拍動率および拍動パターンに対する各種化合物の影響を評価しました。
心筋スフェロイドの形成
本研究では、Cellular Dynamics International(CDI)社製の凍結保存済みiCell Cardiomyocytes2を使用しました。細胞を解凍後、U底の超低接着性(ULA)96ウェルプレートに20,000細胞/ウェル、または384ウェルプレートに10,000 cells/well(Corning)で播種し、維持培地で4日間インキュベートしてスフェロイド培養を形成しました。iPSC由来心筋細胞から効率的にスフェロイドが形成され、48時間以内に構造が完成し、培養開始から3〜4日後には自発的な収縮が始まりました。これらの3D細胞モデルは、Ca²⁺感受性染色を用いることで心毒性評価に利用可能です。細胞内Ca²⁺フラックスに伴う蛍光強度の変化は、スフェロイドの収縮の代替指標として使用されました。心機能活性化剤および心毒性化合物によるベースラインの拍動パターンに対する顕著な変化が観察されました。
本研究では、iPSC由来心筋スフェロイドの拍動パターンを記録・定量・解析する2つの方法を紹介します:ハイコンテントイメージング(ImageXpress® Micro ハイコンテントイメージングシステム)、高速動態蛍光イメージング(FLIPR Tetra® システム)
ハイコンテントイメージングによる心筋スフェロイドの経時取得と解析
イメージング法により、心筋スフェロイドの正確な検出と可視化が可能となり、所望の時間間隔と頻度でタイムラプス画像スタックを取得できます。アッセイのワークフローは図1に示されています。ImageXpress Micro Confocalシステムを用いて、タイムラプス自動取得によりスフェロイド画像を取得しました。スフェロイド全体のカルシウムフラックスパターンは収縮と同期して記録されました(図2)。記録頻度は1ウェルあたり5〜10秒(またはそれ以上)の読み取り時間で、10〜20 reads/secondに設定され、20Xまたは10Xの倍率でFITC励起・蛍光フィルターを使用しました。細胞は環境制御下(37°C、CO₂ 5%)または密閉状態で維持されました。高頻度の読み取りを可能にするため、励起時間は10 ms以下に設定しました。このイメージング法は、スフェロイドサイズに関係なく効率的に機能します。3,000〜20,000 cells/wellの範囲で作製したスフェロイドをテストし、拍動頻度がスフェロイドサイズに依存しないことを確認しました(データ未掲載)。細胞は、Hoechst核染色および**FLIPR® Calcium 6 Dye(モレキュラーデバイス)**を用いて、標準プロトコールに従って染色されました。
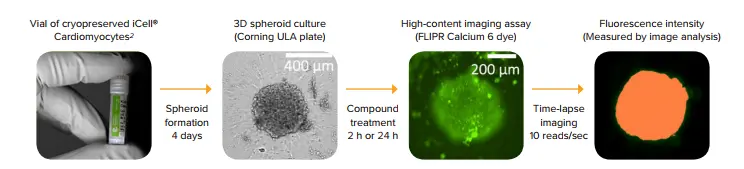
図1. アッセイワークフローの模式図 iCell Cardiomyocytes2を解凍後、U底の低接着性プレートに播種し、3D心筋スフェロイドを形成しました。培養4日後、スフェロイドに化合物処理を行い、FLIPR Calcium 6染色を施した後、ImageXpress Micro Confocalシステムを用いてタイムラプスイメージングを実施しました。
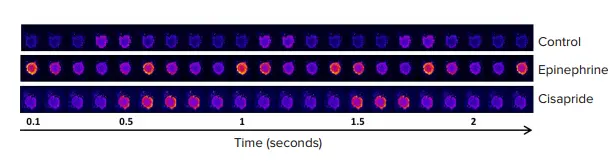
図2. Ca²⁺感受性染色を施したiPSC由来心筋スフェロイドの収縮を示すタイムラプス画像シリーズ 各画像は100ミリ秒間隔で取得されました。黄色/赤(疑似カラー表示)は高濃度のCa²⁺および収縮状態を示しています。
画像解析には**MetaXpress Journal(リクエストにより提供可能)**を使用しました。このジャーナルはスフェロイドを自動的に検出し、各時間点での平均蛍光強度を算出し、プレート形式で強度データを保存します。スフェロイド画像のタイムラプススタックを保存することで、イメージングソフトウェア内に動画クリップとして保存可能です。Display Modeで強度と時間の関係を可視化することで、拍動パターンを確認できます。各タイムラプスの強度データはExcel形式でエクスポートすることも可能です。さらに、拍動パターンの詳細解析にはSoftMax® Pro 7ソフトウェアを使用できます(図3)。このソフトウェアでは、強度データをインポートし、拍動パターンを解析して、以下の主要パラメーターを定義します:フラックス回数、拍動頻度、振幅、ピーク幅、ピーク間距離、ピークの立ち上がり時間、ピークの減衰時間。これらのパラメーターを用いて、化合物の影響(拍動頻度の増減、振幅、ピーク幅、減衰時間の変化など)の用量依存性を評価できます *1,*2。複数の試験化合物によるカルシウムフラックス頻度の濃度依存的な変化を示すグラフが図4に示されています。表1には、カルシウムフラックス頻度を指標として算出された代表的な化合物のIC₅₀値が示されています。

図3. 化合物処理された心筋スフェロイドの動態蛍光強度 画像データはSoftMaxPro 7ソフトウェアにインポートされ、拍動率、振幅、ピーク幅などの解析が行われました。図はタイムラプス強度プロットのプレートビューを示しています。
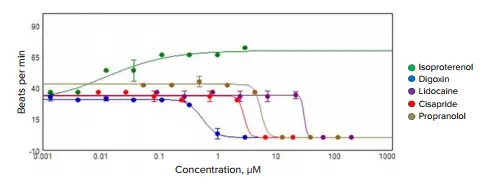
図4. 選択された化合物による拍動頻度の濃度依存的変化のグラフ
| 化合物 | IC₅₀, μM |
|---|---|
|
イソプロテレノール(緑) |
0.013 ± 0.014 |
| リドカイン(紫) | 0.54 ± 0.038 |
| シサプリド(赤) | 30.3 ± 17.4 |
| プロプラノロール(茶) | 2.82 ± 14.2 |
| ベラパミル(灰色 | 5.49 ± 5.43 |
| ソタロール | 20.9 ± 17.5 |
| デルタメトリン | 29.8 ± 16.1 |
|
アスピリン |
8.10 ± 10.5 |
| ジゴキシン(青) | 効果なし |
表1. カルシウムフラックス頻度の濃度依存的変化から算出された代表的化合物のIC₅₀値
ハイコンテントイメージングによるスフェロイドの生存率評価
このハイコンテントイメージング手法は、化合物が細胞の生存率に与える影響を評価するためにも使用できます。たとえば、化合物処理後の心筋スフェロイドに対して、以下の生存率染色を組み合わせて染色することで、生存率を評価しました:Calcein AM(エステラーゼ活性に依存するライブセル染色)、Ethidium homodimer(細胞膜透過性のない死細胞マーカー)、Hoechst(細胞膜透過性の核染色:生細胞・死細胞両方を染色)。これらは、すぐに使用可能なEarlyTox™ Live/Deadアッセイキットとして入手可能です。染色後、2時間インキュベートし、ImageXpress Micro Confocalシステムでスフェロイドをイメージングしました。10Xまたは20Xの倍率で、約150 µmの範囲を10 µm間隔でZスタックイメージングを実施しました。画像はMetaXpressソフトウェアを用いて、2Dおよび3D解析モジュールにより、スフェロイド内の生細胞および死細胞の総数を解析しました。スフェロイドの生存率マーカー解析方法については、以前の研究で報告されています *3。図5には、コントロールおよびジゴキシン処理スフェロイドの解析例が示されています。化合物の影響を多面的に評価するために、以下の指標を用いた解析が可能です:細胞数、スフェロイドサイズ、細胞の生存率。
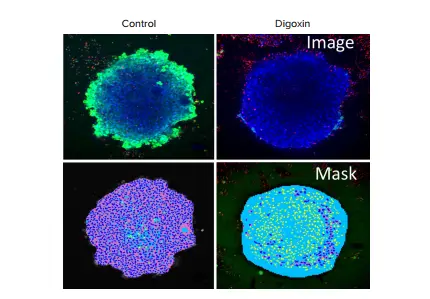
図5. iPSC由来心筋スフェロイドを用いた心毒性のイメージング(上段)コントロールおよびジゴキシン処理スフェロイドを生存率マーカーで染色した: カルセインAM(緑)、ヘキスト(青)、EthD-1(赤)。(下段)スフェロイドを青色、生細胞の細胞質をピンク色、死細胞を黄色で示した画像解析マスク。
FLIPR Tetraシステムを用いた心筋スフェロイドのCa²⁺フラックスモニタリングによるハイスループットスクリーニングの最適化
タイムラプスイメージングで1ウェルずつ取得するハイコンテントイメージングとは対照的に、FLIPR Tetraシステムではプレート全体の蛍光強度を同時に読み取ることができ、すべてのウェルにおけるカルシウムフラックスの動態を一括で取得可能です。また、同システムは自動化された液体処理およびプレートハンドリングにも対応しています。ScreenWorks Peak Proソフトウェアモジュールを使用することで、拍動プロファイルの解析と特性評価が可能となり、拍動率、ピーク頻度、ピーク幅、波形の不規則性などの多面的な出力が得られます。
iPSC由来心筋スフェロイドを用いたカルシウムフラックスアッセイは、FLIPR Tetra®システムを用いて96ウェルまたは384ウェルプレートでハイスループットスクリーニング(HTS)向けに最適化されました。スフェロイドは前述の通り、低接着性U底プレートで形成されました。FLIPR Tetraシステムでは、スフェロイドサイズが比較的大きい(300〜500 µm、10,000〜20,000細胞で形成)場合に、より効率的に検出されることが確認されました。FLIPR Calcium 6染色を用いて、細胞拍動に同期したCa²⁺フラックスの変化をモニタリングしました。試薬(2倍濃度)をプレートに添加後、37°C、CO₂ 5%で2時間インキュベートしました。スフェロイドは化合物に対して2時間または24時間処理されました。薬剤処理前の読み取りは、FLIPR Tetraシステムを用いて約8フレーム/秒で取得し、励起波長485 nm、蛍光波長530 nmで設定されました。化合物処理後の異なる時間点でも追加の読み取りを行い、処理時間の違いによる影響を評価しました。カルシウムフラックスの記録は通常約2分間行い、堅牢なデータセットを取得しました。
この高速動態蛍光イメージング手法の3D細胞モデルへの応用を示すため、心筋スフェロイドに対して以下の既知の心機能活性化剤および心毒性化合物を処理しました:αおよびβ遮断薬(イソプロテレノール、プロプラノロール、ベラパミル)、hERGチャネルに影響を与える既知化合物(ハロペリドール) イオンチャネル遮断薬(リドカイン)、環境毒性物質(ロテノン、トリフェニルリン酸などの農薬・難燃剤)。図6Aには、コントロールおよび化合物処理された心筋スフェロイドのカルシウムフラックス(拍動)パターンが示されています。予想通り、化合物処理により拍動パターンは用量依存的に大きく変化しました(図6B)。しかし、3Dスフェロイド培養で得られたIC₅₀値と、従来の2D培養で得られた値を比較したところ、アッセイ感度に有意な違いが見られ、3D培養では一般的に右方シフト(すなわち高いIC₅₀値)が認められました(表2)。これらの化合物に対する心筋スフェロイドの感受性低下が、従来の2D培養よりも予測性に優れているかどうかは、今後のさらなる検証が必要です。それでも、ミニチュア化されたiPSC由来心筋3D細胞モデルと高速動態蛍光イメージングを組み合わせることで、ハイスループット心毒性スクリーニングを支援する有用性が示されました。
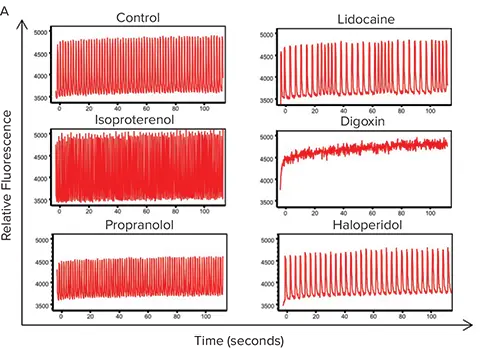
図6. 試験化合物に対する心筋スフェロイドの反応における高速動態蛍光解析 (A) FLIPR Tetraシステムで測定された、選択された化合物処理後の心筋スフェロイドにおけるCa²⁺フラックスプロファイルの比較。拍動頻度、振幅、ピーク幅などのパラメーターは、ScreenWorks PeakProソフトウェアモジュールにより自動計算されます。(B) 試験化合物による心筋スフェロイドの拍動率への影響を示す用量反応プロット。
|
化合物 |
3D IC₅₀ (μM) |
2D IC₅₀ (μM) |
|---|---|---|
| 2h | ||
| イソプロテレノール | 0.003 ± 0.001 | 0.003 ± 0.003 |
| ジゴキシン | 0.31 ± 0.042 | 0.027 ± 0.24 |
| ハロペリドール | 4.24 ± 6.31 | 0.731 ± 0.155 |
| ベラパミル | 19.5 ± 3.6 | 0.744 ± 0.77 |
| リドカイン | 48.15 ± 9.76 | 4.5 ± 8.05 |
| 24h | ||
| イソプロテレノール | 0.0002 ± 0.0012 | 0.00082 ± 0.00088 |
| ジゴキシン | 0.017 ± 0.0003 | 0.003 ± 0.005 |
| ベラパミル | 1.62 ± 3 | 0.71 |
| ハロペリドール | 1.25 ± 3.5 | 1.045 ± 0.21 |
| リドカイン | 27.3 ± 10.8 | 4.52 ± 9.12 |
| バリノマイシン | 0.123 | 0.073 ± 0.00051 |
| 塩化ベルベリン | 2.61 ± 0.68 | 0.894 ± 0.257 |
| ロテノン | 0.131 | 0.051 |
| メチル水銀 | 6.41 | 0.972 |
| デルタメトリン | 33.4 ± 9.09 | 6.92 ± 1.54 |
| リン酸トリフェニル | 15.3 ± 11.9 | 7.23 ± 9.32 |
| トリクレジルホスフェート | 14.8 ± 10.8 | 12.4 ± 11.4 |
| テトラオクチル | 33.5 | 14.98 |
| サリドマイド | 毒素なし | 毒素なし |
| トルエン | 毒素なし | 毒素なし |
表2. 試験化合物処理後のiPSC由来心筋細胞におけるカルシウムフラックスIC₅₀値の比較(3Dスフェロイド vs. 従来の2D培養)
まとめ
本研究では、スフェロイドの生存率アッセイに加え、FLIPR Tetraシステムおよびタイムラプスハイコンテントイメージングアッセイを用いた心筋スフェロイドのカルシウムフラックス測定が、ハイスループットスクリーニングに適していることを示しました。両システムは、ヒトiPSC由来心筋細胞から構築されたin vitro 3D細胞モデルを用いた心毒性評価において有用性を示しています。
参考文献
- Sirenko, O., C. Crittenden, N. Callamaras, J. Hesley, Y.-W. Chen, C. Funes, I. Rusyn, B. Anson, and E. F. Cromwell. Chen, C. Funes, I. Rusyn, B. Anson, and E. F. Cromwell. "Multiparameter In Vitro Assessment of Compound Effects on Cardiomyocyte Physiology Using IPSC Cells". Journal of Biomolecular Screening 18.1 (2012): 39-53. Web.
- Sirenko, Oksana, Evan F. Cromwell, Carole Crittenden, Jessica A. Wignall, Fred A. Wright, and Ivan Rusyn. 「Toxicology and Applied Pharmacology 273.3 (2013): 500-07. Web.
- Sirenko, Oksana, Michael K. Hancock, Jayne Hesley, Dihui Hong, Avrum Cohen, Jason Gentry, Coby B. Carlson, and David A. Mann. "Phenotypic Characterization of Toxic Compound Effects on Liver Spheroids Derived from IPSC Using Confocal Imaging and Three-Dimensional Image Analysis". ASSAY and Drug Development Technologies 14.7 (2016): 381-94. Web.
ImageXpress®ハイコンテントイメージングシステムについて詳しくはこちら >>
PDF版(英語)