Application Note 自動細胞イメージングで
CFPタグ核タンパク質のトランスダクション効率を測定
- CFP波長範囲の蛍光色素を用いてマルチカラーアプリケーションを実施します
- 明視野で取得した細胞を解析します
- 事前設定された解析モジュールを使用してトランスダクション効率を定量します
- オンザフライ解析により、画像取得と同時にデータを生成します
PDF版(英語)
Matthew Hammer|アプリケーションサイエンティスト|モレキュラーデバイス
Shawn Nielsen Alvarado, PhD|フィールドアプリケーションサイエンティスト|モレキュラーデバイス
はじめに
1960年代に緑色蛍光タンパク質が発見されて以来、可視光スペクトル全体をカバーする多様な蛍光タンパク質(FP)とそのバリアントが開発されてきました。これらの遺伝子コード化蛍光タンパク質は、細胞生物学の分野に革命をもたらしました。シアン蛍光タンパク質(CFP)は、FRETなどのマルチカラーアプリケーションに有用であることから大きな関心を集めています。これは、CFPの励起および蛍光スペクトルがほとんど使用されない波長範囲にまたがっているため、さまざまな蛍光色素とのマルチプレックス化に理想的だからです。
蛍光タンパク質技術と自動顕微鏡の進歩により、研究者は生細胞内での遺伝子機能や動的プロセスを研究する能力を拡大しました。蛍光タンパク質は、目的の遺伝子に融合したレポーター遺伝子として一般的に使用されます。FPタグ付き遺伝子産物が細胞によって正常に発現されると、その機能を研究し、タンパク質、オルガネラ、細胞区画の局在を追跡するためにイメージングできます *1。
FP融合産物の直接可視化は、細胞内で新しい遺伝物質を発現させる方法の最適化にも役立ちます。トランスフェクションとトランスダクションは、核酸やタンパク質を細胞に導入するための一般的な方法です。しかし、どちらの方法も詳細な計画、最適化、時間を必要とし、遺伝物質がどれだけ効率的に導入され、その後発現されるかによって制限されます。これらの要因は、トランスダクションまたはトランスフェクション効率を評価するための堅牢で正確な方法の使用を必要とします。
このアプリケーションノートでは、ImageXpress® Pico 自動細胞イメージングシステムとCellReporterXpress® 画像取得・解析ソフトウェアを使用し、トランスダクション効率の評価によるベクター濃度の最適化における有用性を紹介します。CellLight™ Nucleus-CFP BacMamトランスダクション試薬を用いて、2種類の細胞株に一過性トランスダクションを行いました。この試薬は、遺伝物質を送達するためにBacMamベクターシステムを利用します。ここでは、ImageXpress Picoで明視野およびCFPチャンネルを使用した画像取得と、CellReporterXpressソフトウェアによる堅牢なトランスダクション効率解析について説明します。さらに、CFPチャンネルのマルチカラーイメージングへの有用性を強調します。
材料
- ImageXpress Pico自動細胞イメージングシステム(モレキュラーデバイス)
- CellReporterXpress画像取得・解析ソフトウェア(モレキュラーデバイス)
- HeLa細胞(ATCC)
- U2OS細胞(ATCC)
- 96ウェルマイクロプレート(Greiner)
- CellLight Nucleus-CFP BacMam 2.0 (ThermoFisher)
- MitoTracker Deep Red FM(ThermoFisher)
- AlexaFluor 546 Phalloidin (ThermoFisher)
方法
BacMamトランスダクション試薬によるHeLaおよびU2OS細胞のトランスダクション
このトランスダクションアッセイのワークフローは図1に示されています。HeLaおよびU2OS細胞を96ウェル透明底マイクロプレートに1ウェルあたり8,000細胞で播種しました。細胞は37°C、5% CO₂で一晩インキュベートしました。その後、CellLight Nucleus-CFP BacMam 2.0(BacMam Nucleus-CFP)を、1細胞あたり25、50、75、100粒子(PPC)の4種類の濃度でウェルに添加しました。この試薬は、SV40核局在化配列とCFPを融合したBacMam構築体で構成されています。各PPC濃度処理は三重複で実施し、細胞はトランスダクション試薬とともに37°C、5% CO₂で19時間インキュベートしました。イメージング前に、ウェルから培地とBacMam Nucleus-CFPを除去し、ライブセルイメージング用培地に置換しました。

図1. ImageXpress PicoシステムとCellReporterXpressソフトウェアを用いたCellLight BacMamトランスダクション効率アッセイのワークフロー。U2OSおよびHeLa細胞は、異なるPPC濃度で19時間BacMam試薬とインキュベートしました。画像は10X対物レンズで取得し、透過光セルスコアリング解析モジュールをオンザフライで実行しました。
ラベルフリーおよび蛍光イメージング
10X画像はImageXpress Picoシステムを用いて明視野およびCFPチャンネルで取得しました。チャンネルの露光時間は、明視野で3 ms、CFPで1000 msでした。1ウェルあたり9サイトを撮影し、ウェルの47.52%をカバーしました。取得設定は、明視野画像をわずかに焦点を外すことでコントラストを強調し、明視野解析に最適化しました(図2および図3)。
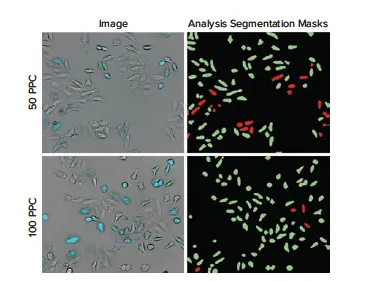
図2. CellLight Nucleus-CFP BacMam添加19時間後のHeLa細胞の代表的な10X画像。(左)50 PPCまたは100 PPCで処理したウェルの画像。トランスダクションされたHeLa細胞(明視野+シアン)が、非トランスダクション細胞(明視野のみ)と比較して明確に視認できます。(右)CellReporterXpressソフトウェアの透過光セルスコアリング一般モジュールを使用し、CFP発現に基づいて細胞を陽性(緑)または陰性としてスコアリングしました。
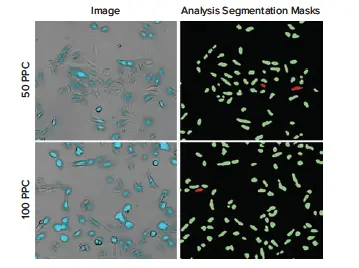
図3. CellLight Nucleus-CFP BacMam添加19時間後のU2OS細胞の代表的な10X画像。(左)50 PPCまたは100 PPCで処理したウェルの画像。トランスダクションされたU2OS細胞(明視野+シアン)が明確に視認できます。(右)CellReporterXpressソフトウェアの透過光セルスコアリング一般モジュールを使用し、CFP発現に基づいて細胞を陽性(緑)または陰性(赤)としてスコアリングしました。
マルチカラー染色
4%パラホルムアルデヒドで固定する前に、細胞をMitoTracker Deep Redで30分間染色し、その後PBSで1回洗浄しました。固定後、細胞を洗浄、ブロッキング、透過処理し、AlexaFluor 546ファロイジンで染色しました。細胞はPBSで2回洗浄後、ImageXpress Picoシステムを用いて40X対物レンズおよびCFP、TRITC、Cy5チャンネルでイメージングしました。
トランスダクション効率の自動画像解析
CellReporterXpressの透過光セルスコアリング一般解析モジュールは、取得中にオンザフライで実行され、HeLaおよびU2OS細胞のトランスダクション効率を解析しました。最小限のユーザー操作で、解析モジュールは明視野チャンネルを使用して細胞を定量し、その後CFP発現に基づいて陽性または陰性としてスコアリングしました。明視野画像をわずかに焦点を外すことで、低コントラストで細いU2OS細胞の解析に最適なコントラストが得られました(図3)。解析から生成された多パラメータリードアウトは、トランスダクション実験結果の包括的なビューを提供しました(図4A)。これらのリードアウトには、陽性対陰性細胞数と割合、全細胞および陽性細胞の面積と強度、さらに個々の細胞測定値が含まれます。
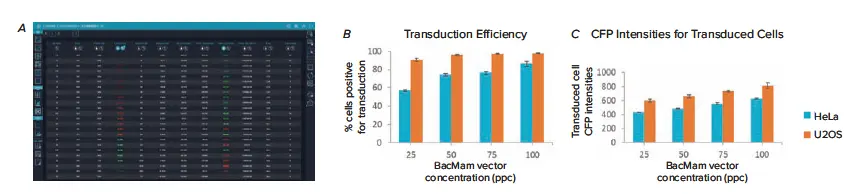
図4. CellLight Nucleus-CFP BacMamを異なる濃度で処理したHeLa細胞とU2OS細胞のトランスダクション効率結果の比較。(A)トランスダクション効率解析から生成された多パラメータリードアウトは、インタラクティブデータテーブルに表示され、ワンクリックでCSVファイルに簡単にエクスポートできます。ヒートマップは、トランスダクション陽性細胞の割合(% positive cells)および陽性細胞の平均面積測定値に適用され、データテーブルは% positive cells測定値でソートされ、最も高い割合のウェルがテーブルの上部に表示されます。このデータは、(B)トランスダクション陽性細胞の割合および(C)陽性細胞のCFP強度によって、U2OS細胞がHeLa細胞よりも容易にトランスダクションされることを示しました。
結果
HeLa細胞とU2OS細胞におけるトランスダクション効率結果の比較
解析結果は、BacMam Nucleus-CFP PPC濃度の増加がトランスダクション効率の増加と相関し、U2OS細胞がこのBacMamシステムによるトランスダクションに対してより高い感受性を示すことを明らかにしました(図4)。最も顕著な効率増加は、両細胞タイプで25 PPCと50 PPCの処理間で認められましたが、この傾向はHeLa細胞でより顕著でした。HeLa細胞では50 PPCと75 PPCの処理間に統計的な差はありませんでしたが、100 PPCではトランスダクション効率が約10%増加しました。一方、U2OS細胞では、50 PPC、75 PPC、100 PPC間で効率の差は有意ではなく(図4B)、各PPC濃度で90%以上のトランスダクション効率が得られました。
同様に、CFP-SV40核局在化配列の全体的な発現は、PPC濃度の増加に伴い増加しました。これは、陽性トランスダクション細胞のCFP強度を測定することで評価されました(図4C)。個々の細胞データも解析し、CFP強度が最も高いHeLaおよびU2OS細胞の特徴を特定しました。これらは小さな細胞面積と丸みを帯びた形態を持つ細胞であり(図5)、この丸い形態は分裂中の細胞に特徴的ですが、確認には生存性、増殖、または細胞周期マーカーによる染色が必要です。
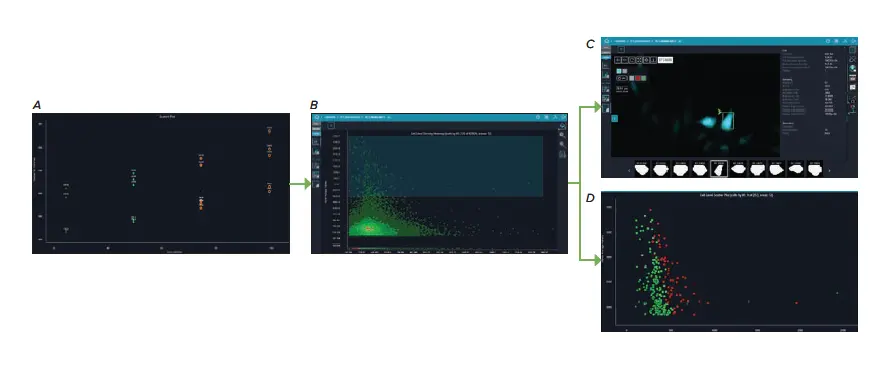
図5. CFP強度が最も高かったHeLa細胞とU2OS細胞のセルレベルデータです。(A) 75 PPC および 100 PPC 処置のウェルは、CFP 強度が最高レベルであったため、強調表示されました。(B)細胞レベルの密度ヒートマップは、細胞面積とCFP強度の関係を表示し、各データ点は個々の細胞を表します。最高レベルのCFP強度を持つ細胞を選択し、(C)細胞イメージギャラリーおよび(D)細胞レベル散布図に表示しました。セルレベル散布図のヒートマップターゲットはCFP積分強度です。
さらに、自動細胞顕微鏡によるCFP-SV40融合タンパク質の可視化は、この挿入キメラタンパク質の局在を明らかにしました。CFP発現の増加に伴い、SV40タンパク質の細胞質局在が増加することが確認されました(図5C)。これは、最高のトランスダクション効率を得るための最適なPPC濃度と、導入された遺伝物質の発現および局在の最適化との間にバランスがあることを示しています。高いトランスダクション効率と固定後のCFPシグナルの持続性は、このBacMam試薬がライブセルイメージングおよびエンドポイント固定細胞染色アプリケーションの両方に有用であることをさらに示しました。さらに、ImageXpress PicoでCFPラベル核をイメージングできることにより、他の蛍光色素で染色された追加の細胞構造をイメージングするために、より一般的に使用されるチャンネルを解放できます(図6)。
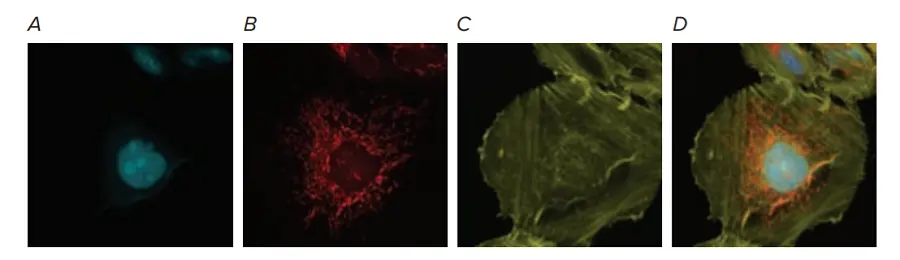
図6. U2OS細胞のマルチカラー染色は、追加の蛍光色素とのマルチプレックス化におけるCFPチャンネルの有用性を強調しました。40X画像は、(A)BacMam Nucleus-CFPトランスダクション試薬75 PPCでトランスダクションされたU2OS細胞(核、シアン)、(B)トランスダクション後にMitoTracker Deep Redで染色されたミトコンドリア(赤)、(C)AlexaFluor 546ファロイジンで染色されたアクチン(黄色)を示します。(D)CFP、TRITC、Cy5の3チャンネルを統合したオーバーレイ画像を示します。
結論
BacMam試薬はHeLa細胞およびU2OS細胞を効果的にトランスダクションし、ライブセルイメージング用途においてより一般的に使用される核染色に代わる適切な選択肢を提供します。ImageXpress PicoシステムとCellReporterXpressソフトウェアの有用性を、核トランスダクションの評価および定量化において実証しました。堅牢なフォーカス方法、事前設定された解析モジュールおよびデータレポートにより、ImageXpress Picoシステムはトランスダクション/トランスフェクションアッセイプロトコールの評価と最適化に不可欠なツールとして機能しました。さらに、CFPのイメージング能力は、GFPなどのより一般的な蛍光タンパク質に代わる適切な選択肢を提供し、追加の細胞マーカーや構造の染色・可視化のために、より一般的に使用される蛍光チャンネルを解放します。
リソース
- Haney SA, Bowman D, Chakravarty A. An introduction to high content screening. Wiley. 2015.
PDF版(英語)