Application Note 磁気バイオプリント技術で
HepG2スフェロイドのアポトーシスを測定
- わずか15分で磁気バイオプリントによるスフェロイドを作製します
- フラットボトムマイクロプレートのウェル中央にスフェロイドを配置し、結果を迅速に1サイトでイメージングします
- 均一な蛍光アッセイを用いて、1時間以内にスフェロイドのアポトーシスを評価します
PDF版(英語)
はじめに
Cathy Olsen, PhD | Sr. Applications Scientist | モレキュラーデバイス
2D細胞培養は、細胞プロセスの広範な研究において100年以上使用されてきました。しかし、最近の研究では、2Dシステムでの応答がin vivoで観察されるものと大きく異なる場合があることが示されています(Duval et al., 2017)。2D培養を3Dスフェロイドに変換するためのさまざまな方法が考案されていますが、多くはスフェロイドの形成に長時間を要し、取り扱いが難しいという課題があります。
Greiner Bio-Oneの384ウェルバイオプリンティングキットは、スフェロイドを迅速に形成し、最大3週間培養できる簡便な方法を提供します。まず、2D培養中の細胞をNanoShuttle™-PL(金、酸化鉄、ポリ-L-リジンからなるナノ粒子アセンブリ)で処理し、磁化します。その後、細胞をトリプシン処理し、セルリペレント384ウェルプレートに移し、プレートを384個の磁石を備えたスフェロイドドライブの上に置きます。これにより、磁化された細胞はウェル底部で磁石の形状に沿って凝集し、15分から数時間でスフェロイドが形成されます。その後、プレートはインキュベーターに移され、さまざまな実験条件下で処理できます。
ここでは、Greiner Bio-Oneの磁気3D細胞培養システム(m3D)を用いてHepG2細胞をバイオプリントする方法を示します。形成されたスフェロイドはアポトーシスを誘導する化合物で処理し、モレキュラーデバイスEarlyTox™ Caspase-3/7-D NucView 488アッセイキットを用いてアッセイしました。この均一な手法により、ハンズオンタイムを削減できます。スフェロイドはSpectraMax® i3x マルチモードマイクロプレートリーダーとSpectraMax® MiniMax 300 イメージングサイトメーターでイメージングし、結果はSoftMax® Proソフトウェアで解析し、定量的なデータを得ました。
材料
- 384-Well Bioprinting Kit (Greiner Bio-One m3D) には以下が含まれます:
・NanoShuttle-PL (600μLバイアル2本)
・384-Well スフェロイドドライブ (1)
・384ウェルホールディングドライブ(1)
・Greiner Bio-One 384-Well Cell Culture Microplate with Cell-Repellent Surface with Flat bottom - HepG2 ヒト肝細胞癌細胞株(ATCC)
- イーグル最小必須培地 (ATCC)
- BenchMark™ ウシ胎児血清 (Gemini Bio-Products)
- ペニシリン-ストレプトマイシン(10,000 U/mL、ThermoFisher.)
- スタウロスポリン(Sigma)
- アニソマイシン(Sigma)
- EarlyTox Caspase-3/7-D NucView 488アッセイキット(モレキュラーデバイス)
- SpectraMax i3x マルチモードマイクロプレートリーダー(モレキュラーデバイス)
・SpectraMax MiniMax 300イメージングサイトメーター(モレキュラーデバイス)
方法
HepG2細胞の培養
HepG2ヒト肝細胞癌細胞は、10%ウシ胎児血清(FBS)と1%ペニシリン/ストレプトマイシンを添加したEagle’s Minimum Essential Medium(EMEM)で培養しました。スフェロイド形成の準備として、細胞をT-25培養フラスコで80%コンフルエンスまで培養しました。その後、NanoShuttle-PLで以下の手順に従って処理しました:
-
NanoShuttle-PLを室温で少なくとも15分間静置しました。
-
バイアル内でNanoShuttle-PLをピペッティングで上下に少なくとも10回混合しました。
-
NanoShuttle-PLを200 μL、T-25フラスコ内の培地に直接添加し、37°Cで一晩インキュベートしました。
スフェロイド形成
翌日、磁気スフェロイドドライブを70%エタノールで拭き取り、無菌状態を保つためバイオセーフティキャビネットに設置しました。NanoShuttle-PLで一晩処理したHepG2細胞をトリプシン処理後、カウントし、培養液で20,000 cells/mLに再懸濁しました。この濃度は、50 μL/ウェルで播種した場合に1,000 cells/wellとなります。セルリペレント384ウェルプレートを384ウェルスフェロイドドライブの上に置き、細胞懸濁液を各ウェルに50 μLずつ播種しました。プレートを磁気ドライブ上に15~30分間置き、細胞がウェル底部で磁石の形状に沿って凝集(プリント)するようにしました。
バイオプリント後、プレートをスフェロイドドライブから取り外し、インキュベーターに移しました。バイオプリント後2日目と5日目に、スフェロイドをSpectraMax MiniMax 300 イメージングサイトメーターの透過光(TL)チャンネルでイメージングしました(設定は表1に示します)。イメージング前に、プレートをホールディングドライブに置き、各ウェルのスフェロイドを中央に配置しました。これにより、各ウェルの単一スフェロイドを1サイトで撮影できました。
| 透過光 | パラメータ | 蛍光 |
|---|---|---|
| 光学構成 | MiniMax | |
| 読み取りモード | Imaging | |
| 読み取りタイプ | Endpoint | |
| 波長 | 透過光 | 蛍光 励起波長:456 nm 発光波長:541 nm |
| プレーティングタイプ | 384ウェルグライナーblk/clrbtm* | |
| 読み取り領域 | [撮像するウェルを選択] | |
| ウェルエリア設定 | 1 サイト | |
| 画像取得設定 | 露光: 7 ms フォーカス調整 100 μm |
露光: 11 ms フォーカス調整 100 μm |
表1. MiniMaxサイトメーターでスフェロイド画像を取得するための設定 SoftMax Proソフトウェアに記載されているプレートタイプを使用しました。設定は、バイオプリント後2日目および5日目に取得した透過光(TL)画像に対応しています。蛍光設定は、EarlyTox™ Caspase-3/7-D NucView 488アッセイキットでアッセイした化合物処理スフェロイドのイメージングに使用しました。
化合物処理
HepG2細胞でアポトーシスを誘導することが知られている化合物、アニソマイシンとドキソルビシンを培養液で希釈し、スフェロイドに添加するためのワーキング溶液を調製しました。アニソマイシンのワーキング溶液は25 μMから0.01 μMまで、1:3の希釈系列で作製しました。ドキソルビシンのワーキング溶液は3 μMから0.0001 μMまで、同様に1:3の希釈系列で作製しました。スフェロイドバイオプリント後5日目に、スフェロイドを含むプレートをホールディングドライブに置き、スフェロイドをウェル底部に保持した状態で培地を除去し、アニソマイシンまたはドキソルビシンのワーキング溶液に置換しました。細胞は化合物で4日間処理しました。処理後、アポトーシスをアッセイしました。
アポトーシスアッセイ
EarlyTox™ Caspase-3/7-D NucView 488アッセイキットを使用し、化合物処理後4日間の各スフェロイドにおけるアポトーシス活性レベルを測定しました。DMSO中のNucView 488 Caspase-3基質1 mMストックを培養液で7.5 μMに希釈し、スフェロイドに添加しました。細胞は室温で15~30分間、遮光下でインキュベートしました。
イメージングはSpectraMax MiniMax 300 イメージングサイトメーターを使用し、541 nmの緑色蛍光チャンネルで実施しました(設定は表1に記載)。画像はSoftMax Proソフトウェアで収集・解析しました。スフェロイド解析には「Set Size and Intensity」設定を使用し、最小幅を200 μm、最大幅を1000 μmに設定しました。「Intensity Above Background」は200に設定しました。これらの設定により、ソフトウェアがスフェロイドのみを解析し、その他の細胞やデブリを除外できるようにしました。
結果
バイオプリントされたHepG2スフェロイドは、数日間培養可能な丸くコンパクトな構造を形成し、化合物処理のスケジューリングに柔軟性を提供しました。バイオプリント後48時間および5日目に撮影したスフェロイド画像は、細胞配置の進行を示しています(図1)。
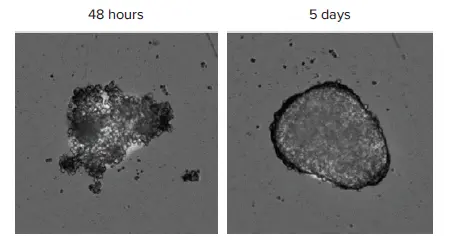
図1. MiniMaxサイトメーターのTLチャンネルで撮影したスフェロイド 同一ウェルの画像を、スフェロイドバイオプリント後48時間および5日目に撮影しました。
アニソマイシンまたはドキソルビシンでスフェロイドを処理すると、濃度依存的にアポトーシスが誘導されました。EarlyTox™ Caspase-3/7-D NucView 488アッセイキットを使用して、アポトーシス細胞の核を緑色に蛍光染色し、MiniMaxサイトメーターで容易に検出できました(図2)。スフェロイドは総蛍光強度で解析され、総アポトーシス活性量を示しました(図3)。
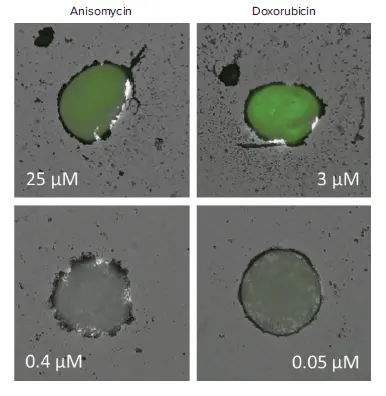
図2. TL画像と蛍光画像のオーバーレイ スフェロイドは高濃度(上段)または低濃度(下段)のアニソマイシンまたはドキソルビシンで処理され、EarlyTox™ Caspase-3/7-D NucView 488アッセイキットでアッセイしました。TLチャンネルと緑色蛍光チャンネルで撮影した画像をオーバーレイしました。
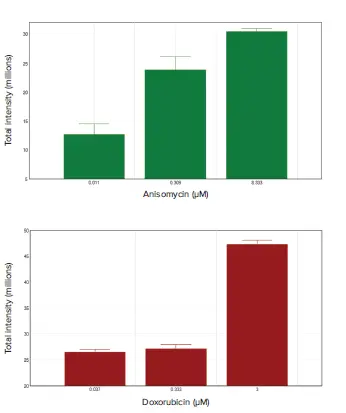
図3. アニソマイシンおよびドキソルビシン処理スフェロイドのアポトーシス解析 EarlyTox™ Caspase-3/7-D NucView 488アッセイキットでアッセイし、MiniMaxサイトメーターでイメージング後、スフェロイドの総蛍光強度をSoftMax Proソフトウェアで化合物濃度に対してプロットしました。低、中、高濃度の化合物がここに示されています。
結論
スフェロイドバイオプリンティングは、細胞を三次元構造に迅速に凝集させ、単層培養細胞よりも高い生物学的関連性を提供する方法です。HepG2細胞は単層培養で磁化され、m3Dシステムを用いてバイオプリントされました。形成されたスフェロイドはEarlyTox™ Caspase-3/7-D NucView 488アッセイキットでアポトーシスを評価しました。SpectraMax i3xプレートリーダーとMiniMaxサイトメーターにより、各ウェル1サイトで効率的なスフェロイドイメージングと、SoftMax Proソフトウェアによるアポトーシスの定量解析が可能になりました。
参考文献
Duval K, Grover H, Han LH, Mou Y, Pegoraro AF, Fredberg J, and Chen Z. 'Modeling physiological events in 2D vs. 3D cell culture.'. Physiology (2017); 32(4): 266-277.
PDF版(英語)