Application Note 3Dスフェロイド解析を10倍速に:
SymphonyとVersaGelの革新
- SymphonyとVersaGel 3D培養プラットフォームを用いた3Dスフェロイドでの創薬スクリーニング
- QuickIDターゲットイメージングにより、データ取得速度が10倍に
- 従来比で画像数を20分の1に削減
- 3Dオブジェクトや2D投影画像を用いた高精度セグメンテーション
PDF版(英語)
はじめに
Jayne Hesley|シニアアプリケーションサイエンティスト|モレキュラーデバイス
Kolin C. Hribar|サイプレ社創設者兼CEO
ほとんどのin vitro細胞培養は2Dで行われ、細胞は平面上で増殖します。しかし、薬剤をスクリーニングするために細胞を2Dで培養することは、細胞外マトリックス(ECM)からのシグナルが、細胞が異なる化合物にどのように反応するかに影響を与えるかを捉えることができないため、生体内で何が起こるかの限られたイメージしか得られません。その代わりに、がん細胞やスフェロイドをマイクロプレートで培養し、3Dマトリックスでイメージングすることで、in vivoの腫瘍微小環境をより忠実に模倣したモデルで薬剤をスクリーニングすることができます。
ここでは、新規の光架橋性3D細胞培養プラットフォームであるSymphony® 装置とVersaGel® ECMハイドロゲルをImageXpress® Micro Confocalハイコンテントイメージングシステムと組み合わせ、ハイスループットなスクリーニングに適した3Dアッセイを実証します。VersaGelは、in vitroおよびex vivoの3Dアッセイに使用される光架橋性ECMハイドロゲルです。この調整可能なECMハイドロゲルはヒトの生理を再現し、多くの種類のセルをサポートします。がん細胞の懸濁液やスフェロイドをVersaGelに封入することができます。いったん細胞が樹立されると、化合物を添加し、次いで細胞染色を行い、その後培養液をイメージングすることができます。
さらにスループットを向上させるため、MetaXpress®ハイコンテント画像取得・解析ソフトウェアを使用すると、1~4個のスフェロイド/ウェルしか観察できない実験でもQuickIDを使用できます。QuickIDでは、プレート全体を低倍率で高速スキャンし、スフェロイドを含むウェルまたは視野のみを高倍率で複数のZ平面で再イメージングします。複数のがん細胞株を用いて、3種類のVersaGel硬度条件下で最適化されたスフェロイド成長の結果を提示します。これらのスフェロイドに抗がん剤を処理することで、SymphonyおよびVersaGelとImageXpress Micro Confocalシステムを組み合わせたワークフローが、創薬スクリーニングにおいて強力かつシンプルなソリューションであることを示します。(図1)。

図1. Symphony と VersaGel 3D 培養システムの後に ImageXpress® Micro Confocal システムでイメージングする方法は、ハイスループットな薬剤スクリーニングに適した生理学的手法です
材料
- 実証されたがん細胞株 - U2OS, MCF-7, HCT-116
- ガラス底96ウェルマイクロプレート(Greiner)
- EarlyTox Caspase-3/7-D NucView 488アッセイキット、エクスプローラー(モレキュラーデバイス、PN R8348)
- EarlyTox Live/Deadアッセイキット、エクスプローラー(モレキュラーデバイス、PN R8340)
- VersaGel ECMハイドロゲル(Cypre, Inc.)
- Symphonyインストゥルメンテーション(Cypre, Inc.)
- ImageXpress®Micro ConfocalハイコンテントイメージングシステムとMetaXpressハイコンテント画像取得・解析ソフトウェア(モレキュラーデバイス)
3D VersaGelでのスフェロイド増殖とイメージング方法
SymphonyとVersaGel 3D培養プラットフォームは、まず液体VersaGelを体積比1:1で培地中の細胞またはスフェロイドと混合するという簡単な技術を用います。次に、VersaGelとスフェロイドの混合物をSymphonyで架橋し、プレート全体に低強度の青色光を60秒間照射してウェル内のゲルを重合させます。その後、ImageXpress® Micro Confocalシステムを用いてスフェロイドをイメージングすることができます。VersaGelは微細孔性なので、マトリックスに封入した後、細胞を低分子化合物や抗体で処理し、染色し、ホルムアルデヒド固定することができます。マトリックスはプレートに接着したままであり、固定後の構造を損なうことなく4℃で保存することができます。
QuickIDの特定のオブジェクトを用いたイメージング効率の向上
QuickIDは、96ウェルプレート内でイメージングするスフェロイドを特定のオブジェクトにすることでイメージングを効率化しました。まず、2倍の対物レンズを使用して、1視野でウェル全体を撮影しました。対象オブジェクトが特定され、そのXおよびY座標が、複数のZ平面にわたる3つのWavelengthで高倍率の画像を自動的に得るために使用されました。このプロセスは、手動でスフェロイドを高倍率でイメージングするよりも10倍速く、保存が必要な高解像度の画像の生成は20倍少なかったです(図2)。
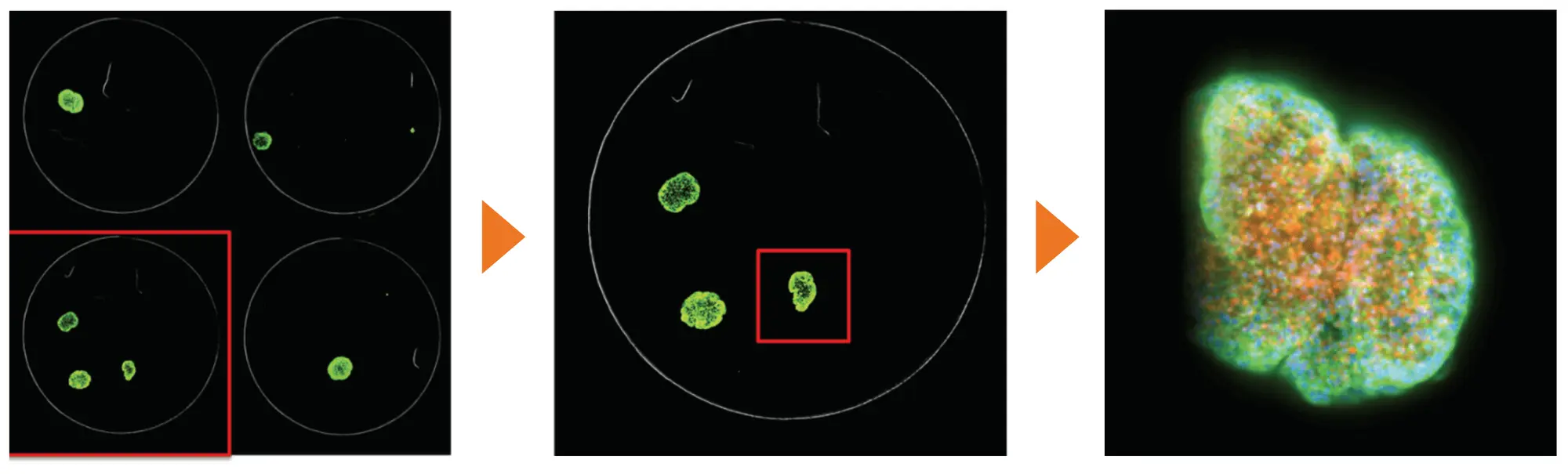
図2. スフェロイド画像取得の効率化にQuickIDを使用 1つの視野でウェル全体を見るために低倍率で取得された画像は、複数のz平面にわたって3つのWavelengthsを使用して高倍率で自動再画像化するための対物レンズを特定するために使用されました。
増殖および染色条件の最適化
MCF-7乳がん細胞由来のスフェロイドの培養条件を最適化するために、まず単一スフェロイドを、丸底96ウェルプレートに1,500細胞/ウェルをプレーティングして超低付着マイクロプレートで増殖させ、3~5日間培養しました。次に、培地中のスフェロイドを3種類のVersaGel製剤と体積比1:1で組み合わせ、\( \frac{50\,\mu\mathrm{L}}{\mathrm{well}} \)をガラス底96ウェルマイクロプレートに移しました。Symphony装置を用いてゲルを重合し、カプセル化したスフェロイドをさらに3日間増殖させた後、固定し、HoechstとPhalloidin-AlexaFluor 546で染色しました。MCF-7スフェロイドの共焦点画像から、スフェロイドは通常、硬いVersaGel中ではよりコンパクトに保たれ、柔らかい製剤中ではあまり球状に成長しないことが明らかになりました(図3)。
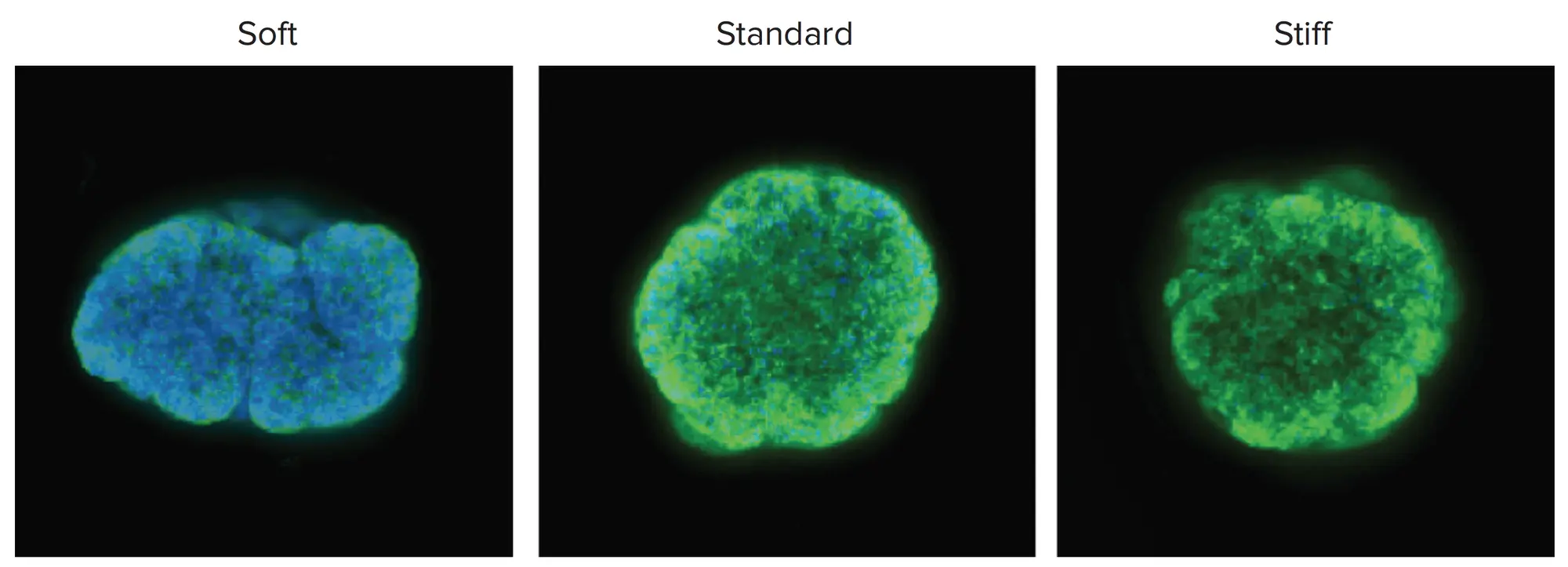
図3. 3種類の硬さのVersaGelで培養したMCF-7スフェロイド スフェロイドの形と大きさに若干の違いがあったが、今後の実験では標準的なゲルの硬さを選択しました。
EarlyToxアッセイキットを用いたスフェロイドに対する化合物の影響試験
U2OS骨癌スフェロイドの生存率を測定するために、EarlyTox™ Live/Deadアッセイキットを使用した。生きた予備形成スフェロイドをVersaGel中で架橋した後、さらに2日間増殖させ、その後48時間化合物で処理しました。スフェロイドは、2D細胞培養に通常使用される2倍の色素濃度で染色し、2倍の時間インキュベートしました。QuickIDを用いてスフェロイドを同定し、死染色(赤)と比較した生染色(緑)の有無を測定しました(図4A)。結果(図4B)により、SymphonyおよびVersaGelプラットフォームと予め形成されたスフェロイドの使用が、EarlyTox Live/Deadアッセイキットに適合することが確認されました。
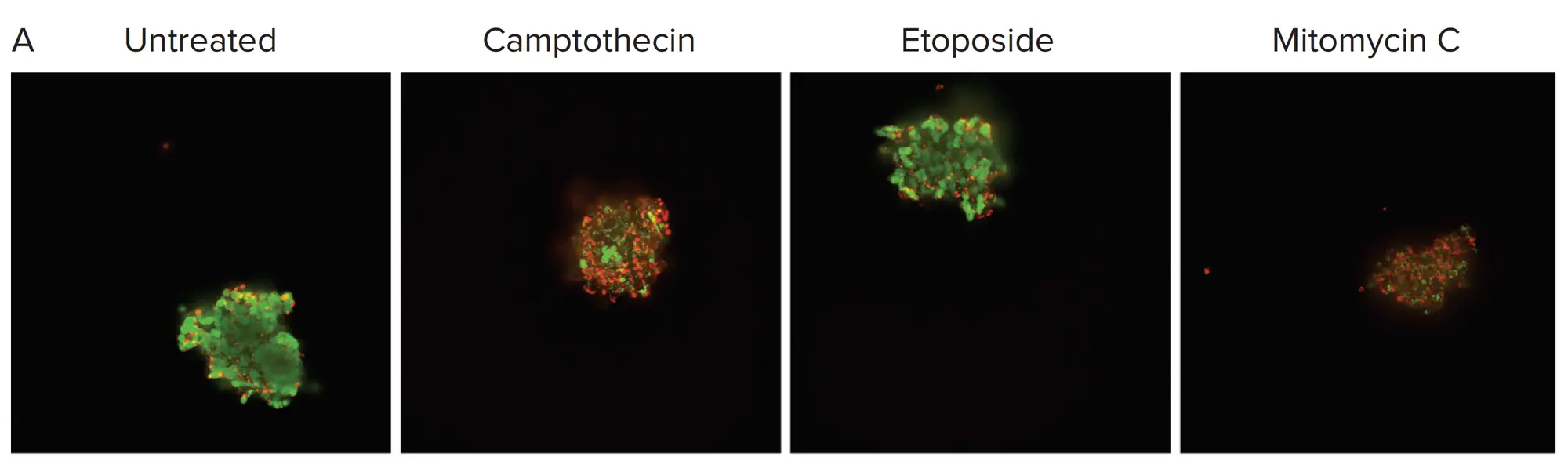
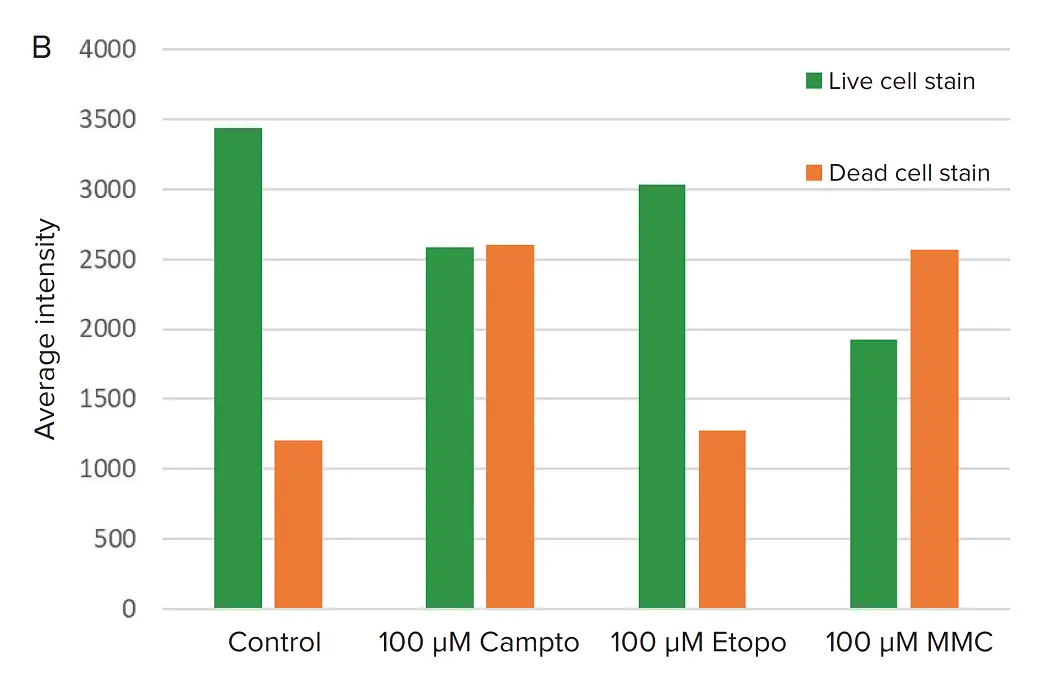
図4. EarlyTox Live/DeadアッセイキットはVersaGel中のスフェロイドに適合します A) あらかじめ形成したU2OSスフェロイドを3種類の化合物で48時間処理しました。B) 毒性は、生きた染色(緑)と死んだ染色(赤)の存在によって測定されました。癌スフェロイドは各化合物に対して予想通りの反応を示しました。
次に、標準的な VersaGel で培養した HCT-116 結腸癌スフェロイドを用い、EarlyTox™ Caspase 3/7 アッセイキットを用いました。スフェロイドを3種類の化合物で48時間処理し、QuickIDを用いてアポトーシス核(緑色)の存在を同定・測定しました(図5)。分析の結果、化合物に対する予想通りの反応が示され、EarlyTox Caspase 3/7 NucView 488アッセイキットとSymphonyおよびVersaGelプラットフォームとの適合性が確認されました。
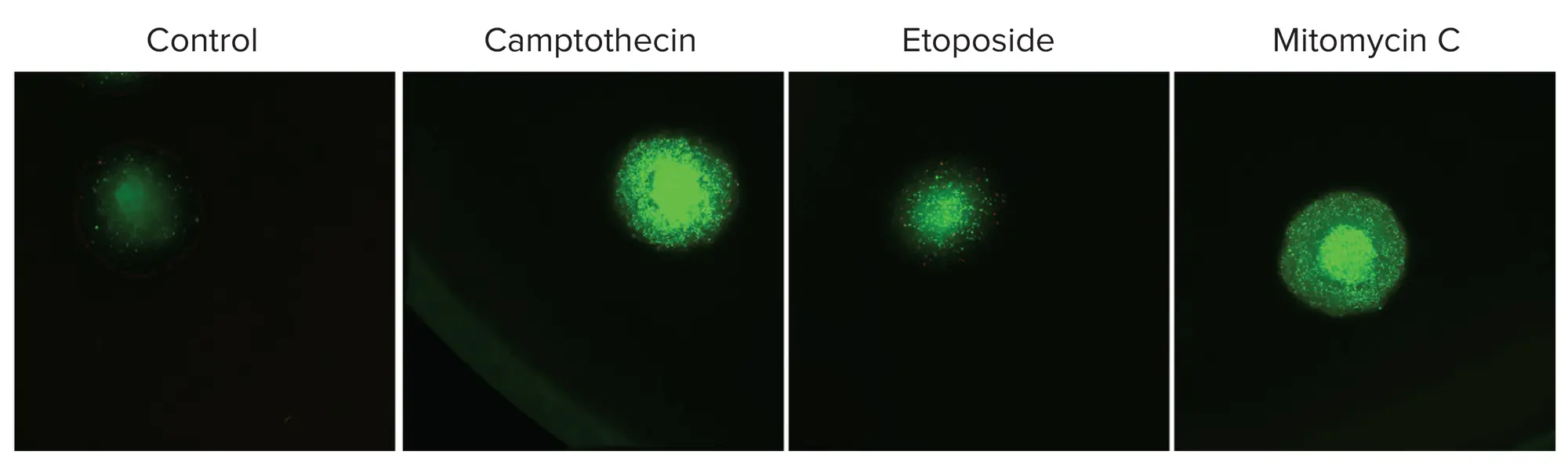
図5. EarlyTox アポトーシスアッセイは VersaGel に適合します あらかじめ形成したHCT-116スフェロイドを3種類の化合物で48時間処理し、アポトーシス核(緑色)の存在により細胞毒性を測定しました。
2D投影の解析でも3D解析と同じ結論が得られました
MetaXpress®ソフトウェアを用いて、HCT-116スフェロイドのアポトーシスを2D解析と3D解析で比較しました。スフェロイドをVersaGelに浮遊させ、複数のz平面を取得してスフェロイドの深さにわたる画像を収集しました。すべての画像は3D対物レンズを構築するために保存され、単一の2Dベストフォーカス投影画像(図6A)を作成するためにも使用されました。
アポトーシスをEarlyTox Caspase 3/7 NucView 488アッセイキットを用いて測定し、2D投影の解析を3D対物レンズの解析と比較しました。グラフ解析により、2Dおよび3D解析の両方を用いて、エトポシド処理がHCT-116細胞のアポトーシスを増加させることが示されました(図6B)。
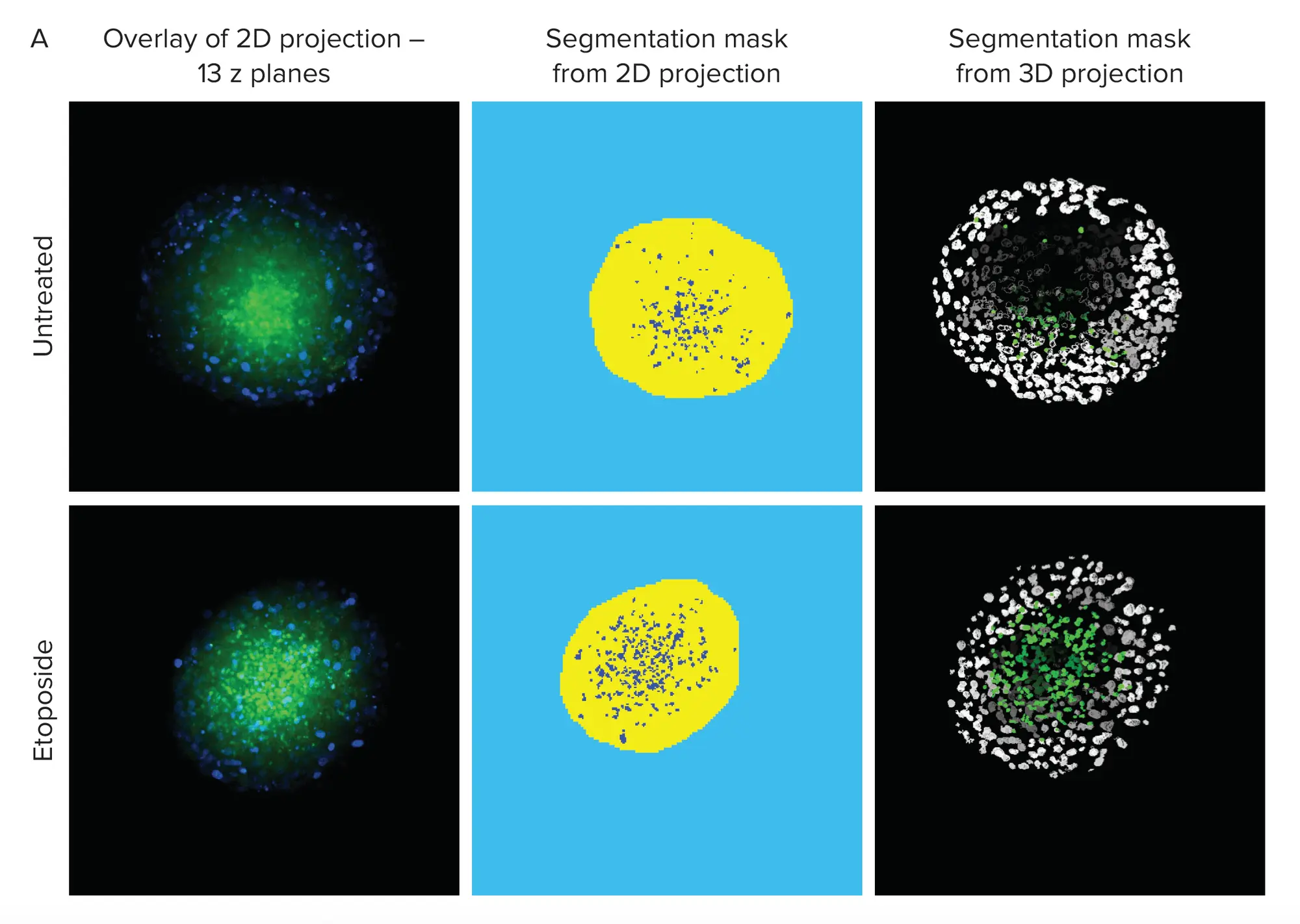
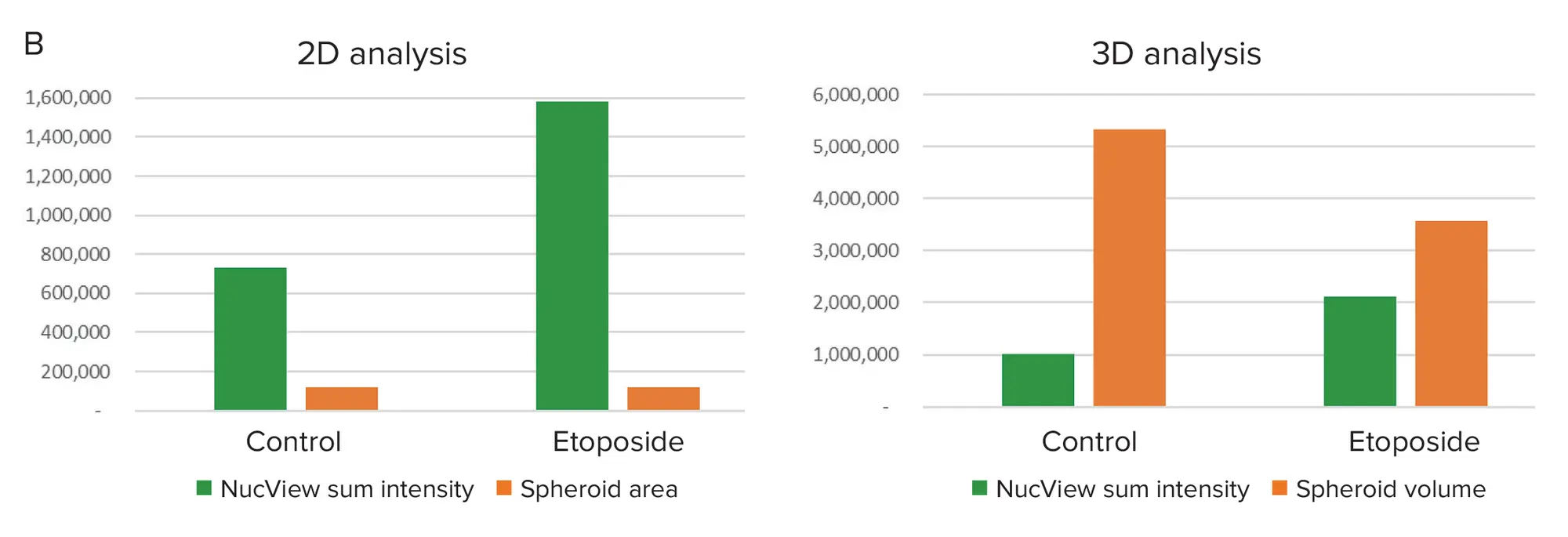
図6. 2D解析と3D解析の比較 A. 左図はアポトーシスマーカー(緑)と核(青)で染色したベストフォーカス画像の重ね合わせ。中央の画像は、緑色のアポトーシス細胞をロイヤルブルーでセグメンテーションした2D画像の解析結果のセグメンテーションマスク。右は3D対物レンズのセグメンテーションマスクで、Hoechst核はモノクロ、NucView 488陽性細胞は緑で擬似着色されています。B. NucView 488強度の測定は、エトポシド処理細胞におけるアポトーシスの増加を示しています。3D解析により、2D投影の解析では明らかでなかった処理細胞のスフェロイド体積の減少が明らかになりました。
結論
Symphonyと VersaGel は、ImageXpress Micro Confocal システムと組み合わせることで、3D スフェロイドアッセイに優れたイメージング品質を提供するシンプルな 3D 培養プラットフォームです。このプラットフォームは非常に汎用性が高く、がんや肉腫などの腫瘍に関する医学の研究に理想的であります。あらかじめ形成されたスフェロイドをVersaGelに移植することも、マイクロプレート内のVersaGel中で直接細胞を培養することもできます。VersaGelの硬さは、最適なスフェロイド培養のために調整することができます。
QuickIDはプロセスを合理化するため、標準的なイメージングよりもはるかに短時間で画像を取得し、保存の必要性を減らすためにはるかに少ない画像を生成します。さらに、MetaXpress画像解析ソフトウェアは、細胞画像を重ね合わせ、3D対物を構築し、画像を解析用の単一の2Dプロジェクションに折り畳み、陽性細胞をセグメンテーションする機能により、3D細胞解析ワークフローを簡素化します。
この実験により、SymphonyおよびVersagel 3DアッセイとImageXpress Micro Confocalシステムの組み合わせは、薬剤スクリーニングを次のレベルに引き上げることができる、多用途で強力なソリューションであることが示されました。
PDF版(英語)