Application Note 3D環境における免疫細胞移動の可視化
ハイコンテントイメージング
- ハイコンテントイメージングに対応し、容易にスケールアップ可能な複雑な細胞移動アッセイを作成します
- 免疫細胞の動態を定量的に評価し、セルカウントや細胞移動距離などのハイスループットなリードアウトを生成します
PDF版(英語)
はじめに
Angeline Lim, PhD | Applications Scientist | モレキュラーデバイス
Oksana Sirenko, PhD | Sr. Applications Scientist | モレキュラーデバイス
Thomas Olivier | Bioinformatics Engineer | MIMETAS
Johnny Suijker | Scientist | MIMETAS
細胞移動は、初期胚発生や免疫細胞応答など、多くの生物学的現象に不可欠なプロセスです。炎症時には、血管系を介して炎症部位へT細胞をリクルートすることが重要な要素となります。これらのT細胞は、TNFαやIFN-γなどの炎症性サイトカインやケモカイン濃度勾配といったさまざまな因子によってリクルートされます。リクルート後、T細胞は血管内皮に接着し、血管壁を越えて炎症組織へ移動する必要があります。このプロセスは、経内皮移動(transendothelial migration:TEM)と呼ばれます。TEMには、生体組織の複雑な3D環境をうまくナビゲートし、細胞外マトリックス(ECM)のリモデリングや特定の細胞適応を介して密な構造を通過することが含まれます。
本研究では、MIMETAS社のOrganoPlate® 3-Lane 40を用いて、灌流条件下で血管構造と組み合わせたT細胞動態を研究するためのin vitroアッセイを開発しました。ヒト初代T細胞を血管内腔に添加し、さまざまな因子の有無において、隣接するECMへの浸潤および移動を評価しました。細胞移動は、複数のタイムポイントでハイコンテントイメージングにより観察しました。ここでは、炎症性サイトカインの濃度に応答して経内皮移動を行う細胞数を定量化するために使用したイメージングおよび解析手法について説明します。
材料
- OrganoPlateプラットフォーム(MIMETAS)
- 内皮細胞源
- CD3+ T細胞
- AIM V培地(Invitrogen)
- コラーゲン I 5 mg/mL (AMSbio Cultrex 3D collagen I rat tail, 5 mg/mL)
- 1M HEPES(Life Technologies)
- 37g/L NaHCO3(Sigma)
- PBS(Sigma)
- CellTracker Orange CMRA (Invitrogen)、CellTracker Orange CMRA (Invitrogen)
- CD3/CD28 Human T-activators DynaBeads (Gibco)
- TNFα(R&Dシステムズ)
- ケモカイントリガー
- ImageXpress Micro Confocalハイコンテントイメージングシステム(モレキュラーデバイス)
- MetaXpressハイコンテント画像取得・解析ソフトウェア、バージョン6.6 (モレキュラーデバイス)
方法
モデル
灌流条件下で血管構造と組み合わせたT細胞動態を評価するため、OrganoPlate 3-Lane内で内皮血管を構築しました。内皮細胞は、コラーゲンI ECMに対してトップ灌流チャネルに10,000 cells/chipの密度で播種しました。接着後、灌流条件下で培養し、灌流チャネル内に3Dマイクロ血管を形成しました。炎症状態は、炎症性サイトカインTNFαを濃度依存的に添加することで模倣し、経内皮移動に関与する内皮の接着特性を誘導しました。このモデルでは、OrganoPlate 3-Laneのボトムチャネルにケモカインを添加することでケモカイン濃度勾配を形成しました。CD3+ T細胞は、CD3/CD28ヒトTアクチベータDynabeadsを用いて48時間刺激または非刺激とし、セルトラッカーで標識して、内皮血管から隣接するECMへの浸潤をライブトラッキングしました。
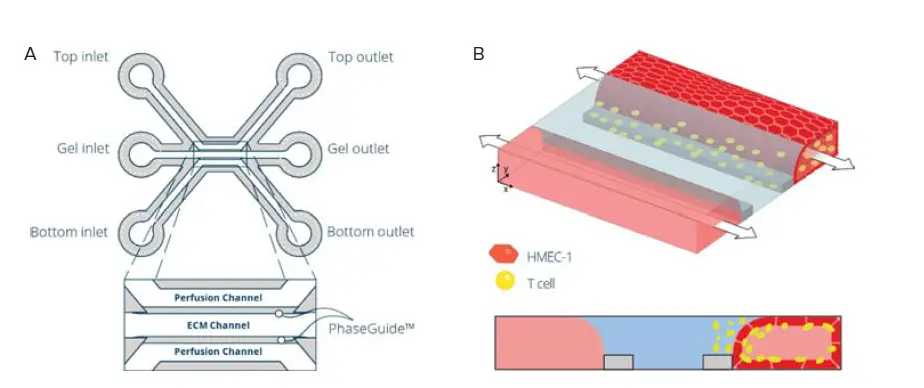
図1. OrganoPlateにおけるT細胞灌流内皮オンチップモデルの構築。A)OrganoPlate® 3-Lane 40の40個のマイクロ流体チップのうち1つを示す模式図。3つのチャネル(2つの培地灌流チャネルと中央のゲルチャネル)はPhaseguides™で分離され、中央の観察ウィンドウ(OW)ウェルで合流します。B)免疫細胞灌流内皮オンチップモデルを構築するための播種戦略の模式図。
実験セットアップ
CD3+ T細胞は培養し、ヒトTアクチベータDynabeadsを用いて48時間刺激または非刺激としました。
イメージングと解析
T細胞の浸潤と配置の画像は、ImageXpress® Micro Confocalシステム(モレキュラーデバイス)を用いて定期的に取得しました。10xエア対物レンズ(0.45NA)と60μm Nipkowスピニングディスクを使用し、蛍光画像のZスタックを0.69×0.69×3μm/pixel(XYZ)の解像度で取得しました。スタックはZ軸に沿って投影し、最大輝度投影(MIP)を作成しました。
すべての画像は、MetaXpressソフトウェア(Version 6.6、モレキュラーデバイス)のカスタムモジュールエディタ(CME)を用いて構築したカスタマイズプロトコールで解析しました(図3)。CMEにはCount Nucleiアプリケーションモジュールが含まれ、T細胞はサイズと背景レベルを超える強度に基づいて識別されました。ECMチャネル内に存在する集団を特定するため、一連のフィルタリングステップを使用しました(図2)。ECMチャネルの正確な位置は、プレート間およびプレートローディングのばらつきを補正するため、各実験で定義しました。
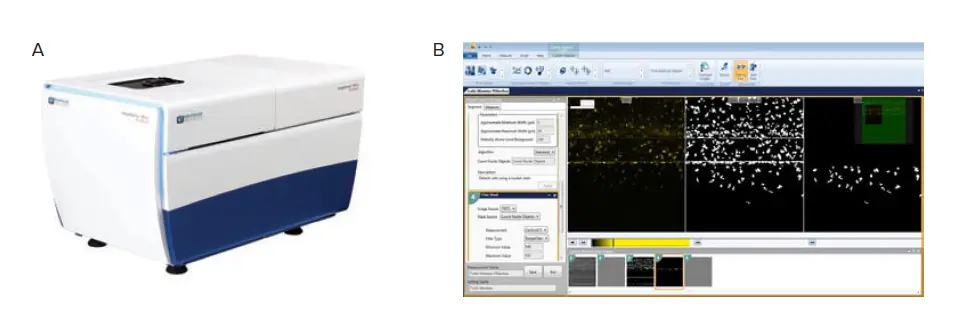
図2. 画像取得と解析ワークフロー。A)ImageXpress Micro Confocalハイコンテントスクリーニングシステム(モレキュラーデバイス)。B)MetaXpressカスタムモジュールエディタのGUI。画像処理ステップは左側に定義され、現在のステップの画像と結果のプレビューが右側に表示され、下部には全ワークフローのサムネイルが表示されます。
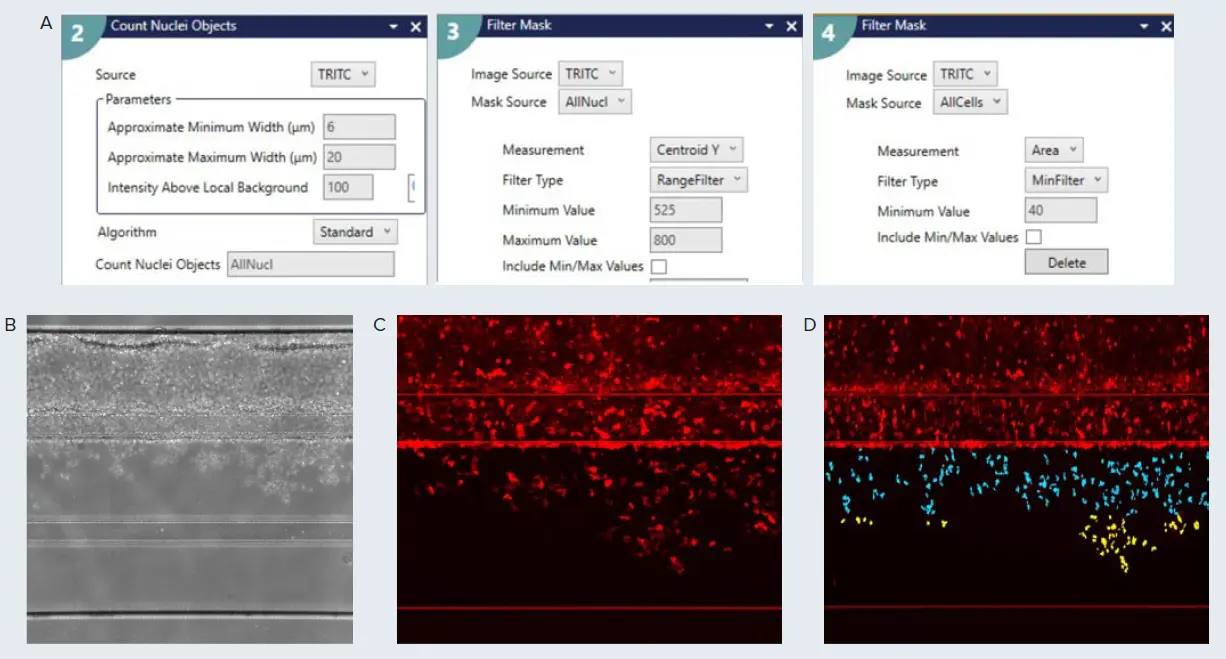
図3. ハイスループット画像解析のためのカスタムモジュールエディタ設定。A)T細胞集団を識別するために使用した主要なステップを示します。Count Nucleiアプリケーションモジュールを使用して、画像内のすべての細胞を検出しました。得られた画像は、位置(Centroid Y)と面積でフィルタリングされ、ECMチャネル内の細胞をより正確に識別しました。必要に応じて、追加の位置フィルタリングを使用して、ボトムチャネルへの移動の程度を分類できます。セルカウント、面積、強度、形状係数などの特定の測定値は、Measurement選択設定タブから利用できます。B)内皮血管とCD3+ T細胞の位相差画像。C)前サンプルのCy5蛍光シグナルの拡大画像。D)CME解析結果で、ECM内のCD3+ T細胞集団のセグメンテーションオーバーレイを示します。ティール色の細胞はECMチャネルの上半分に存在し、黄色の細胞はECMチャネルの下半分に存在します。画像は、セグメンテーション処理で誤って検出される可能性のあるイメージングアーティファクトを確認します。
結果
経内皮移動(TEM)は、非刺激および刺激したCD3+ T細胞の両方で観察されました。時間依存的な効果は両条件で確認されましたが、非刺激条件ではより微妙な傾向を示しました(図4Bおよび4C)。刺激条件では、24時間タイムポイントでTEMの増加はほとんど見られませんでしたが、非刺激条件ではTNFα処理による濃度依存的な効果が24時間および48時間タイムポイントで観察されました。48時間タイムポイントでのTEMの総量は、刺激したT細胞条件で非刺激条件よりも有意に大きくなりました。TEMの総量は、非刺激条件ではTNFαによる効果、刺激条件では刺激プロセスによって駆動されていると考えられます。
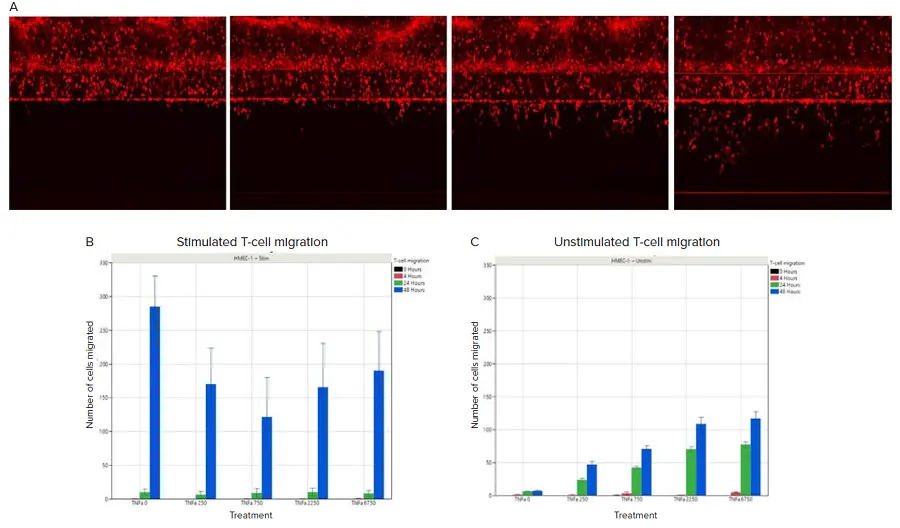
図4. TNFα処理に応答した刺激あり/なしのT細胞移動。A)Cell Trackerで標識した非刺激T細胞の0時間、4時間、24時間、48時間のTNFα処理後の画像。時間経過に伴い、内皮細胞バリアの反対側に存在する細胞数の増加が観察されました。B)TNFα処理に応答した刺激T細胞の移動の定量化。C)TNFα処理に応答した非刺激T細胞の移動の定量化。TNFαの量はx軸にpg/mLで示されています。
結論
本研究では、ハイスループットマイクロ流体プラットフォームを用いて、新しい3D T細胞浸潤および移動アッセイを開発しました。ハイコンテント顕微鏡を使用することで、異なる条件下で個々のT細胞の移動挙動を正確にマッピングし、評価できます。この移動アッセイは、フロー下でのT細胞の内皮血管への接着および血管壁から下層組織への浸潤を捉えます。このアッセイは人工膜に妨げられず、3D ECM様スキャフォールドや多細胞共培養の存在を可能にし、in vivo条件を模倣するために重要な要件を満たします。私たちは、このアッセイがT細胞の移動挙動に関する現在の理解を深め、免疫腫瘍学や自己免疫分野における新しい治療法の開発を促進すると考えています。
PDF版(英語)